Introduction
Chronic kidney disease (CKD) is highly prevalent worldwide. Na China, quase 1 em cada 10 pessoas tem algum grau de disfunção renal, totalizando quase 150 milhões de pacientes (1). Anemia e hiperparatiroidismo secundário são as duas complicações mais comuns associadas ao CKD (2, 3). De fato, tem sido relatado que quase 90% dos pacientes com CKD avançada (classificados como estágio 4 e 5 de CKD) sofrem de anemia (4). O início e a gravidade da anemia têm se mostrado bem correlacionados com o declínio na taxa de filtração glomerular (4). A identificação precoce, avaliação e tratamento da anemia pode diminuir a morbidade e mortalidade, assim como melhorar a qualidade de vida, em pacientes com DTC.
O hiperparatiroidismo secundário é caracterizado por níveis elevados de hormônio paratireoidiano (PTH) sérico. O excesso de PTH pode prejudicar a eritropoiese, exercendo um efeito tóxico directo nas células progenitoras da eritróide e um efeito indirecto através da indução da fibrose da medula óssea (5, 6). Além disso, a baixa concentração de hemoglobina em pacientes urêmicos pode ter resultado de um aumento na fragilidade osmótica dos eritrócitos devido à alta concentração de PTH (7). Foi estabelecida uma correlação inversa entre os níveis de PTH e de hemoglobina (8-10). Meytes et al. descobriram que concentrações de PTH dentro de 7,5-30 U/mL, que é comparável aos níveis séricos de PTH em pacientes urêmicos, induziram a inibição significativa do crescimento da unidade formadora de rompimento, a unidade de crescimento da medula óssea murina (BFU-E), sugerindo um possível caminho para o envolvimento do excesso de PTH na gênese da anemia da uremia (11).
Erythropoiesis-stimulating agents (ESAs) tornaram-se uma marca registrada da terapia de anemia em pacientes com CKD e são a medicação mais comumente prescrita em pacientes de diálise, com utilização de >95% na China (1). A primeira eritropoietina humana recombinante, epoetina-alfa, foi licenciada nos Estados Unidos em 1988 (12). A epoetina-alfa e a epoetina-beta são agentes terapêuticos de curta duração e de baixo custo e são administrados – uma a três vezes por semana na maioria dos pacientes com DRC. Entretanto, sua dosagem aumenta com um intervalo de dosagem prolongado para atingir ou manter um nível alvo de hemoglobina. Epiao®(3,000 μ/tubo) é uma espécie de Epoetina-alfa muito utilizada na China, enquanto que Recormon®(2,000 μ/tubo) é uma espécie de Epoetina-beta mais utilizada na Europa, e tem sido usada na China há aproximadamente 4 anos.
Os resultados de estudos clínicos recentes mostraram que doses que atingem metas altas de hemoglobina levantaram preocupações com o aumento do risco de morte ou desfechos adversos, como eventos tromboembólicos e acidentes vasculares cerebrais (13-16). Andrews et al. descobriram que uma frequência de dose elevada a um nível de dose elevado aumentou a incidência de toxicidade trombótica em comparação com animais dosados com menos frequência em grupos de dose mais baixa, apesar de um hematócrito igualmente elevado em todos os grupos (17), sugerindo que um hematócrito elevado não é o único factor causal que leva a toxicidade relacionada com a ESA, mas também está associado com o nível de dose, frequência de dose e duração da dose. Assim, toxicidade relacionada ao ESA independente do hematócrito elevado deve ser dada muita atenção.
No momento, há poucos dados disponíveis sobre a possível relação entre a dose de ESA e PTH em pacientes urêmicos mantidos em hemodiálise regular. Este estudo retrospectivo teve como objetivo investigar a associação entre a dose de ESAs e os níveis intactos de iPTH (iPTH) em pacientes em hemodiálise com base em dados clínicos em nosso sistema de banco de dados computadorizado do hospital.
Materiais e Métodos
Patientes e Procedimentos
Este estudo retrospectivo de coorte foi realizado de fevereiro de 2015 a maio de 2015 no Hospital Xiamen Zhongshan, Universidade de Xiamen, China. Este estudo incluiu pacientes urêmicos em hemodiálise mantida por pelo menos 3 meses, que usaram ESAs para o tratamento de anemia. Foram excluídos do estudo os pacientes que preenchiam os seguintes critérios: (1) idade <18 anos; (2) pacientes com infecção ativa, malignidade, anemia por deficiência de ferro (definida como ferritina <100 ng/mL e saturação <20%), ou sangramento ativo em 3 meses; (3) pacientes com dados incompletos. Os pacientes elegíveis foram categorizados em dois grupos, com base no ESA utilizado: Grupo Recormon e grupo Epiao.
Recolha de dados
Dados foram obtidos de Jinshida, o sistema de banco de dados computadorizado do Hospital Xiamen Zhongshan, que recodificou os dados clínicos de 376 pacientes com hemodiálise. Foram coletados os seguintes dados: idade, sexo, peso seco, diagnóstico de doenças primárias, nitrogênio uréico no sangue (BUN), creatinina sérica (Scr), hemoglobina, cálcio, fósforo, albumina, iPTH, ferritina sérica, saturação de transferrina e dosagem de ESAs. Estes dados foram medidos pela manhã, no dia da hemodiálise (antes da diálise). De acordo com as diretrizes da Kidney Disease Improving Global Outcomes (KDIGO), o nível normal de hemoglobina foi definido como níveis entre 110 e 130 g/L em pacientes uremicos com hemodiálise mantida (8). Os valores de referência para cálcio sérico e fósforo foram definidos como valores entre 2,1-2,54 e 1,1-1,78 mmol/L, respectivamente (18). Os pacientes foram ainda classificados com base nos níveis de iPTH: 150, 300, 600 e 1.500 pg/mL (19, 20).
Estudo Ética
Este estudo foi realizado através da análise dos dados retrospectivos obtidos do Sistema de Registro Eletrônico de Pacientes de nosso hospital. O protocolo do estudo sobre pesquisa em humanos foi aprovado pelo Comitê de Ética do Hospital Zhongshan, da Universidade de Xiamen. O consentimento livre e esclarecido por escrito foi obtido de todos os sujeitos.
Análise estatística
Análise estatística foi realizada utilizando o software SPSS for Windows versão 17.0. Os dados foram expressos em porcentagem ou média ± Erro Padrão de Média (SEM). Os dados demográficos e medidas laboratoriais entre os grupos foram comparados pelo teste do qui-quadrado de Pearson, teste exato de Fisher, ou correção de Yate para continuidade. Um valor de P <0,05 foi considerado estatisticamente significativo.
Resultados
Características de Pacientes Urêmicos Mantidos em Hemodiálise Regular
Um total de 240 pacientes urêmicos mantidos em hemodiálise regular foram incluídos neste estudo. As características básicas dos pacientes são mostradas na Tabela 1. Não houve diferenças significativas em idade, sexo, peso seco, doenças primárias, BUN, Scr, hemoglobina, fosfato sérico, cálcio, albumina, ferritina sérica e saturação da transferrina entre os grupos Recormon e Epiao (Tabela 1, P > 0,05).

Tábua 1. Características básicas dos pacientes.
O nível médio de hemoglobina de todos os sujeitos foi 103,15 ± 1,07 g/L. Os pacientes com níveis de hemoglobina entre 110 e 130 g/L foram responsáveis por 30,4% (n = 84). A anemia foi dividida em cinco classes com base no nível de hemoglobina, de acordo com a gravidade da anemia (21, 22): nível de hemoglobina <60 g/L (2,1%, n = 5), nível de hemoglobina ≥60 e <90 g/L (21,7%, n = 52), nível de hemoglobina ≥90 e <110 g/L (38.7%, n = 93), nível de hemoglobina ≥110 e <130 g/L (30,4%, n = 73), e nível de hemoglobina ≥130 g/L (7,1%, n = 17).
Relação entre o Grau de Anemia e iPTH
A relação entre os diferentes graus de anemia e iPTH foi analisada. Os resultados revelaram que o nível de hemoglobina foi associado negativamente com iPTH (Figura 1A; Tabela 2; P < 0,05). Entretanto, não foi encontrada associação significativa entre anemia e nível sérico de cálcio ou fósforo (Figura 1B; Tabela 2; P > 0,05 para ambos).
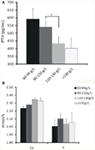
Figura 1. A relação entre as concentrações de hemoglobina e os níveis de iPTH, cálcio ou fósforo no soro. (A) A concentração de hemoglobina aumentou à medida que o nível de iPTH diminuiu com a estratificação. (B) Não foi encontrada associação significativa entre a concentração de hemoglobina e o nível sérico de cálcio ou de fósforo. Os dados foram calculados pelo teste t. *P < 0,05.

Tábua 2. Medidas dos níveis séricos de cálcio, fósforo e iPTH com base nos valores de hemoglobina por estratificação.
Pacientes com 150-300 pg/mL de iPTH tinham os níveis mais altos de hemoglobina, ferritina sérica e saturação da transferrina
Quando o nível de iPTH estava entre 150-300 pg/mL, os pacientes com hemodiálise tinham os níveis médios mais altos de hemoglobina, ferritina sérica e saturação da transferrina; que eram 106.25 g/L, 248,98 μg/L, e 30,97%, respectivamente (Figura 2).
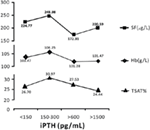
Figura 2. Os pacientes com níveis de iPTH entre 150-300 pg/mL apresentaram os níveis mais altos de hemoglobina, ferritina sérica e saturação da transferrina. Os dados são expressos em percentagem ou média ± SEM.
Comparação de Recormon vs. Epiao no Tratamento da Anemia
Patientes tratados com Recormon e Epiao tinham níveis semelhantes de hemoglobina (103,54 ± 1,72 g/L, n = 98 vs. 102,59 ± 1,38 g/L, n = 142, P > 0,05; Figura 3A). Entretanto, a dosagem de Recormon (3.853,66 ± 225,13 μ/semana, n = 98) para o tratamento da anemia foi significativamente menor que Epiao (7.083,33 ± 264,93 μ/semana, n = 142, P < 0,05; Figura 3B, Tabela 1).
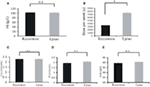
Figura 3. Comparação de Recormon vs. Epiao no tratamento da anemia. (A) Os pacientes tratados com Recormon e Epiao tinham níveis similares de hemoglobina (103,54 ± 1,72 g/L, n = 98 vs. 102,59 ± 1,38 g/L, n = 142, P > 0,05). (B) A dosagem de Recormon para o tratamento da anemia foi significativamente menor que Epiao, 3.853,66 ± 225,13 μ/semana, n = 98 vs. 7.083,33 ± 264,93 μ/semana, n = 142. (C-E) Não houve diferenças significativas nos níveis de cálcio (C), fósforo (D) e albumina (E) entre os grupos Recormon e Epiao. Os dados foram calculados pelo teste t; P > 0.05.
Níveis séricos de cálcio, fósforo e albumina não foram significativamente diferentes entre os grupos Recormon e Epiao (respectivamente, 2.27 ± 0,47 vs. 2,29 ± 0,01 mmol/L, P > 0,05; 1,94 ± 0,10 vs. 2,06 ± 0,04 mmol/L, P > 0,05; 39,5 ± 0,44 vs. 40,2 ± 0.35 g/L, P > 0,05; Figuras 3C-E; Tabela 1).
A Relação entre as Doses de ESAs e níveis de iPTH
Para todos os pacientes em hemodiálise, os níveis de iPTH no grupo Recormon foram inferiores aos do grupo Epiao (336.66 ± 57,76 pg/mL, n = 98 vs. 531,05 ± 39,57 pg/mL, n = 142; P < 0,05; Figura 4A; Tabela 1). Uma tendência similar foi encontrada em pacientes com níveis de hemodiálise entre 110 e 130 g/L (319,50 ± 74,9 pg/mL no grupo Recormon, n = 28 vs. 499,5 ± 64,38 pg/mL no grupo Epiao, n = 45; P < 0,05; Figura 4A).
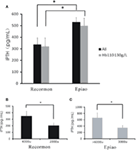
Figura 4. A associação entre a dose de ESAs e os níveis de iPTH. (A) O nível de iPTH nos grupos Recormon e Epiao. (B) No grupo Recormon, os níveis de iPTH em pacientes tratados com Recormon em 2.000 vs. 4.000 μ/semana. (C) No grupo Epiao, os níveis de iPTH em pacientes tratados com Epiao em 3.000 e >6.000 μ/semana. Os dados foram calculados pelo teste t; *P < 0,05.
Em pacientes com níveis de hemoglobina entre 110 e 130 g/L, o nível de iPTH foi 201,54 ± 42.67 pg/mL (n = 10) em pacientes tratados com Recormon a 2.000 μ/semana, que foi significativamente inferior aos pacientes tratados com Recormon a 4.000 μ/semana (348,16 ± 117,9 pg/mL, n = 13; P < 0,05, Figura 4B). Similarmente, o nível médio de iPTH em pacientes tratados com Epiao em 3.000 μ/semana foi significativamente menor do que em pacientes tratados com Epiao >6.000 μ/semana (347,15 ± 75,94 pg/mL, n = 12 vs. 661,01 ± 198,45 pg/mL, n = 27; P < 0,05, Figura 4C).
Discussão
Este estudo retrospectivo é o primeiro a fornecer evidências de que doses mais elevadas de ESAs (Epoetin-alfa e -beta) podem estar associadas a níveis mais elevados de iPTH em pacientes urêmicos mantidos em hemodiálise regular. Além disso, encontramos que pacientes com níveis de iPTH entre 150-300 pg/mL tiveram os níveis mais altos de hemoglobina, ferritina sérica e saturação de transferrina, o que foi consistente com o nível recomendado de iPTH baseado nas diretrizes KDIGO (9).
A anemia é uma das complicações mais comuns da CKD. A Organização Mundial da Saúde definiu anemia como tendo uma concentração de hemoglobina inferior a 13,0 g/dl em homens e mulheres pós-menopausa, ou uma concentração de hemoglobina <12,0 g/dL em outras mulheres. O uso de ESAs melhorou acentuadamente a vida de muitos pacientes anêmicos com CKD. No entanto, foi demonstrado que altas doses de ESAs têm sido associadas com o aumento do risco de resultados adversos em adultos e crianças com CKD. Os pacientes tratados com altas doses de ESA têm um risco 1,2-1,5 aumentado de mortalidade (23). Neste estudo, encontramos uma associação inversa significativa entre os níveis de iPTH e as concentrações de hemoglobina em pacientes em hemodiálise tratados com ESAs, o que é consistente com resultados de estudos anteriores (8-10).
Neste estudo, pacientes dos grupos Recormon e Epiao apresentaram concentrações semelhantes de hemoglobina; entretanto, a dosagem usada para Recormon foi significativamente menor que Epiao. Verificamos também que o nível de iPTH no grupo Recormon foi significativamente mais baixo do que no grupo Epiao. Para determinar melhor a associação entre a dose de ESAs e os níveis de iPTH, analisamos os dados clínicos dos pacientes tratados com Recormon ou Epiao separadamente. O nível de iPTH foi notavelmente menor nos pacientes tratados com Recormon em 2.000 μ/semana do que nos pacientes tratados com Recormon em 4.000 μ/semana. Uma tendência semelhante foi encontrada em pacientes tratados com Epiao numa dosagem de 3.000 ou 6.000 μ/semana, sugerindo que doses elevadas de ESAs podem estar relacionadas com níveis elevados de iPTH. Estes achados indicam que as toxicidade dos ESA não podem ser explicadas apenas por um hematócrito elevado. Dado que altas doses de ESAs podem estar associadas a altos níveis de iPTH em pacientes em diálise mantida, pacientes com doença renal em estágio terminal podem ser melhor gerenciados minimizando ou retendo a dose de ESAs, especialmente em pacientes com eventos cardiovasculares ou cerebrovasculares recentes, emergências hipertensivas, ou eventos tromboembólicos agudos. De fato, considerando o risco aumentado de eventos cardiovasculares em concentrações quase normais de hemoglobina e altas doses de ESAs na CKD, não é recomendado em Taiwan o uso de doses desproporcionalmente altas de ESAs para atingir um nível de hemoglobina entre 100-110 g/L (24).
Embora a patogênese da anemia na CKD seja multifatorial, a falta de eritropoietina é a principal causa de anemia em pacientes com CKD (25). Outros fatores que contribuem para a anemia associada ao CKD incluem deficiência de ferro, anemia inflamatória, supressão da eritropoiese, encurtamento da sobrevida dos glóbulos vermelhos por toxinas urêmicas e perda de sangue, como hemorragia gastrointestinal. Como a deficiência de ferro também é um fator causal comum da anemia, a suplementação com ferro intravenoso foi incentivada no início de Taiwan, em 1996. Com base na experiência do controle da anemia por CKD em Taiwan, uma meta razoável de hemoglobina pode ser alcançada usando a menor dose possível de ESA e suplementação com ferro intravenoso (24).
O nosso estudo tem várias limitações. Em primeiro lugar, este estudo observacional é um estudo de centro único. Em segundo lugar, dado o potencial de confusão e seleção por indicação, é necessária uma interpretação cuidadosa desses dados. De fato, nossa observação sobre a associação entre iPTH e ESAs requer uma maior exploração através de estudos prospectivos longitudinais. Terceiro, há uma predominância no número de pacientes tratados com Epiao (142 para Epiao vs. 98 para Rocormon), o que provavelmente é devido ao preço relativamente barato de Epiao em comparação com Recormon (Tabela 1). Em quarto lugar, intervenções farmacológicas como agentes anti-hipertensivos podem ter resultado em flutuações transitórias ou mesmo interferência nos níveis de iPTH ou hemoglobina.
Em conclusão, este estudo demonstra que doses mais altas de ESAs podem estar associadas a níveis mais altos de iPTH em pacientes urêmicos mantidos em hemodiálise regular. O envolvimento de doses mais elevadas de ESAs na patogénese do hiperparatiroidismo secundário permanece pouco claro e pode requerer mais investigação. Nossos achados sugerem que o uso da menor dose possível de ESA pode minimizar riscos potenciais, enquanto se atinge uma meta razoável de hemoglobina.
Author Contributions
O manuscrito foi revisado e aprovado por todos os autores, e não está sendo considerado para publicação em outro lugar de forma similar e em qualquer idioma.
Conflict of Interest Statement
Os autores declaram que a pesquisa foi realizada na ausência de quaisquer relações comerciais ou financeiras que pudessem ser interpretadas como um potencial conflito de interesses.
Fundamento
Esta pesquisa foi apoiada pelo Fundo do Programa de Inovação Médica da Província de Fujian (No. 2011027).
A abreviações
BUN, nitrogénio ureico no sangue; CKD, doença renal crónica; ESA, agente estimulante da eritropoiese; Hb, hemoglobina; iPTH, hormona paratiróide intacta; Scr, creatinina sérica.
1. Zhang L, Wang F, Wang L, Wang Wang W, Liu B, Liu J, et al. Prevalência de doença renal crônica na China: uma pesquisa transversal. Lancet (2012) 379:815-22. doi: 10.1016/S0140-6736(12)60033-6
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Martin KJ, Gonzalez EA. Doença metabólica óssea em doença renal crônica. J Am Soc Nephrol (2007) 18:875-85. doi:10.1681/ASN.2006070771
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Rodriguez M, Nemeth E, Martin D. O receptor sensorial de cálcio: um factor chave na patogénese do hiperparatiroidismo secundário. Am J Physiol Renal Physiol (2005) 288:F253-64. doi:10.1152/ajprenal.00302.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Levin A, Thompson CR, Ethier J, Carlisle EJ, Tobe S, Mendelssohn D, et al. Aumento do índice de massa ventricular esquerda na doença renal precoce: impacto do declínio da hemoglobina. Am J Kidney Dis (1999) 34:125-34. doi:10.1016/S0272-6386(99)70118-6
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kwack C, Balakrishnan VS. Gerenciando a hiporesponsividade da eritropoietina. Semin Dial (2006) 19:146-51. doi:10.1111/j.1525-139X.2006.00141.x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Gallieni M, Corsi C, Brancaccio D. Hiperparatiroidismo e anemia na insuficiência renal. Am J Nephrol (2000) 20:89-96. doi:10.1159/000013563
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Wu SG, Jeng FR, Wei SY, Su CZ, Chung TC, Chang WJ, et al. Fragilidade osmótica dos glóbulos vermelhos em pacientes cronicamente hemodialisados. Nephron (1998) 78:28-32. doi:10.1159/000044878
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Baradaran A, Nasri H. Intensificação da anemia por hiperparatiroidismo secundário em pacientes em hemodiálise. Med J Islam Acad Sci (2001) 14(4):161-6.
Google Scholar
9. Sliem H, Tawfik G, Moustafa F, Zaki H. Relação do hiperparatiroidismo secundário associado ao fator de crescimento sérico do fibroblasto-23 na fase final da doença renal: um estudo de caso-controle. Indian J Endocrinol Metab (2011) 15:105-9. doi:10.4103/2230-8210.81939
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Trovato GM, Carpinteri G, Spina S, Squatrito G, Catalano D, Iannetti E. Hiperparatiroidismo, anemia e eritropoietina: efeitos na função sistólica de pacientes em diálise. Resumos do 31º Congresso da European Renal Association/European dialysis ND Transplantation Association, 5-8 de Setembro de 1999 Madrid. Nephrol Dial Transplplantation (1999) 14:190.
Google Scholar
11. Meytes D, Bogin E, Ma A, Dukes PP, Massry SG. Efeito da hormona paratiróide na eritropoiese. J Clin Invest (1981) 67:1263-9. doi:10.1172/JCI110154
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Eschbach JW, Abdulhadi MH, Browne JK, Delano BG, Downing MR, Egrie JC, et al. Recombinante eritropoietina humana em pacientes anêmicos com doença renal em estágio terminal. Resultados de um ensaio clínico multicêntrico fase III. Ann Intern Med (1989) 111(12):992-1000. doi:10.7326/0003-4819-111-12-992
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Besarab A, Bolton WK, Browne JK, Egrie JC, Nissenson AR, Okamoto DM, et al. Os efeitos do normal em comparação com valores baixos de hematócrito em pacientes com doença cardíaca que estão recebendo hemodiálise e epoetina. N Engl J Med (1998) 339:584-90. doi:10.1056/NEJM199808273390903
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Singh AK. Devemos manter os níveis de hemoglobina como uma medida de resultado viável? Nephrol News Issues (2010) 24(15-6):18.
PubMed Abstract | Google Scholar
15. Phrommintikul A, Haas SJ, Elsik M, Krum H. Mortalidade e concentrações alvo de hemoglobina em pacientes anêmicos com doença renal crônica tratados com eritropoietina: uma meta-análise. Lancet (2007) 369:381-8. doi:10.1016/S0140-6736(07)60194-9
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Regidor D, McClellan WM, Kewalramani R, Sharma A, Bradbury BD. Alterações na dosagem do agente estimulante da eritropoiese (ESA) e nos níveis de hemoglobina em pacientes com doença renal crônica não-dialítica nos EUA entre 2005 e 2009. Nephrol Dial Transplant (2011) 26:1583-91. doi:10.1093/ndt/gfq573
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Andrews DA, Pyrah ITG, Boren BM, Tannehill-Gregg SH, Lightfoot-Dunn RM. O hematócrito elevado resultante da administração de agentes estimulantes da eritropoiese não é totalmente preditivo de mortalidade ou toxicidade em espécies pré-clínicas. Toxicol Pathol (2014) 42:510-23. doi:10.1177/0192623313486317
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Doença dos Rins: Melhoria dos Resultados Globais (KDIGO) CKD-MBD Grupo de Trabalho. KDIGO diretriz da prática clínica para o diagnóstico, avaliação, prevenção e tratamento da Doença Renal Crônica-Mineral e Desordem Óssea (CKD-MBD). Kidney Int Suppl (2009) 113:S1-130. doi:10.1038/ki.2009.188
CrossRef Full Text | Google Scholar
19. Tentori F, Blayney MJ, Albert JM, Gillespie BW, Kerr PG, Bommer J, et al. Mortality risk for dialysis patients with different levels of sérico calcium, phosphorus, and PTH: the Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis (2008) 52(3):519-30. doi:10.1053/j.ajkd.2008.03.020
PubMed Abstract | CrossRef Full Text | Google Scholar
20. National Kidney Foundation. K/DOQI clinical practice guidelines for chronic kidney disease: evaluation, classification, and stratification. Am J Kidney Dis (2002) 39(2 Suppl 1):S1-266.
Google Scholar
21. Pisoni RL, Bragg-Gresham JL, Young EW, Akizawa T, Asano Y, Locatelli F, et al. Anemia e resultados de 12 países no Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis (2004) 44(1):94-111. doi:10.1053/j.ajkd.2004.08.005
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Doença dos Rins: Grupo de Trabalho sobre Anemia (KDIGO) Improving Global Outcomes (KDIGO). KDIGO clinical practice guideline for anemia in chronic kidney disease (diretriz de prática clínica para anemia renal crônica). Kidney Int Suppl (2012) 2:279-335.
Google Scholar
23. Suttorp MM, Hoekstra T, Mittelman M, Ott I, Krediet RT, Dekker FW, et al. Tratamento com alta dose de agentes estimulantes da eritropoiese e mortalidade: análise com uma abordagem sequencial de Cox e um modelo estrutural marginal. Pharmacoepidemiol Drug Saf (2015) 24(10):1068-75. doi:10.1002/pds.3855
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Hung SC, Kuo KL, Tarng DC, Hsu CC, Wu MS, Huang T-P. Tratamento da anemia em pacientes com doença renal crônica: Orientações práticas de Taiwan. Nefrologia (Carlton) (2014) 19:735-9. doi:10.1111/nep.12332
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Randolph JF, Scarlett JM, Stokol T, MacLeod JN. Eficácia clínica e segurança da eritropoietina canina recombinante em cães com anemia de insuficiência renal crônica e cães com aplasia de eritropoietina humana recombinante induzida por eritropoietina. J Vet Intern Med (2004) 18:81-91. doi:10.1111/j.1939-1676.2004.tb00139.x
CrossRef Full Text | Google Scholar