
Uma base é qualquer molécula que aceita um próton, enquanto que um ácido é qualquer molécula que liberta um próton. Por esta razão, o amoníaco é considerado básico porque o seu átomo de azoto tem um par de electrões que aceita prontamente um protão. No entanto, o amoníaco é classificado como uma base fraca que é um composto químico que não se desfaz completamente em iões numa solução aquosa. Quando as moléculas se partem em iões, o processo é chamado de dissociação. Isto forma uma estrutura química diferente para se tornar ou uma base fraca ou um ácido forte e vice-versa.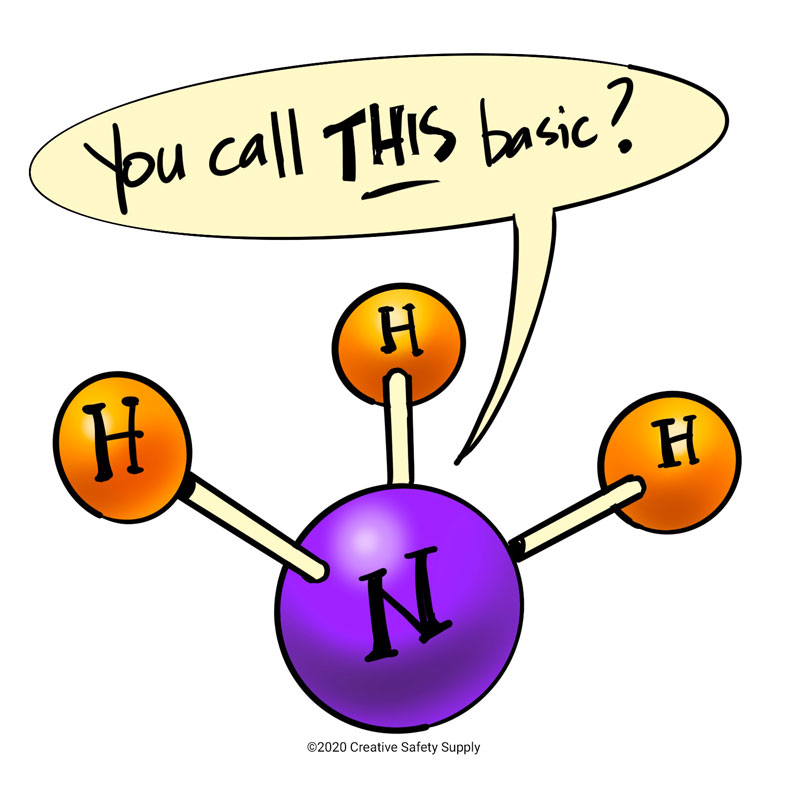
Amoníaco não contém iões de hidróxido para começar, mas quando é dissolvido em água adquire iões de hidrogénio da água para produzir hidróxido, bem como iões de amónio. Contudo, o amoníaco não se converte totalmente em hidróxido e iões de amónio numa solução, razão pela qual é considerado uma base fraca. Quando se desfaz, transforma-se em iões de amónio com carga positiva (NH4+) e iões de hidróxido de amónio com carga negativa (OH-), mas algumas das moléculas de amoníaco ainda estão ligadas entre si. Por causa do facto de que nem todas as moléculas foram quebradas separadas, a dissociação é considerada incompleta como só uma percentagem muito minúscula produziu iões de hidróxido das moléculas de amónia.
Agora, quando as bases ou ácidos são classificados como fortes ou fracos, esta classificação só é significativa em relação a como as concentrações de uma determinada reacção química são determinadas. Não descreve quão reactivas, oxidantes ou cáusticas elas são. As bases fortes podem ser tão cáusticas e perigosas como os ácidos fortes. Tome o amoníaco anidro como exemplo: tem um nível de pH de cerca de 11,6, no entanto, ainda dá às pessoas queimaduras químicas e causa irritação severa às membranas mucosas, à pele e aos olhos, tal como a exposição ao ácido clorídrico (pH de 0) é corrosiva para essas mesmas áreas.