24º Relatório Anual sobre Glaucoma
Seguir os links abaixo para ler outros artigos da atualização anual sobre glaucoma:
Glaucoma Care with Laser Precision
MIGS Madness: Um Atlas de Opções
>
Comanaging Invasive Glaucoma Surgeries
Glaucoma: Estilos de Vida dos Ricos e Famosos Antioxidantes (Ganhe 2 Créditos CE)
Os especialistas ainda não chegaram a um consenso sobre uma etiologia universalmente aceite do glaucoma. No entanto, eles concordam com isto: a redução da pressão intra-ocular (PIO) é o único factor de risco modificável para abrandar a sua progressão. A farmacoterapia tópica é a abordagem tradicional de primeira linha, e as opções são mais abundantes do que nunca.
Este artigo, parte três da nossa série Take Charge of Glaucoma, explora os muitos medicamentos que as Doenças Orais podem empregar, com conselhos sobre quando usar qual terapia para quais pacientes.
Early Autonomics
Medicamentos que agem sobre o sistema nervoso autônomo (ou seja colinérgicos e adrenérgicos) têm sido a base da terapia do glaucoma desde 1800.1,2 Os colinérgicos induzem a miose, que estica e estimula a malha trabecular (MT) para aumentar a saída aquosa para lá e para o canal de Schlemm.3 Membros desta classe incluem pilocarpina, carbachol, fisostigmina, neostigmina e ecotiofato. Destes, apenas o piloto ainda está em uso rotineiro. O tratamento exibe uma resposta relacionada à dose com uma diminuição na PIO de cerca de 20% quando prescrito QID.4
Take Charge of Glaucoma
Seguir os links abaixo para ler outros artigos da nossa série de quatro partes de glaucoma:
Parte Um: Glaucoma: A Primary Care Crusade
Parte Dois: Preparando sua caixa de ferramentas de diagnóstico
Parte Quatro: Tocar uma parte nos Cuidados Pós-Operatórios de Glaucoma
O uso colinérgico e eficaz é limitado pelos seus efeitos secundários oculares e sistémicos. Estes incluem espasmo muscular ciliar (com dor de cabeça associada e miopia induzida), miose, toxicidade da córnea, vermelhidão, uveíte, possível formação de cataratas, depressão respiratória e angústia gastrointestinal. Além disso, os medicamentos mais recentes têm maior eficácia para diminuir a PIO, o que deixa os colinérgicos reservados para casos específicos em que o efeito mioótico pode ter um benefício adicional, como o fechamento do ângulo agudo.
Adrenérgicos agonistas, por outro lado, impactam os receptores alfa ou beta adrenérgicos (ou ambos se não forem seletivos). A epinefrina, o agente primário não-seletivo, reduz a PIO primeiro diminuindo a produção aquosa e depois aumentando a vazão através da TM.5Felizmente, ela tem aplicação limitada devido aos efeitos colaterais sistêmicos significativos. A dipivefrina, um pró-fármaco da epinefrina desenvolvido nos anos 70, permite o uso de concentrações muito mais baixas do composto pai, com menos efeitos sistêmicos.6 Adrenérgicos não-seletivos vêem uso mínimo hoje, exceto em casos onde outras drogas podem estar contra-indicadas.
>
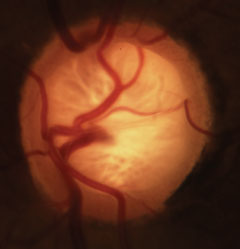
Cúpula glucomatosa com perda característica de borda neuroretorial, lâmina e alteração da vasculatura. Clique na imagem para ampliá-la.
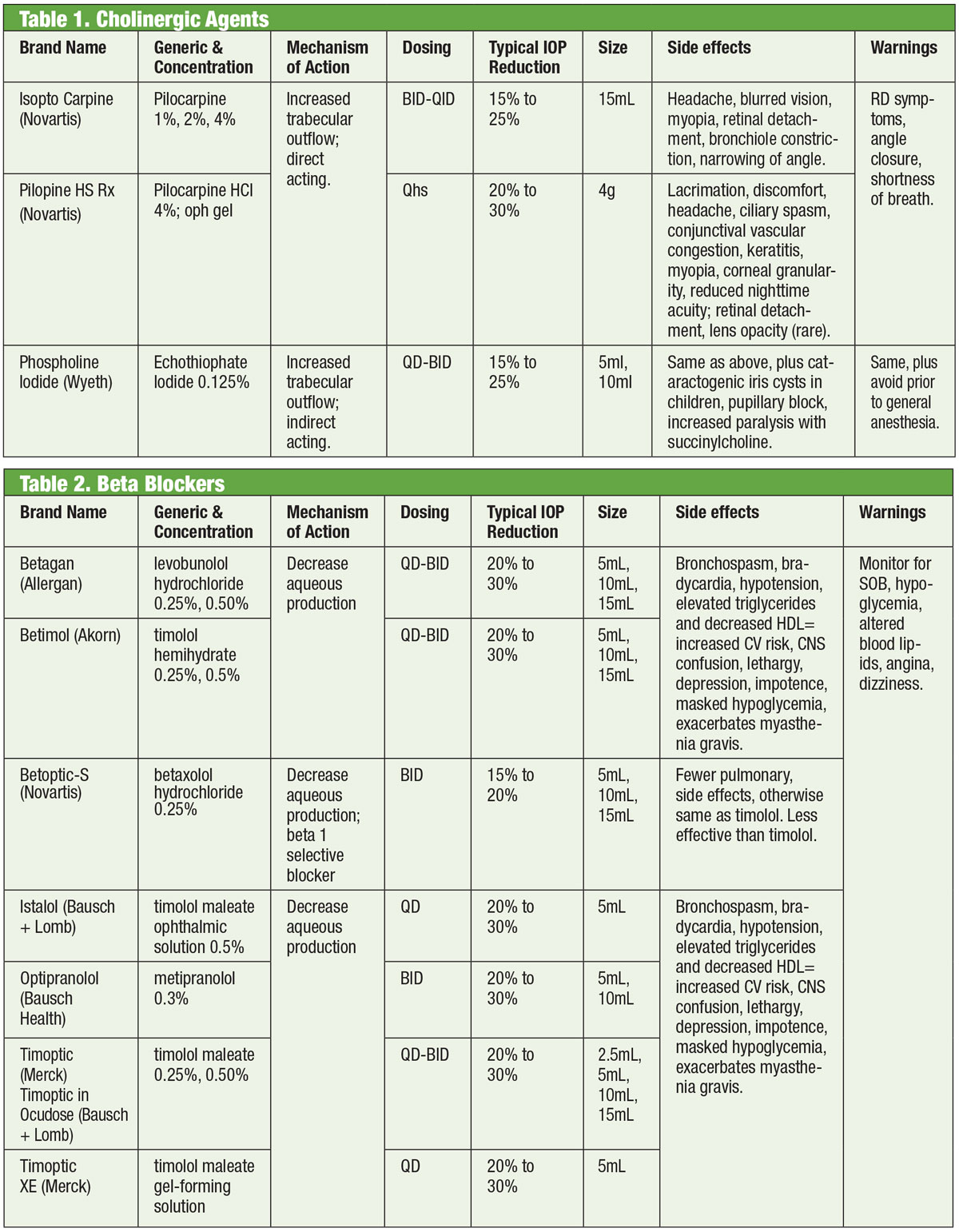
Beta Blockers
Antagonistas adrenérgicos, ou beta (β)-bloqueadores, inibem a produção aquosa e representam o padrão pelo qual os novos medicamentos são comparados. Especificamente, os bloqueadores β reduzem a ultrafiltração, o que limita a disponibilidade de substrato de humor aquoso disponível para transmissão para a câmara posterior.1,7,8 Esses medicamentos podem ser não-seletivos, ou seja, inibem ambas as isoformas dos receptores adrenérgicos β (β1 e β2), ou cardioseletivos, que têm muito mais afinidade com o receptor β1. β2 é o receptor adreno-receptor predominante do olho, portanto os agentes não-seletivos terão maior impacto no controle da PIO.9,10
Topical β-bloqueadores incluem timolol, levobunolol, metipranolol, carteololol e betaxololol. Apenas o betaxolol é cardioselectivo – o que o torna útil em certas contra-indicações, mas pode ser menos eficaz na redução da PIO.11β-bloqueadores reduzem a PIO em 20% a 30% e podem ser doseados duas vezes ao dia. Eles também podem ser dosados uma vez ao dia, especialmente quando se usa soluções formadoras de gel devido ao seu maior tempo de contato ocular.12,13 Antagonistas adrenérgicos podem ter menos impacto durante o sono, portanto, deve-se tomar cuidado quando os bloqueadores β são dosados perto da hora de dormir, especialmente se prescritos como um regime uma vez ao dia.14,15 Se os pacientes estão tomando bloqueadores sistêmicos β-bloqueadores, o efeito hipotensivo ocular dos bloqueadores tópicos β-bloqueadores é reduzido, e outras classes de medicamentos tópicos poderiam ser consideradas.16
Embora esta classe de medicamentos deva ser evitada principalmente em condições pulmonares ou cardíacas, em casos selecionados pode ser razoável considerar a terapia com beta-bloqueadores. Entretanto, isto deve ser feito com o consentimento do especialista apropriado (cardiologia ou pulmonar).
Tabelas: Bruce Onofrey, OD, RPh. Clique na imagem para ampliar.
Geralmente, porém, o uso do bloqueador β deve ser evitado naqueles com bloqueio atrioventricular, bradicardia sinusal e doença pulmonar obstrutiva.17
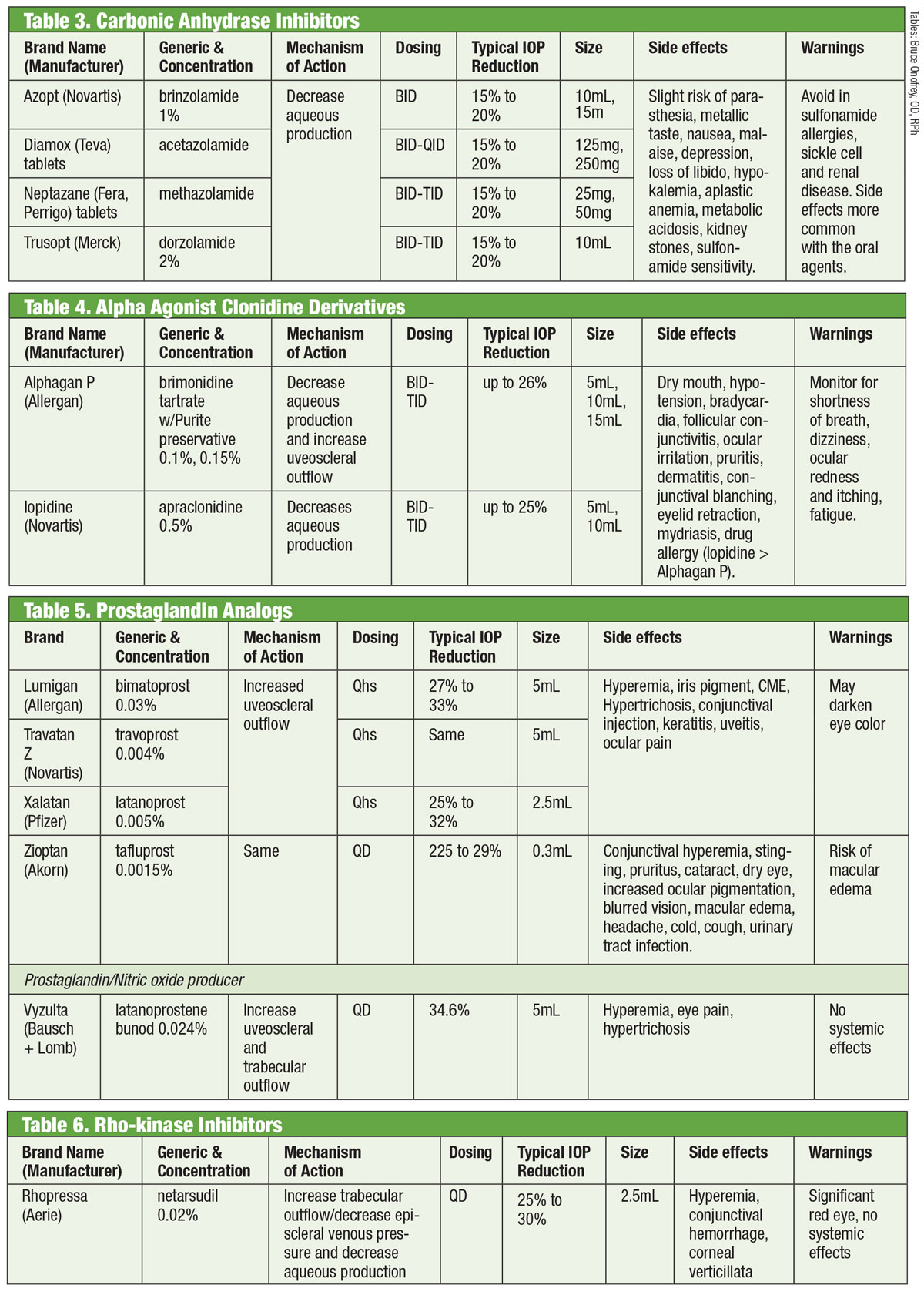
Inibidores de Anidrase Carbônica
Os pesquisadores têm reconhecido a capacidade dos inibidores de anidrase carbônica (IAC) orais de diminuir a PIO desde a década de 1950.18 Eles conseguem isso suprimindo a produção aquosa.18 Entretanto, os efeitos colaterais sistêmicos (como fadiga, distúrbios gastrointestinais e parestesias) limitam seu uso crônico no glaucoma.18 As IACs orais ainda são utilizadas nos casos em que as IACs tópicas causam hipersensibilidade ou quando se exclui o uso de gotas, bem como nos casos de fechamento agudo do ângulo.18 Tentativas de formular uma variedade tópica foram bem sucedidas com a introdução da dorzolamida em meados dos anos 90 e, logo após, da brinzolamida.19
Existem pelo menos sete isoenzimas diferentes de anidrase carbônica (CA), com CA-II nos processos ciliares predominantemente envolvidos com a produção aquosa.18 Tanto a dorzolamida quanto a brinzolamida são inibidores potentes desta isoenzima, mas apresentam várias diferenças clinicamente relevantes. Por exemplo, a dorzolamida tem um pH de 5,6 enquanto a brinzolamida tem um pH de 7,5. Além disso, a brinzolamida está disponível como suspensão. Estas são apenas algumas das propriedades que podem explicar os efeitos secundários individuais dos produtos, que podem incluir picadas no caso da dorzolamida e visão turva no caso da brinzolamida.19
Embora as drogas rotuladas pela FDA para a dosagem TID, alguns profissionais optam pela administração da BID. Para brinzolamida, ensaios fase III relatam reduções clinicamente equivalentes de PIO com regimes BID ou TID.20 Outros não relatam diferenças estatisticamente significativas entre a dosagem BID ou TID com dorzolamida.18 Alternativamente, outros defendem a dosagem TID para monoterapia e dosagem BID quando usada como terapia adjuvante.21
Tabelas: Bruce Onofrey, OD, RPh. Clique na imagem para ampliar.
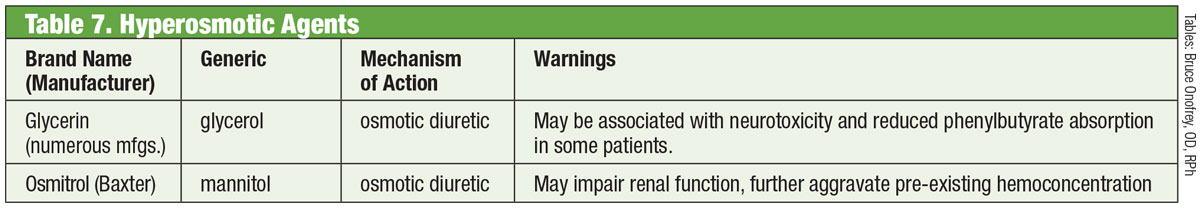
Alpha Agonists
>
Clonidine representou o primeiro alfa agonista (AA) eficaz para baixar a PIO. Entretanto, mesmo na forma tópica, produziu efeitos colaterais sistêmicos profundos de bradicardia, sedação e hipotensão.22 A substituição do grupo amido da apraclonidina diminuiu a penetração da barreira hematoencefálica e, portanto, os efeitos colaterais. Infelizmente, sua eficácia diminuiu com o tempo e o aumento da incidência de alergia ocular limita-a ao uso a curto prazo.
Introduzida em 1997, a brimonidina é um potente AA com 32 vezes mais seletividade para os adrenorreceptores β2 do que a apraclonidina.22 Ela reduz a PIO através de um duplo mecanismo de diminuição da produção aquosa e aumento da saída uveoscleral.23 Como sua predecessora, ela tem uma notável taxa de alergia (até 20%), que pode ocorrer até oito meses após o início da terapia.22 Três formulações foram desenvolvidas, cada uma com eficácia semelhante: 0,2% com cloreto de benzalcónio (BAK); e 0,15% e 0,1% com o conservante Purite.24 Desde então, a alergana descontinuou a formulação conservada com BAK.
A Droga Reta
Marijuana medicinal tem feito grandes notícias tardias, graças a uma série de mudanças legislativas nos Estados Unidos. Embora tenha sido pesquisada como um método para reduzir a PIO desde os anos 70, os investigadores só a descobriram capaz de baixar a PIO por breves períodos de tempo. Isso, aliado ao seu perfil de efeito colateral bastante forte, faz dele um fraco candidato a tratamento. Entretanto, a pesquisa diz que ela pode ter um papel a desempenhar para “pacientes com glaucoma em fase terminal que falharam na máxima terapia médica e cirurgia ou que são candidatos pobres à cirurgia”
Sun X, Xu C, Chadha N,et al. Marijuana para glaucoma: uma receita para o desastre ou tratamento? Yale J Biol Med. 2015 Set; 88(3): 265-9.
Os efeitos colaterais correlacionados principalmente com o uso de prostaglandinas, a literatura mostra uveíte anterior induzida por brimonidina.25 A duração variou de sete dias a cinco anos, com uma média de quase 20 meses.
Prostaglandin Analogs
Estes proporcionam a mais robusta redução da PIO de todas as gotas através do aumento da saída aquosa uveoscleral. Os análogos de prostaglandina (PGAs) ligam-se aos receptores no corpo ciliar e induzem um relaxamento muscular suave, e alteram a matriz extracelular dentro do músculo ciliar para aumentar a saída aquosa através das vias uveosclerais.26 Dosados uma vez por dia, geralmente na hora de dormir, os PGAs produzem uma redução de 30% a 35% da PIO; as opções incluem latanoprost, bimatoprost, travoprost e tafluprost (fornecidos em dose única, opção sem conservantes).26 O efeito colateral mais comum dos PGAs é a hiperemia conjuntival, frequentemente nas primeiras semanas após o início da terapia.26 Irritação ocular, exacerbação das condições inflamatórias existentes (edema macular, irite), atrofia da gordura periorbital, pigmentação da pele periocular, cílios e íris e hipertricose também podem ser vistas.26
Uma nova variante na categoria análoga da prostaglandina é o bunod latanoprosteno 0,024%. Este composto tem um duplo mecanismo: aumentar a saída uveoscleral e melhorar a saída trabecular através do impacto do óxido nítrico.27 O olho quebra o bunod latanoprosteno duas vezes para produzir os componentes ativos ácido latanoprost e óxido nítrico.28 Este último impacta um caminho de sinalização que relaxa os componentes contráteis na MT, o que aumenta o fluxo de saída.28 O impacto adicional cai PIO >1mm Hg vs. latanoprost sozinho através de múltiplos pontos de tempo, com redução total de PIO variando de 7.5mm Hg a 9.1mm Hg. Os efeitos colaterais com o bunod latanoprosteno foram comparáveis aos do latanoprost sozinho, com possivelmente menos pigmentação periocular e hipertricose, de acordo com os investigadores.28,29
Inibidores de ROCK
Em um olho normal, a principal via de drenagem para o humor aquoso é a MT. A resistência ao humor aquoso através dessa estrutura é aumentada em pacientes com glaucoma, elevando a PIO.30 Até recentemente, os medicamentos para glaucoma não conseguiam atingir essa estrutura. Isso mudou em 2017 com a introdução do Rhopressa (netarsudil 0,02%, Aerie), um inibidor de rho-kinase (ROCK).
>
 >
>
>
Tabela: Bruce Onofrey, OD, RPh. Clique na imagem para ampliar.
Rho-kinase é amplamente expressa em muitos tecidos, incluindo a MT, onde promove a montagem de fibras de actina de tensão e regula a contração celular.31 Os inibidores ROCK aumentam a saída aquosa diminuindo a actina e a contração celular acionada por miosina e reduzindo a produção de proteína de matriz extracelular.32 A Rhopressa também tem ação inibitória contra o transportador de norepinefrina (NET), tornando-a um inibidor ROCK/NET. O mecanismo NET pode ser o resultado da redução do fluxo sanguíneo para o corpo ciliar através da vasoconstrição induzida pela norepinefrina, o que resulta na diminuição da produção aquosa.33 Além disso, o netarsudil também diminui a pressão venosa episcleral (EVP), proporcionando assim múltiplas vias para a redução da PIO.32 O efeito colateral ocular mais comum é a hiperemia ocular (cerca de metade dos pacientes tratados), que na maioria das vezes é leve, transitória e auto-resolúvel.32
De notar que o próprio rho desempenha um papel importante no crescimento e orientação axonal, assim como na regulação da sobrevivência neuronal e morte.34 Os pesquisadores descobriram que, após a lesão do nervo óptico, a aplicação tópica do netarsudil reduz a morte das células ganglionares da retina e promove a regeneração axonal.34
Centrando no Mix
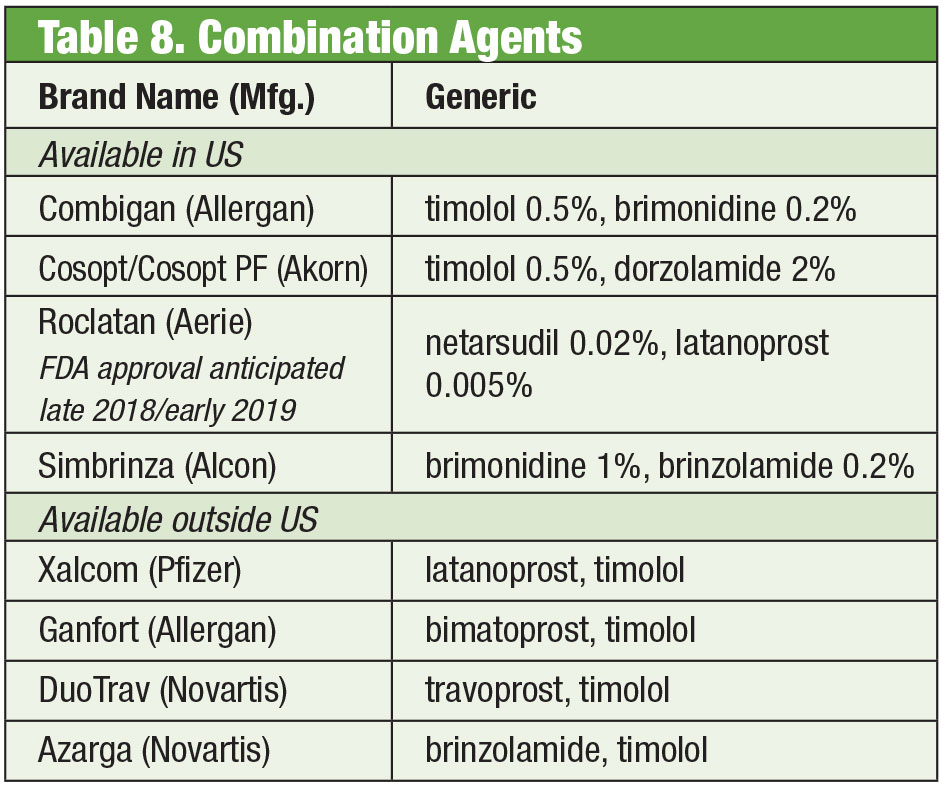
Algumas vezes os pacientes precisam mais do que o que os produtos de prateleira oferecem. A sensibilidade do paciente ou a toxicidade da superfície ocular pelo uso crônico de conservantes pode levar a uma busca por alternativas. Algumas drogas compostas estão disponíveis sem conservantes. Se a conformidade for um problema, essas misturas podem conter até quatro medicamentos em um único frasco. Além disso, muitas combinações fixas têm sido utilizadas eficazmente fora dos Estados Unidos, mas não são actualmente aprovadas pela FDA; o composto dá aos médicos norte-americanos acesso a esses regimes. Se o custo é uma limitação, a composição pode ser uma vantagem adicional. Enquanto o produto composto muitas vezes não é coberto pelo plano de seguro do paciente, o preço de um ou dois produtos combinados pode ser mais econômico do que o de várias opções de medicação única, mesmo formulações genéricas. Duas farmácias de composto oferecem múltiplas variações pré-definidas: Gotas simples da Imprimis Pharmaceuticals e a linha Omni prodcut da Ocular Science. Também é possível a personalização adicional de cada uma delas.
Embora os agentes individuais sejam aprovados pelo FDA, combinações particulares podem não ser. Cabe ao médico pesar os riscos e benefícios da conformidade.
Produtos de Glaucoma Compostos:
Gotas Simples (Imprimis Pharmaceuticals)
Todos os conservantes disponíveis livres de conservantes.
– Tim-Lat PF (timololol/latanoprost)
– Brim-Dor PF (brimonidina/dorzolamida)
– Tim-Brim-Dor PF (timololol/brimonidina/dorzolamida)
– Tim-Dor-Lat PF (timololol/dorzolamida/latanoprost)
– Tim-Brim-Dor-Lat PF (timololol/brinzolamida/dorzolamida/latanoprosta)
– Dor-Tim (dorzolamida/timololol)
– Dorzolamida PF
– Latanoprosta PF
Omni Drops (Ocular Science)
Conter cloreto de benzalkonium, mas em concentrações mais baixas (0.001%) que as formulações genéricas comuns (0,002%).
– Timololol/latanoprost
– Timololol/brimonidina/dorzolamida (fórmula AM)*
– Timololol/brimonidina/dorzolamida/latanoprost (fórmula PM)*
* Destinado a ser usado em uníssono, faltando a versão AM a prostaglandina, que normalmente é dosada apenas uma vez por dia.
Produtos Combinados Fixos
Embora a eficácia destes produtos individuais, é comum que muitos pacientes com glaucoma exijam múltiplas terapias para controlar a sua condição.35 Quando a dupla terapia é necessária, pode ser melhor oferecer o mesmo dispensador, promovendo uma maior adesão e reduzindo o impacto da toxicidade sobre a superfície ocular.36 pares de timolol com brimonidina (como Combigan, Allergan) e dorzolamida (como Cosopt, Akorn), ambos dosados duas vezes por dia, com uma opção sem conservantes disponível para o produto timololol-dorzolamida. Outra combinação duas vezes ao dia – Simbrinza – une brimonidina e dorzolamida. As combinações fixas mostram uma boa eficácia tanto como terapia primária, como também em adição aos PGAs. Os efeitos secundários são comparáveis aos dos componentes individuais.
Adeerência/Percepção de Pacientes
Embora a decisão de recomendar o tratamento possa ser complexa e esteja dependente de muitos factores, uma vez que o médico e o paciente concordam em iniciar a terapia, determinados factos de base devem ser reconhecidos e princípios básicos devem ser utilizados.
Clique na imagem para ampliar.
Progressão do campo visual e a gravidade da doença está ligada à má aderência.37 Pacientes com condições médicas crônicas utilizam, em média, 30% a 70% das doses prescritas e 50% interrompem a medicação nos primeiros meses de terapia, de acordo com um estudo.38 A aderência a medicamentos para glaucoma é semelhante à de outras condições crônicas.38 Assim, pode existir uma lacuna de eficácia onde, embora tenha sido comprovado que os medicamentos tópicos são eficazes em grandes estudos clínicos, na prática podem ser ineficazes devido à não adesão do paciente.39
Os fatores que contribuem para a má adesão ao glaucoma são, entre outros; perfil de efeitos colaterais dos medicamentos, custo da terapia, educação do paciente e a relação médico-paciente.40 Além disso, a doença pode ser assintomática até tarde em seu curso, com falta de consciência da perda do campo visual.41
E Agora para algo completamente diferente
Medicamentos têm sido a espinha dorsal do manejo do glaucoma há mais de um século, e o desenvolvimento de novos medicamentos continua ininterruptamente. Mas alguns pesquisadores estão procurando por alternativas além do frasco. Óculos embutidos com uma bobina eletromagnética, juntamente com uma lente de contato contendo um traço de ouro, podem um dia ajudar a baixar a PIO. Desenvolvido por uma empresa chamada Bionode, a combinação é projetada para gerar uma corrente elétrica que flui através dos músculos ciliares para estimular a via natural de drenagem e diminuir a PIO.
American Academy of Oftalmologia. Os óculos podem um dia tratar o glaucoma. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Acesso em 3 de julho de 2018.
Uma barreira adicional à aderência é a dificuldade com a instilação da gota e o horário de dosagem.42 De fato, até 80% dos pacientes contaminam suas gotas ao tocar o rosto, até 61% não instilam exatamente uma gota e, o mais crítico, até 37% falham o olho com a gota.43 O profissional nunca deve assumir que o paciente é proficiente com a instilação da gota. Antes de iniciar a terapia com gotas, ensine o paciente a instilar as gotas de forma apropriada e faça com que elas demonstrem a instilação com sucesso antes de sair do consultório. Isto pode ser eficientemente delegado a um técnico optometrista e reforçado com um folheto educativo sobre técnica (PDF imprimível em www.glaucoma.org/treatment/eyedrop-tips.php), assim como o uso de vídeos como um produzido pela Glaucoma Research Foundation (www.glaucoma.org/treatment/putting-in-eye-drops.php).
Se o paciente tiver dificuldade significativa em inserir gotas oftálmicas, um auxiliar mecânico de dosagem pode melhorar a probabilidade de sucesso. A adesão à programação de dosagem correta melhora com o uso de lembretes automáticos baseados em telecomunicações, smartphone e aplicativos de lembrete baseados em comprimidos.44,45 Uma combinação de educação no escritório, estabelecimento de metas, regime simplificado de gotas e tecnologia deve ser adotada para melhorar a adesão.46 A abordagem de barreiras conhecidas à adesão a medicamentos é um primeiro passo necessário para o sucesso.
Diminuir a Pressão
A PIO é o único fator de risco glaucomatoso modificável conhecido e reduzi-lo provou inegavelmente reduzir o risco de progressão da doença.47,48 A redução efetiva da PIO torna-se, assim, o objetivo no tratamento de pacientes com glaucoma. Depois que a doença é classificada com precisão, um objetivo terapêutico é tipicamente estabelecido. Padrões de prática preferenciais nos Estados Unidos sugerem o uso de um intervalo de PIO alvo que o clínico acredita que irá reduzir prospectivamente o risco de cegueira durante toda a vida do paciente, enquanto simultaneamente minimiza a carga relacionada ao tratamento.49-52
Embora múltiplas metodologias possam ajudar a determinar uma PIO alvo inicial (PIO limite, calculada, tamanho único), o método mais simples e baseado em evidências é reduzir a PIO em uma porcentagem do pico de PIO diurna basal no qual o dano ao nervo óptico está ocorrendo. A PIO é dinâmica e exibe flutuações de curto e longo prazo, o que torna a tonometria atualmente disponível não perfeitamente reprodutível. Portanto, é recomendado que o clínico obtenha múltiplas leituras de PIO em diferentes momentos do dia antes de iniciar o tratamento para tentar estabelecer uma PIO de pico diurno a partir da qual se baseie a faixa de alvo.53-55 No entanto, a menos que se obtenha múltiplas curvas de PIO de 24 horas, é improvável que um pico verdadeiro alguma vez seja capturado. O médico precisará, em última análise, avaliar o sucesso do tratamento reduzindo a taxa de progressão nos testes estruturais e funcionais.48,56,57
As reduções percentuais de PIO alvo recomendado variam de 20% a 50%, dependendo da condição (ou seja, suspeita de glaucoma, hipertensão ocular, glaucoma de tensão normal, glaucoma de alta tensão, glaucoma de fechamento angular) gravidade da doença de base e expectativa de vida.58-61
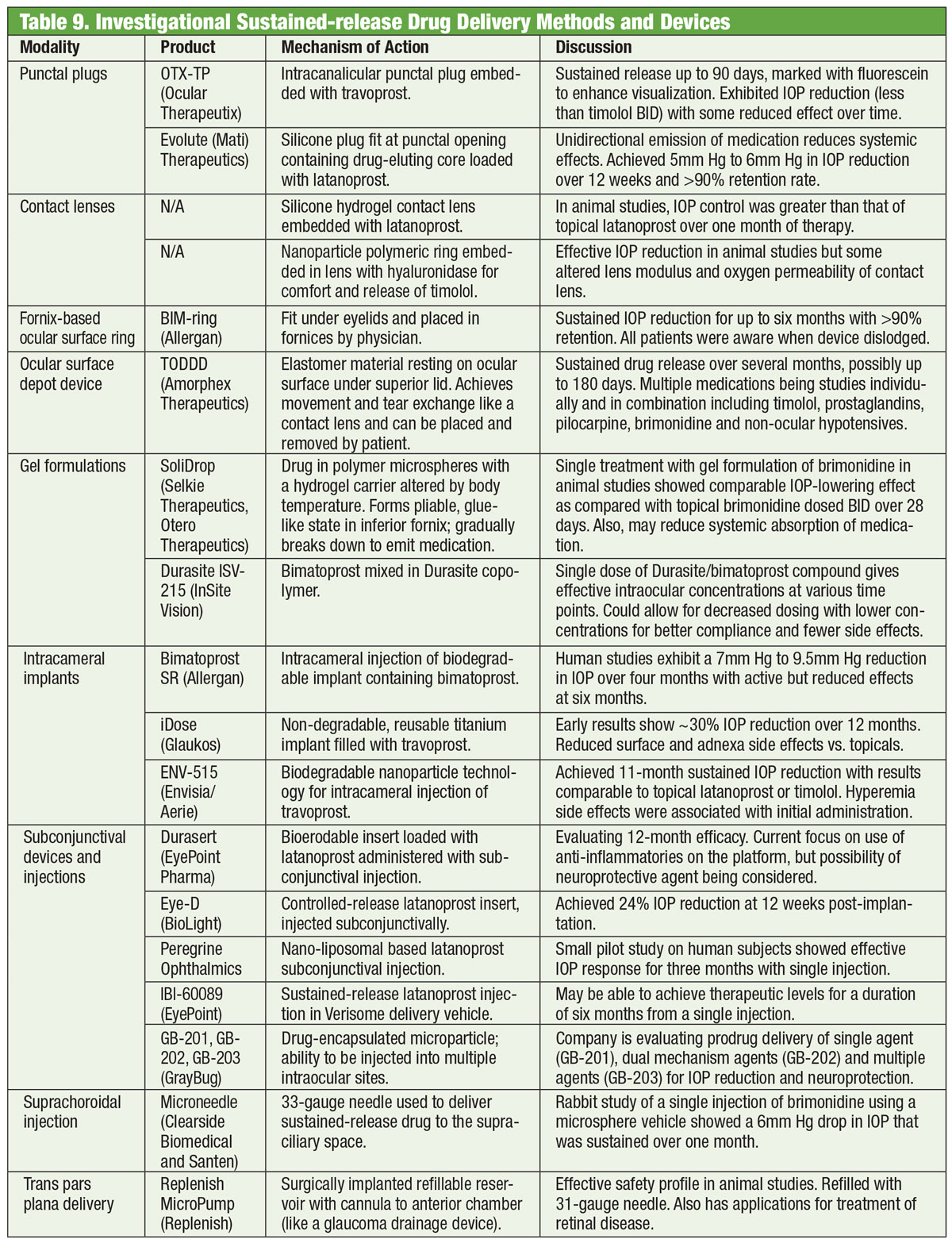
Tabela: Bruce Onofrey, OD, RPh. Clique na imagem para ampliar.
PGAs são aprovados para tratamento de primeira linha nos Estados Unidos e são mais eficazes na redução da PIO, têm um perfil de efeito colateral relativamente limitado e são dosados com menos freqüência (uma vez por dia) do que outras classes de medicamentos.62,63
Após a selecção de um agente específico, o paciente deve ser visto novamente em não mais do que quatro semanas para avaliar a eficácia da gota, para prevenir quaisquer eventos adversos que possam surgir, assegurar a aderência do paciente e reforçar o valor do tratamento.
Ultimamente, uma educação adequada e um acompanhamento vigilante com testes estruturais e funcionais ajudarão a minimizar a perda de visão.
O Dr. Dorkowski é o coordenador clínico do Programa de Enfermagem no Lar /Vida Assistida na SCO.
O Dr. Williamson é o supervisor da residência no Memphis VA Medical Center.
Dr. Rixon é o supervisor da residência no Memphis VA e é membro da Sociedade de Glaucoma Optométrico.
Dr. Onofrey é autor de The Ocular Therapeutics Handbook.
1. Zimmerman TJ, William P. BogerIII. Os agentes bloqueadores beta-adrenérgicos e o tratamento do glaucoma. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. Uma história da farmacologia do glaucoma. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Efeitos diretos dos agentes muscarínicos sobre as vias de saída dos olhos humanos. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. A resposta doseada da pressão intra-ocular humana à pilocarpina. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. O mecanismo de ação das drogas adrenérgicas no glaucoma. Research Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalyl epinefhrine: um novo pró-fármaco no tratamento do glaucoma. Oftalmologia. 1978;85(3):268-75.
7. Neufeld AH. Estudos experimentais sobre o mecanismo de ação do timolol. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. O mecanismo do timolol na redução da pressão intra-ocular: No olho normal. Oftalmol de Arco. 1978;96(11):2045-8.
9. Trope GE, Clark B. Beta receptores adrenérgicos em processos ciliares pigmentados. Br J Ophthalmol. 1982;66:788-92.
10. Wax MB, Molinoff PB. Distribuição e propriedades dos receptores beta-adrenérgicos no corpo íris-ciliar humano. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Walker AM, Epstein DL. Uma comparação de duas marcas de betaxolol vs timololol no tratamento do glaucoma de ângulo aberto. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Ophthalmic beta-blockers desde timolol. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. Avaliação do timolol no glaucoma crônico de ângulo aberto: Uma vez por dia vs. duas vezes por dia. Arco Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. Efeitos do timolol, epinefrina, e acetazolamida no fluxo aquoso durante o sono. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. Circadian variação de pressão intra-ocular com beta-bloqueadores. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. Effects of systemic beta-blocker therapy on the effectiveness and safety of topical brimonidine and timololol. Brimonidina Grupos de Estudo 1 e 2. Oftalmologia. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaucoma e doenças sistêmicas. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. Propriedades hipotensivas farmacológicas e oculares dos inibidores de anidrase carbónica tópica. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Entrega de drogas tópicas ao olho: dorzolamida. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamide ophthalmic suspension: uma revisão da sua farmacologia e utilização no tratamento do glaucoma de ângulo aberto e da hipertensão ocular. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. Comparação do efeito aditivo de diminuição da pressão intra-ocular de latanoprost e dorzolamida quando adicionado ao timololol em pacientes com glaucoma de ângulo aberto ou hipertensão ocular: um estudo randomizado, open-label, multicêntrico na Grécia. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. Incidência de alergia à brimonidina em doentes anteriormente alérgicos à apraclonidina. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. Effectiveness and safety of brimonidine as adjunctive therapy for patients with elevated intraocular pressure in a large, open-label community trial. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidina-purite 0,1% versus brimonidina-purite 0,15% duas vezes ao dia em glaucoma ou hipertensão ocular: um estudo aleatório de 12 meses. Curr Med Res Opinião. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Brimonidina induz a uveíte anterior. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Kaufman PL. Atualização sobre o mecanismo de ação das prostaglandinas tópicas para redução da pressão intra-ocular. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. Eficácia do bunod latanoprosteno 0,024% comparado com timolol 0,5% na redução da pressão intra-ocular em 24 horas. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprostene bunod oftálmico 0,024% para a diminuição da PIO em glaucoma e hipertensão ocular. Opinião Especialista Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. Comparação de bunod latanoprosteno 0,024% e maleato de timolol 0,5% em glaucoma de ângulo aberto ou hipertensão ocular: O estudo LUNAR. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. A malha trabecular: Uma revisão básica da forma e função. J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-2838-02-0017. Acesso em 29 de junho de 2018.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. Discovery of the ROCK inhibitor netarsudil for the treatment of open-angle glaucoma. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. Dois ensaios clínicos fase 3 comparando a segurança e eficácia do netarsudil ao timolol em pacientes com pressão intra-ocular elevada: rho kinase elevated iop treatment trial 1 and 2 (ROCKET-1 e ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. Discovery and preclinical development of netarsudil, a novel ocular hypotensive agent for the treatment of glaucoma. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Wang Y, et al. A administração tópica de um inibidor de rocha/redes promove a sobrevivência de células ganglionares da retina e regeneração de axônios após lesão do nervo óptico. Exp Eye Res. 2017;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Padrões de terapia adjuntiva em pacientes com glaucoma usando análogos de prostaglandina. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Combinações fixas. Glaucoma de hoje. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Scudeller L, et al. As taxas de aderência e a progressão do campo visual glaucomatoso estão correlacionadas? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Usando dados de alegações farmacêuticas para estudar a aderência a medicamentos para o glaucoma: metodologia e resultados do Estudo de Aderência e Persistência do Glaucoma (GAPS). Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Stamper R, et al. Effectiveness of intraocular pressure-lowering medication determined by washout. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. Porque é que as pessoas (ainda) ficam cegas devido ao glaucoma? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. Uma vista sobre glaucoma – Estamos a vê-lo claramente? Olho. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. As barreiras mais comuns à aderência de medicamentos para glaucoma: Uma pesquisa transversal. Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Instilação de gota e glaucoma. Curr Opinião Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Automated telecommunication-based reminders and adherence with once-daily glaucoma medication dosing: O estudo automatizado de lembretes de dosagem. JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. The Wills eye glaucoma app: Interesse dos pacientes e seus cuidadores em uma aplicação de glaucoma à base de smartphone-based e tablet-based. J Glaucoma. 2016;25(9):e787-e791.
46. Joseph A, Pasquale LR. Atributos associados à aderência à terapia médica do glaucoma e seus efeitos nos resultados do glaucoma: Uma revisão baseada em evidências e estratégias potenciais para melhorar a aderência. Semin Ophthalmol. 2017;32(1):86-90.
47. Clement CI, Bhartiya S, Shaarawy T. Novas perspectivas sobre a pressão intra-ocular alvo. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Personalização da pressão intra-ocular: Pressão intra-ocular alvo no ajuste da monitorização da pressão intra-ocular 24 horas. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. Pressão alvo na terapia do glaucoma. J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. Care of the patient with open-angle glaucoma. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Redução precoce da pressão intra-ocular agressiva, pressão intra-ocular alvo, e um novo conceito para os cuidados com glaucoma. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr. BE, Rosenberg LF, Gedde SJ, et al. Primary open-angle glaucoma Preferred Practice Pattern guidelines. Oftalmologia. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. Os padrões de pressão intra-ocular diurna não são repetíveis a curto prazo em indivíduos saudáveis. Oftalmologia. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhD, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. Reprodutibilidade a longo prazo dos padrões de pressão intra-ocular diurna em pacientes com glaucoma. Oftalmologia. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Variabilidade diária da pressão intra-ocular no glaucoma e hipertensão ocular. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Utilidade clínica da monitorização da pressão intra-ocular fora do horário normal de expediente em pacientes com glaucoma. Arco Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Peak intraocular pressure and glaucomatous progression in primary open-angle glaucoma. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arco Oftalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Redução da Pressão Intraocular e Progressão do Glaucoma: Resultados do Teste do Glaucoma Manifesto Inicial. Arco Oftalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. O estudo avançado de intervenção do glaucoma (AGIS): A relação entre o controle da pressão intra-ocular e a deterioração do campo visual. Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Progressão do campo visual no estudo colaborativo de tratamento inicial do glaucoma. O impacto do tratamento e outros fatores de base. Oftalmologia. 2009;116(2):200-207.e1.
62. Albert A. Latanoprost no tratamento do glaucoma. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. Impacto da introdução do genérico latanoprost na aderência de medicamentos para o glaucoma. Oftalmologia. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. A randomised, controlled comparison of latanoprostene bunod and latanoprost 0.005% in the treatment of ocular hypertension and open angle glaucoma: O estudo VOYAGER. Br J Ophthalmol. 2015;99(6):738-45.