Embora a dengue já tenha sido uma doença periódica que causou epidemias de longo intervalo, hoje é considerada a mais importante doença viral transmitida por mosquitos do mundo. Por ano, aproximadamente cinquenta a cem milhões de casos de dengue são registrados em todo o mundo. Meio milhão desses casos resultam na forma mais grave de dengue (DF) conhecida como febre hemorrágica do dengue (FHD). A DHF é uma doença que afeta predominantemente crianças menores de 15 anos e é caracterizada pelo início súbito da febre, trombocitopenia e síndrome de vazamento vascular. A FHD ocorre devido a uma infecção pelo vírus do dengue, que faz parte da família Flaviviridae . O vírus é icosahedra, envolto, de cadeia única, RNA de sentido positivo . O núcleo do icosahedra tem de 40 a 50 nanômetros de diâmetro e contém a proteína C que encapsula o genoma viral . Duas proteínas virais, M e E, que compõem o envelope lipídico, envolvem o núcleo . A infecção é causada por um dos quatro serotipos do vírus do dengue (DENV): DENV-1, DENV-2, DENV-3, e DENV-4 . A infecção por um dos serotipos não fornece imunidade contra a infecção com os outros serotipos .
Se alguém que foi infectado anteriormente for infectado novamente, ele ou ela tem um risco aumentado de desenvolver a síndrome do choque do dengue (DSS) e DHF, o que resulta no enfraquecimento e ruptura da vasculatura e sangramento interno . Anticorpos não neutralizantes podem aumentar a absorção do vírus pelas células que expressam os receptores Fc, permitindo assim um aumento dependente do anticorpo na DHF . Várias espécies de Aedesmosquitoes são vetores para o vírus do dengue e transmitem o vírus mordendo um hospedeiro humano . O Aedes aegypti; um mosquito pequeno, preto e branco, tropical e subtropical encontrado na América Central, América Latina, Sudeste Asiático e Pacífico Ocidental, é o principal vetor .
Epidemiologia
Atualmente, a DHF é considerada internacionalmente como a doença viral mais significativa transmitida por mosquitos. É endêmica em mais de 100 países do mundo, especialmente em regiões tropicais e subtropicais. Nos Estados Unidos, a DHF causadora da Aedes aegyptispecies pode ser encontrada sazonalmente na Louisiana, sul da Florida, Novo México, Arizona, Texas, Georgia, Alabama, Mississippi, Carolina do Norte e do Sul, Kentucky, Oklahoma, e Tennessee . Nos últimos 50 anos, a incidência da dengue aumentou 30 vezes.
Segundo a Organização Mundial de Saúde (OMS), estima-se que 50 a 100 milhões de infecções por dengue ocorrem anualmente. Destes casos, 500.000 progridem para DHF resultando em 22.000 mortes, a maioria das quais de crianças . Com base em dados oficiais submetidos à OMS, os casos de dengue nas Américas, Sudeste Asiático e Pacífico Ocidental ultrapassaram 1,2 milhões em 2008 e mais de 3 milhões em 2013. Em 2013, foram notificados 2,35 milhões de casos de dengue somente nas Américas, dos quais 37, 687 casos de DHF . Após a primeira epidemia conhecida de DHF em 1953 a 1954 nas Filipinas, a doença continuou a se espalhar pelo sudeste asiático.
Durante os anos 50, 60 e a maior parte dos anos 70, a epidemia de dengue foi rara na maior parte da América do Sul e Central porque o vetor primário do mosquito, Aedes aegypti, foi erradicado. No entanto, uma vez parada a eexterminação, o Aedes aegypti começou a reinvadir essas regiões. Em 1997, o Aedes aegypti e o vírus da dengue ganharam novamente uma distribuição mundial, (Figuras 1,2). Segundo a OMS, existem hoje mais de 2,5 bilhões de pessoas que vivem em áreas onde a dengue/DHF é endêmica e estão em risco de serem infectadas com o vírus da dengue. Vários fatores contribuem para a transmissão viral pelo Aedes aegypti; incluindo temperatura, chuvas, migração rural-urbana, crescimento populacional, água armazenada, aumento de resíduos sólidos que permitem habitats larvares para o vetor . Também pode haver surtos de DHF associada à viagem. A dengue é a infecção pelo arbovírus mais comum em todo o mundo .
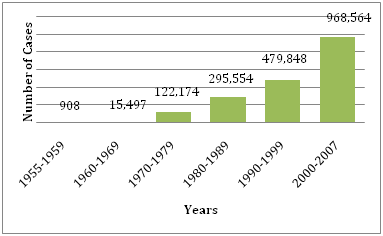
Figure 1: Número médio de DF/DHF reportado à OMS nos anos fornecidos .
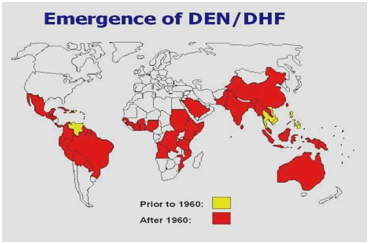
Figura 2: Distribuição do dengue/febre hemorrágica do dengue nas Américas, Caribe, África e Oriente Médio.
Fator de risco para DF e transmissão do vírus do dengue
Febre do dengue é uma importante doença viral transmitida por artrópodes . Pesquisas mostram que os gêneros Aedes, principalmente os mosquitos Aedes aegypti e Aedes albopictus, adaptaram-se a viver perto de áreas habitadas por humanos e são responsáveis pela transmissão da febre do dengue. Os mosquitos se alimentam durante o dia e preferem os seres humanos a outros animais. O Aedes aegyptii tem o padrão mais elevado de alimentação humana com 76,9%, seguido pelos mosquitos Aedes albopictus e Aedes vittatus, com 75% e 33,3% respectivamente . A incidência do DF tem sido associada com a quantidade de vegetação, cobertura de árvores, qualidade de alojamento e área de terreno circundante .
Além dos locais de reprodução criados pelo homem, o clima também tem mostrado influenciar a ecologia da dengue, afetando a dinâmica do vetor, o desenvolvimento do agente e a interação mosquito/humano.13 A temperatura ajuda a influenciar as taxas de desenvolvimento do vetor, mortalidade, comportamento e controla a replicação viral dentro do vetor. Os climas quentes permitem o desenvolvimento larvar e um aumento da velocidade de replicação do vírus, enquanto os climas frios retardam o desenvolvimento viral e diminuem o tempo de sobrevivência dos mosquitos, diminuindo assim a possibilidade de um vetor infeccioso e diminuindo a transmissão da dengue. A temperatura também interage com as chuvas como principal regulador da evaporação, afetando assim diretamente a disponibilidade de habitats aquáticos e afetando indiretamente a cobertura e uso do solo, o que pode promover ou impedir o crescimento das populações vetoriais .
Mudanças demográficas e sociais como o crescimento populacional, urbanização e transporte moderno contribuem muito para o aumento da incidência e propagação geográfica da atividade do dengue . À medida que os viajantes se deslocam de áreas endêmicas, eles tendem a servir como veículos para uma maior propagação . A virulência da estirpe viral e a variação genética do vírus do dengue também se prestam a um maior potencial de transmissão epidêmica da FHD.
Patogênese da febre hemorrágica do dengue
Como o mosquito se alimenta do hospedeiro humano, ele injeta o vírus do dengue (DENV) na corrente sanguínea e na epiderme e derme circunvizinhas. Isto resulta na infecção de células imaturas de Langerhans e queratinócitos através da endocitose mediada por receptores. A proteína E, a proteína superficial, é reconfigurada e permite a fusão da membrana e a liberação do RNA viral na célula infectada. As proteínas não estruturais, NS1 e NS2A controlam a replicação do RNA viral e NS1 também podem estar implicadas na ativação da cascata do complemento . As células infectadas podem então morrer por apoptose ou necrose ou migrar para os gânglios linfáticos onde os macrófagos são recrutados, (Figura 3). A infecção por qualquer um dos quatro serótipos da dengue (DENV-1 até DENV-4) pode ser assintomática na maioria dos casos, pois o sistema imunológico do hospedeiro é capaz de neutralizá-la localmente, mas também pode causar um espectro de manifestações clínicas, sendo a forma mais grave a DHF, que pode progredir para DSS e morte . A DHF é clinicamente definida como uma febre contínua de 2 a 7 dias com manifestações hemorrágicas da mucosa ou pele associadas a trombocitopenia (<100.000 células/mm3) e um hematócrito superior a 20% acima da linha de base do paciente ou população da mesma idade. As marcas patológicas da DHF são o vazamento de plasma de superfícies pleurais ou peritoneais e a Coagulopatia intrínseca, que é clinicamente medida por um teste de garrote positivo, ou por evidências de sangramento espontâneo, como petéquias ou equimoses, sangramento gengival ou epistaxe, ou hemorragia gastrointestinal .

Figure 3: Após serem picadas pelo mosquito portador Aedes aegypti, células imaturas de Langerhans e queratinócitos são infectadas com DENV. As células infectadas descem então para a linfa onde os macrófagos são recrutados. A partir daqui a infecção é disseminada em vários órgãos, incluindo o fígado, baço e medula óssea. A necrose da medula óssea pelo DENV pode levar à supressão da hematopoiética e à diminuição da trombogénese no sangue . A resposta inflamatória, causada pela liberação de quimiocinas e citocinas de mastócitos, macrófagos e linfócitos, causa aumento da permeabilidade vascular, disfunção plaquetária, trombocitopenia e vazamento de plasma . Embora o mecanismo não seja bem compreendido, esta cascata também parece causar sangramento espontâneo, levando a manifestações clínicas de petéquias, sangramento gengival e hemorragia gastrointestinal .
Esta forma grave da doença é frequentemente resultado de uma infecção secundária, onde o hospedeiro é infectado com um segundo serótipo e uma complexa interação entre o vírus e a resposta imunológica do hospedeiro. Embora o mecanismo que causa esta reacção não seja bem compreendido, as evidências sugerem que a infecção anterior pode criar anticorpos reactivos cruzados que ligam o novo serótipo, mas que são incapazes de neutralizá-lo. Isto é chamado teoria do realce dependente do anticorpo (ADE). Pensa-se que os anticorpos formados durante infecções anteriores contra proteínas estruturais DENV, como a proteína E ou prM, são incapazes de neutralizar o novo patógeno e, em vez disso, levam a uma ligação reforçada à célula receptora positiva Fcγ, permitindo a replicação amplificada do vírus . Em resposta, o sistema imunológico libera uma resposta exagerada de citocinas, levando ao aumento da permeabilidade vascular e da coagulopatia.
As mastócitos também foram implicados na patogênese da DHF. Em alguns casos, os mastócitos parecem fornecer uma função protetora onde moléculas antivirais são liberadas por granulação e outras células imunes, como os linfócitos T e as células assassinas naturais (NK) são recrutadas, todas elas ajudando a neutralizar o vírus . No entanto, em outros casos, os mecanismos locais de controle não podem conter o vírus e este viaja pela corrente sanguínea ou sistema linfático para ativar mastócitos em outros órgãos como o fígado, baço e gânglios linfáticos . Quando a granulação ocorre nesses órgãos, são liberadas proteases e sintetizados mediadores inflamatórios, como leucotrienos e fator de crescimento endotelial vascular (VEGF), aumentando a permeabilidade dos capilares e levando ao vazamento de plasma . Isto é importante, pois diferentes grupos de mastócitos liberam mediadores distintos durante o processo de granulação . O complexo vírus-anticorpo, talvez através do antígeno NS1 do vírus do dengue, e a produção de citocinas também resulta na ativação do complemento. A liberação de fragmentos de C3a e C5a é conhecida por aumentar a permeabilidade vascular e assim contribuir para o vazamento de plasma .
O tipo e a quantidade de citocinas liberadas tem um papel importante na dita da gravidade da doença. A proteína inflamatória macrófaga 1β (MIP-1β) parece ser um indicador de doença menos grave, pois é liberada por células mononucleares infectadas e células NK ativadas. Ela atua como um atrativo químico para mais células NK, atraindo-as para o local inflamatório, limitando a replicação viral e o efeito das citocinas a jusante. Interferon γ (IFN-γ), por outro lado, demonstrou induzir vazamento de plasma e aumentar a absorção de partículas de dengue através do aumento dos receptores de Fc nas células-alvo e, portanto, está associado a manifestações clínicas mais graves e mau prognóstico. Outras citocinas encontradas com aumento da Fc que têm sido implicadas na indução de vazamento plasmático incluem a interleucina 2 (IL-2), fator de necrose tumoral α (TNF- α) fator inibidor da migração de macrófagos (MIF), proteína-1 monocitária (MCP-1), interleucina-8 (IL-8), e caixa de grupo-1 de alta mobilidade (HMGB-1) . Os efeitos da liberação de citocinas não estão limitados à permeabilidade vascular e vazamento de plasma, mas também estão implicados nas manifestações hemorrágicas da DHF. Entretanto, o mecanismo subjacente que causa hemorragia na DHF é mal compreendido. Apesar da maioria das células infectadas serem propensas à morte por apoptose, algumas necroses ocorrem, resultando na liberação de toxinas, que ativam os sistemas de coagulação e fibrinólise. Quando altos níveis de necrose ocorrem na medula óssea devido à alta carga viral, a hematopoiética é suprimida, resultando em trombolíticopenia. A resultante diminuição da trombogênese e disfunção plaquetária pode causar fragilidade capilar e as manifestações clínicas resultantes observadas na FHD. Alguns estudos indicam que o envolvimento do fígado na infecção por DENV pode estar implicado em tendências de sangramento espontâneo, com uma correlação entre níveis elevados de enzimas hepáticas e aumento da tendência para hemorragia .
Sinais e sintomas clínicos
A manifestação clínica da doença inclui infecção assintomática, febre dengue leve (DF), febre hemorrágica do dengue (FHD), ou síndrome de choque do dengue (SAF), que é frequentemente grave devido à permeabilidade capilar anormal e vazamento de plasma . O dengue grave geralmente ocorre entre pacientes que foram infectados anteriormente com um vírus do dengue (ou seja, infecção secundária). Altas taxas de infecção grave pelo dengue também têm sido relatadas em bebês com infecção primária pelo vírus do dengue que nascem de mães que foram infectadas anteriormente com um vírus do dengue .
A fase inicial da DHF aparece como febre do dengue. A sintomatologia desta fase inicial depende da idade do paciente e inclui uma febre alta súbita (às vezes com dois picos de apoio), dor de cabeça severa, diminuição do apetite, mialgia severa e artralgia, uma erupção cutânea maculopapular que aparece três a quatro dias após o início da febre, dor retro-orbital, fotofobia, linfadenopatia, hemorragia leve (epistaxe, sangramento gengival, hemorragia gastrointestinal, hematúria e menorragia), e um teste de torniquete positivo . Os casos de DHF são caracterizados por quatro grandes manifestações clínicas que são febre alta, fenômenos hemorrágicos e, frequentemente, hepatomegalia e falência circulatória. A doença febril aguda característica da fase inicial consiste em temperaturas superiores a 39ºC e assim permanecem durante 2-7 dias.
Os sintomas acima mencionados da fase inicial agravam-se progressivamente com febre e dores de cabeça contínuas, dores abdominais graves, vómitos persistentes, hematemese, melena, petéquias, hematomas fáceis, inquietação, letargia, sonolência, irritabilidade, hemorragia ou hematomas sob a pele. Após 2-7 dias de febre, uma queda rápida da temperatura é frequentemente acompanhada por sinais de distúrbios circulatórios de gravidade variável. O paciente pode suar, estar inquieto, ter extremos frios e apresentar alterações na frequência de pulso e pressão sanguínea. Após 24-48 horas do início das características específicas da DHF, hemostasia anormal e vazamento de plasma são observados como os sintomas marcantes.
Um bom indicador destes avanços é um aumento do fígado superior a 2 cm, uma vez que a hepatomegalia tende a preceder o vazamento de plasma. Muitos pacientes se recuperam com ou sem tratamento com fluidos e eletrólitos. Em casos graves, a perda plasmática pode progredir até ao choque e morte se não for tratada. Pesquisas sugerem que tanto uma infecção secundária de dengue quanto a retaliação exagerada da resposta do sistema imunológico de citocinas aumentam a predileção por um paciente desenvolver DHF.
Produtos virais como a glicoproteína NS1 são acreditados para influenciar a ativação do complemento e a permeabilidade vascular resultando em vazamento de plasma que se desenvolve em ascite ou derrame pleural . A resposta das citocinas também é responsável pelo aumento da permeabilidade vascular, como consequência da qual a pressão oncótica intravascular é reduzida e facilita a perda de líquido para os compartimentos vasculares extras (Figura 4). A hemostasia anormal consiste em trombocitopenia concomitante com aumento do hematócrito, tempo prolongado de tromboplastina parcial com redução da concentração de fibrinogênio, juntamente com as petéquias mencionadas anteriormente, hemorragias gastrointestinais graves, equimose e epistaxe.
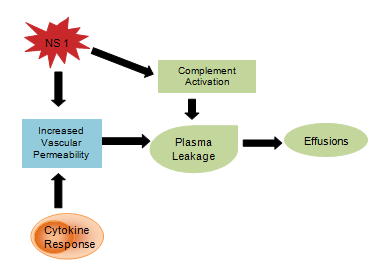
Figure 4: Cytokine immune system response.
Durante a fase febril virêmica da DHF, acredita-se que a trombocitopenia e as manifestações subsequentes ocorrem devido à supressão da medula óssea. Como mencionado anteriormente, a supressão da medula óssea é resultado de ser um local de replicação do vírus, atacando especificamente as células progenitoras hematopoiéticas. No entanto, a destruição imuno-mediada das plaquetas também foi sugerida pela descoberta de complexos vírus-anticorpos encontrados nas superfícies plaquetárias de pacientes com DHF.
As manifestações clínicas incomuns incluem hepatite aguda, insuficiência hepática, insuficiência renal aguda, encefalopatia, ou cardiomiopatia (miocardite aguda) . Um estudo sobre DHF fatal em adultos analisou outras causas de fatalidade além da síndrome do choque do dengue (DSS) em pacientes com dengue grave e concluiu que hipotermia, leucocitose e bandemia podem ser sinais desencadeantes de dengue grave. O estudo aconselhou ainda os clínicos a estarem conscientes do possível desenvolvimento de sangramento gastrointestinal maciço, especialmente em pacientes com alteração precoce da consciência, trombocitopenia profunda, TP prolongada e/ou leucocitose .
Diagnóstico, tratamento e manejo
O diagnóstico precoce e preciso é crítico para o cuidado clínico adequado. Existem muitos métodos nos quais o diagnóstico de dengue pode ser feito. O diagnóstico pode ser feito através do isolamento do vírus, do ácido nucleico viral, de anticorpos e antígenos, ou através de uma combinação de todas estas técnicas. A detecção do vírus da dengue por cultura é o teste diagnóstico definitivo, mas considerações práticas limitam a sua utilização. A detecção do RNA viral é mais rápida, mas a contaminação pode levar a um resultado falso positivo. Além disso, o teste serológico pode produzir um resultado falso positivo devido aos anticorpos reactivos cruzados .
Infecções agudas são detectadas no soro, plasma e células sanguíneas circulantes durante a fase inicial de convalescença, que é o 5-8 dias iniciais dos sintomas. Neste momento, a carga viral primária pode ser de até 103 partículas de RNA/ml ou superior a 106 partículas de RNA/ml em infecções secundárias . Atualmente, a combinação dos testes de antígenos e anticorpos NS1, bem como métodos moleculares, como a transcrição reversa em tempo real da reação em cadeia da polimerase em cadeia (RT-PCR), estão sendo usados com mais freqüência para diagnóstico, pois podem fornecer resultados mais rápidos e podem ser mais sensíveis. A análise imunohistoquímica e a imunofluorescência também confirmam a presença do vírus através dos antígenos virais. Os anticorpos IgM são os primeiros a aparecer nos primeiros 3-5 dias após a infecção.
Estão nos níveis máximos 2 semanas após o aparecimento dos sintomas, diminuindo depois para níveis indetectáveis após 30-60 dias . Os anticorpos IgG, que são mais reativos em cruz, são detectados em níveis baixos após os 7-9 dias iniciais dos sintomas, aumentam lentamente até quatro vezes e permanecem detectáveis após vários meses e possivelmente até mesmo a vida . A resposta do antígeno humano e dos anticorpos depende do estado imunológico do hospedeiro e está presente apenas durante a infecção primária ou secundária. Não existem tratamentos específicos ou medicamentos antivirais para a dengue. A fisiopatologia da dengue aumenta a permeabilidade vascular, o que leva a uma perda significativa de plasma do compartimento intravascular para o espaço vascular extra.
Esta perda de líquido pode levar ao choque e sem correção adequada levará à hipóxia, acidose metabólica e eventualmente à morte. Portanto, o tratamento primário requer cuidados de suporte hospitalar com equilíbrio de fluidos e eletrólitos. O volume de células embaladas deve ser monitorado na hora a cada 4-6 horas. A perda significativa de plasma é definida como tendo um aumento >20% no volume de células embaladas ou hematócrito. Quando um paciente atinge estes níveis, é necessária uma reposição rápida e agressiva do volume.
A taxa de reposição de fluido de infusão depende do volume de células embaladas e do débito urinário. Há vários fluidos usados para reposição de perda de plasma, incluindo soro fisiológico, lactato de Ringer ou acetato de Ringer, solução glicosada diluída a 5%, plasma ou substitutos de plasma como dextrina 40 e sangue total fresco . Além da substituição do fluido intravenoso, os eletrólitos podem ser introduzidos por via oral, pois aliviará parte da sede e da desidratação da febre. Analgésicos de apoio como o acetaminofeno podem ser usados para tratar a febre e outros sintomas. Os AINE e aspirina devem ser evitados, pois podem precipitar a síndrome de Reye.
A recuperação do componente de pacientes com DHF deve atender aos seguintes critérios antes da alta hospitalar: melhora clínica visível, afebril sem o uso de antipiréticos por >24 horas, aumento do apetite, hematócrito estável, débito urinário adequado, três dias após a recuperação de acidose metabólica grave, contagem de plaquetas >50,000/mm3, e nenhum desconforto respiratório por derrame pleural ou ascite.
Prevenção e erradicação do aedes aegypti
Aedes aegypti, o vector mais prevalente do vírus da dengue, é o principal alvo das actividades de vigilância e controlo. Outros vetores, como o Aedes albopictus, podem produzir a dengue, mas as atividades de vigilância e controle para diferentes vetores só devem ser consideradas se houver evidências confiáveis de que esses vetores desempenharam um papel epidemiologicamente significativo na transmissão das infecções pelo dengue. A primeira iniciativa para eliminar o Aedes aegyptiwas foi em Cuba, em 1901. A fumigação e eliminação dos focos de mosquito, destruindo os recipientes abandonados, foram os primeiros passos para erradicar o vetor . Após os surtos de febre amarela ocorridos no Brasil em 1928 e 1932, ficou evidente que a proteção completa das populações urbanas dependia da erradicação absoluta do Aedes aegyptimosquito, o que levou à aprovação pela Organização Pan-Americana de Saúde (OPAS) do plano de combate à febre amarela urbana do Aedes aegyptiw em 1947. Desde 1947, o Escritório Sanitário Pan-Americano (PASB) promoveu intensamente campanhas em todos os países afetados, e seu sucesso foi demonstrado em 1962, quando 18 países continentais e várias ilhas do Caribe haviam conseguido a erradicação. Como resultado destes esforços, o genótipo americano DENV-2 genótipo V é o único vírus da dengue que permanece até hoje.
Apesar dos esforços para erradicar o vector, o Aedes aegypti não foi erradicado em Cuba, nos Estados Unidos, na Venezuela e em vários países das Caraíbas . Décadas de esforços humanos sem precedentes para erradicar o Aedes aegypti separaram-se muito rápida e rapidamente levaram à infestação. Falta de vigilância e deterioração da estrutura dos programas de erradicação, saneamento ambiental insuficiente e participação comunitária insuficiente foram alguns dos fatores que levaram ao declínio dos esforços para erradicar o vetor . A partir de hoje, não há vacina disponível para prevenir as infecções pelo dengue. A Takeda Vaccines Inc. está desenvolvendo uma vacina candidata viva e atenuada conhecida como vacina contra o dengue tetravalente (TDV) que é composta por uma cepa atenuada de DENV-2 (TDV-2) e três vírus quiméricos contendo os genes prM e proteína E de DENV-1, -3 e -4 que foram expressos no contexto da espinha dorsal atenuada do genoma TDV-2 (TDV-1, TDV-3, e TDV-4, respectivamente). A vacina demonstrou ser bem tolerada e imunogênica em um ensaio clínico de Fase 2 em países endêmicos de dengue entre adultos e crianças.
A vacina está na fase 3 de desenvolvimento . Além disso, a Sanofi Pasteur desenvolveu uma vacina contra o dengue recombinante, atenuada ao vivo e tetravalente (CYD-TDV) que mostrou segurança e eficácia consistentes em indivíduos do ano ≥9 em países endêmicos; ela está na fase final de desenvolvimento . A Dengvaxia (CYD-TDV) da Sanofi Pasteur foi registrada pela primeira vez no México em dezembro de 2015 e foi avaliada como uma série de 3 doses em um cronograma de 0/6/12 meses em estudos clínicos da Fase III. Há aproximadamente cinco vacinas candidatas adicionais em avaliação em ensaios clínicos . Os viajantes para áreas endêmicas de dengue estão em risco de contrair dengue; assim, para prevenção, eles devem ser encorajados a selecionar acomodações com janelas e portas bem protegidas, usar repelente de insetos, usar roupas apropriadas e esvaziar e cobrir qualquer água parada que possa eventualmente se tornar um local de reprodução de mosquitos .
Situação global atual
Correntemente, há expectativas de que a incidência de dengue continuará a aumentar devido a muitos fatores, incluindo o status socioeconômico, as mudanças climáticas contínuas, as viagens e a globalização. Vacinas ainda estão em desenvolvimento e nenhuma terapia antiviral específica existe atualmente para lidar com a crescente ameaça da dengue. A estimativa global da incidência da dengue está entre 50 a 200 milhões. No entanto, o uso de abordagens cartográficas recentemente sugere que o número da incidência está mais próximo de 400 milhões . Em 2012, a OMS classificou o dengue como uma das doenças virais vitais transmitidas por mosquitos . Esta classificação é justificada pela significativa propagação geográfica do vírus, juntamente com o seu vector, a áreas que não foram anteriormente afectadas (Figura 5).
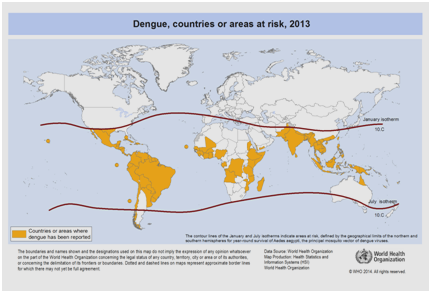
Figure 5: Países ou áreas do mundo onde a dengue foi relatada em 2013, conforme dados coletados pela Organização Mundial de Saúde .
Também é suportada pelo custo que a doença traz consigo. Comparando a carga da dengue com outras doenças transmissíveis na região afetada, a dengue causa muito mais sofrimento humano e é mais uma carga do que as outras doenças transmitidas por vetores. Segundo a OMS, a dengue é a principal causa de hospitalização e morte de crianças no sudeste asiático. Um estudo de Hammond et al. relatou que a maioria da morbidade e mortalidade relacionadas a esta doença está associada a crianças e não a qualquer outra faixa etária. Lactentes entre 4-9 meses de idade e crianças entre 5-9 anos de idade carregam a maior carga de dengue (Figura 6). A gravidade da doença nestas crianças é frequentemente devida à infecção secundária por DENV. Um estudo ecológico realizado por Dıaz-Quijano e Waldman na América Latina e Caribe descobriu que os determinantes da taxa de mortalidade por dengue nessas populações incluem a extensão da endemicidade reconhecida, a densidade populacional e a precipitação pluviométrica .
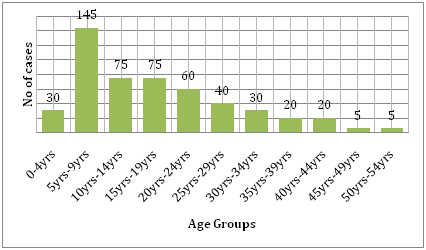
Figure 6: Distribuição etária da coorte do estudo em León por faixa etária .
Além do impacto da morbidade e mortalidade, o vírus da dengue carrega um alto ônus financeiro para as regiões afetadas, muitas das quais estão mal equipadas para suportar esses custos. Em 2010, a carga financeira do vírus da dengue foi estimada em 2,1 bilhões de dólares americanos por ano, em média, nas Américas (em dólares americanos de 2010), com um intervalo de 1 a 4 bilhões de dólares em análises de sensibilidade e variação substancial ano a ano . De acordo com a OMS, a dengue é agora vista como uma preocupação mundial com a Ásia-Pacífico promovendo a maior (75%) população global com exposição ao vírus da dengue . O Pacífico Ocidental também tem experimentado um aumento contínuo no número de casos notificados de dengue na última década.
Com a ausência de transmissão do DF em meados do século XX, há agora a presença de um aumento da endemia do DF indígena nas Américas. Somente nas Américas, em 2010, houve mais de 1,6 milhões de casos relatados de dengue e 49.000 desses casos são de dengue grave. Na África, os surtos de DF estão aumentando em tamanho e freqüência, mas não estão sendo relatados consistentemente à OMS. Entre 1960 e 2010, foram relatados casos esporádicos por 22 países africanos, como sugerido pelos dados disponíveis sobre surtos . Na Europa, nenhuma epidemia de DF foi relatada desde um surto na Grécia em 1928. Existem agora ameaças do surto na Europa, que tem sido atribuído ao Aedes albopictus devido a viagens de países onde a doença é endémica. Estima-se que haverá um aumento na incidência da doença nos próximos anos devido a factores de risco multifactoriais .