Celele conțin multă apă. Unul dintre rolurile apei este acela de a dizolva diferite materiale. De exemplu, în celule există mulți compuși ionici diferiți (săruri). Ionii sunt utilizați pentru a menține potențialele celulare și sunt importanți în semnalizarea celulară și în contracția musculară.
Cum vă puteți da seama dacă un compus este ionic sau covalent?
Nu există un răspuns simplu la această întrebare. Multe legături sunt undeva la mijloc. Într-o legătură covalentă polară, o pereche de electroni este împărțită între doi atomi pentru a îndeplini octeții lor, dar electronii se află mai aproape de un capăt al legăturii decât de celălalt. Există mai multă sarcină negativă spre un capăt al legăturii, ceea ce lasă mai multă sarcină pozitivă la celălalt capăt.
Urmărirea valorilor electronegativității diferiților atomi ne ajută să decidem cât de uniform este împărțită o pereche de electroni într-o legătură. Electronegativitatea crește spre colțul din dreapta sus al tabelului periodic din cauza unei combinații de sarcină nucleară și factori de ecranare. Atomii din colțul din dreapta sus al tabelului periodic au o atracție mai mare asupra electronilor de legătură pe care îi împart, în timp ce cei din colțul din stânga jos au o atracție mai slabă pentru electronii din legăturile covalente.
Într-o legătură carbon-oxigen, mai mulți electroni vor fi atrași de oxigen, deoarece acesta se află la dreapta carbonului în rândul său din tabelul periodic. Compuși precum , eterul dimetilic, CH3OCH3, sunt un pic polari. Formaldehida, CH2O, este și mai polară. Electronii din legăturile pi sunt ținuți mai puțin strâns decât electronii din legăturile sigma, din motive care țin de mecanica cuantică. Acest lucru permite oxigenului să atragă electronii spre el mai ușor într-o legătură multiplă decât într-o legătură sigma.

Nu toate polaritățile sunt ușor de determinat aruncând o privire în tabelul periodic. Direcția dipolului într-o legătură bor-hidrogen ar fi dificil de prezis fără a căuta valorile electronegativității, deoarece borul este mai la dreapta, dar hidrogenul este mai sus. După cum se pare, hidrogenul este ușor negativ.
O legătură este ionică dacă diferența de electronegativitate dintre atomi este suficient de mare pentru ca un atom să poată îndepărta complet un electron de la celălalt. Această situație este frecventă în compușii care combină elemente din marginea stângă a tabelului periodic (sodiu, potasiu, calciu etc.) cu elemente din colțul extrem de dreapta sus al tabelului periodic (cel mai frecvent oxigen, fluor, clor). Clorura de sodiu este un compus ionic.
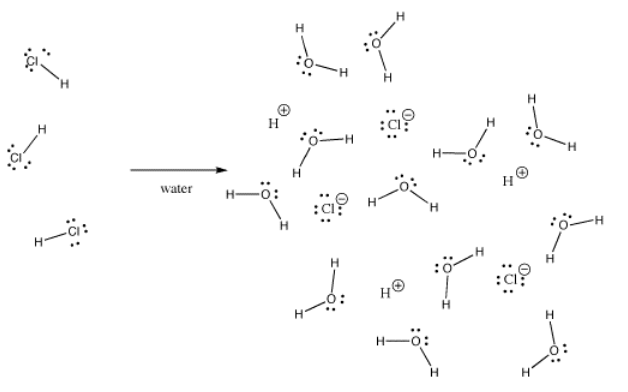
Multe legături pot fi covalente într-o situație și ionice în alta. De exemplu, clorura de hidrogen, HCl, este un gaz în care hidrogenul și clorul sunt legați covalent, dar dacă HCl este barbotat în apă, acesta se ionizează complet pentru a da H+ și Cl- dintr-o soluție de acid clorhidric. Chiar și în HCl gazos, sarcina nu este distribuită uniform. Clorul este parțial negativ, iar hidrogenul este parțial pozitiv.
Hidroxidul de potasiu, KOH, conține o legătură care este covalentă (O-H) și una care este ionică (K-O). Hidrogenul este dificil, deoarece se află atât în partea de sus a tabelului periodic, cât și în partea stângă. Este doar suficient de electropozitiv pentru a forma legături ionice în unele cazuri. Este doar suficient de electronegativ pentru a forma legături covalente în alte cazuri.
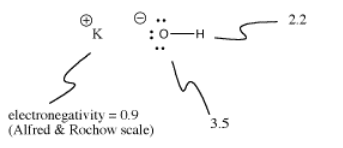
În KOH, legătura K-O este ionică deoarece diferența de electronegativitate dintre potasiu și oxigen este mare. Diferența de electronegativitate dintre oxigen și hidrogen nu este mică. O legătură O-H se poate ioniza uneori, dar nu în toate cazurile.
Uneori, ionizarea depinde de ceea ce se mai întâmplă în cadrul unei molecule. Deoarece legătura K-O din hidroxidul de potasiu este ionică, nu este foarte probabil ca legătura O-H să se ionizeze. Există deja o sarcină negativă pe oxigen. Separarea sarcinilor costă energie, așa că este mai dificil să se pună o a doua sarcină negativă pe oxigen prin ionizarea și a legăturii O-H. În mod frecvent, primele ionizări în molecule sunt mult mai ușoare decât a doua ionizare.
Exercițiu \(\PageIndex{1}\)
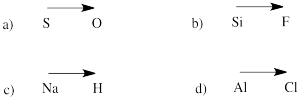
Precizați direcția polarității într-o legătură între atomii din următoarele perechi:
a) sulf-oxigen b) siliciu-fluor
c) hidrogen-sodiu d) clor-aluminiu
Răspuns
Pentru că este atât de frecvent ca un element din extrema stângă a tabelului periodic să fie prezent sub formă de cation, și că elementele din extrema dreaptă poartă sarcină negativă, putem presupune adesea că un compus care conține un exemplu din fiecare va avea cel puțin o legătură ionică.
Exercițiu \(\PageIndex{2}\)
Desenați structurile următorilor compuși. Fiecare dintre ei conține cel puțin un anion și un cation.
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Răspuns
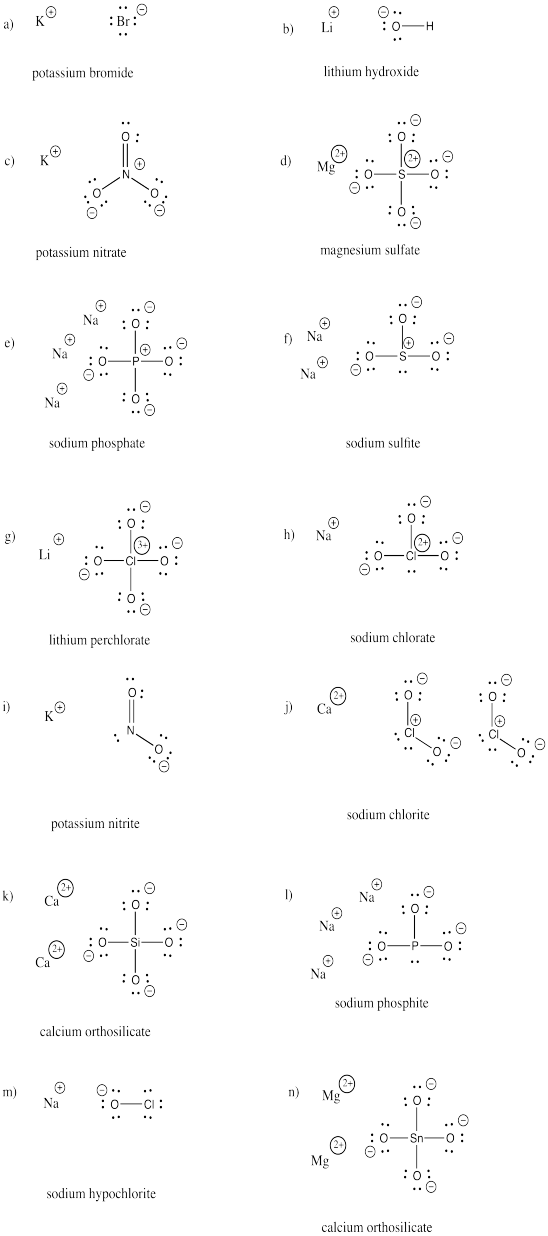
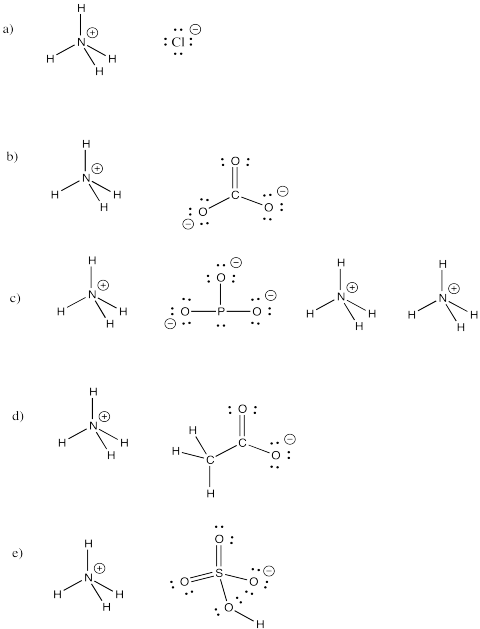
Exercițiu \(\PageIndex{3})
Ion de amoniu, NH4+, este un ion molecular comun. Desenați structurile următorilor compuși care includ acest ion.
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Răspuns
Exercițiu \(\PageIndex{4}\)
Mulți anioni au nume care vă spun ceva despre structura lor.
| prefix- sau -sufix |
semnificație comună |
exemplu de nume | exemplu de formulă |
| -.ide | atomul este prezent sub formă de anion | clorură | Cl – |
| -ate | atomul este prezent sub formă de oxianion; de obicei, o formă comună | clorat | ClO3- |
| -ite | atomul este prezent ca oxi-anion, dar cu mai puțini oxigeni (sau cu o „stare de oxidare” mai mică decât o altă formă comună | clorit | ClO2- |
| per- | atomul este prezent ca oxianion, dar cu un număr și mai mare de oxigen decât forma „-at” | perclorat | ClO4- |
| hipo- | atomul este prezent ca oxi-anion, dar cu și mai puțini oxiani decât forma „-ite” | hipoclorit | ClO- |
Utilizând tabelul ca ghid, propuneți denumiri pentru următorii anioni:
a) Br- b) O2- c) F- d) CO32- (oxanion comun) e) NO3- (oxanion comun) f) NO2-
g) S2- h) SO42- (oxanion comun) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (oxanion comun) o) PO33- p) I- q) IO3- (oxianion comun) r) IO4-
Răspuns a)
bromură
Răspuns b)
oxid
Răspuns c)
fluorură
Răspuns d)
carbonat
Răspuns e)
nitrat
Răspuns f)
nitrit
Răspuns g)
sulfură
Răspuns g)
sulfură
Răspuns g)
sulfură
. Răspuns h)
sulfat
Răspuns i)
sulfit
Răspuns j)
persulfat
Răspuns k)
carbură
Răspuns l)
nitrură
Răspuns m)
arsenură
Răspuns n)
fosfat
Răspuns o)
fosfit
Răspuns p)
iodură
Răspuns q)
iodat
Răspuns r)
periodat
Atribuție
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)
.