Spectrele de emisie atomică
Electronii dintr-un atom tind să fie aranjați în așa fel încât energia atomului să fie cât mai mică posibil. Starea fundamentală a unui atom este starea de cea mai joasă energie a atomului. Atunci când acești atomi primesc energie, electronii absorb energia și se deplasează la un nivel energetic superior. Aceste niveluri de energie ale electronilor din atomi sunt cuantificate, ceea ce înseamnă din nou că electronul trebuie să se deplaseze de la un nivel de energie la altul în pași discreți, mai degrabă decât continuu. O stare excitată a unui atom este o stare în care energia sa potențială este mai mare decât starea fundamentală. Un atom aflat în stare excitată nu este stabil. Când revine la starea fundamentală, el eliberează energia pe care o dobândise anterior sub formă de radiație electromagnetică.
Atunci, cum dobândesc atomii energie în primul rând? O modalitate este de a trece un curent electric printr-un eșantion închis al unui gaz la presiune scăzută. Deoarece nivelurile energetice ale electronilor sunt unice pentru fiecare element, fiecare tub de descărcare în gaz va străluci cu o culoare distinctivă în funcție de identitatea gazului (vezi mai jos).

Semnele cu „neon” sunt exemple familiare de tuburi cu descărcare în gaz. Cu toate acestea, numai semnele care strălucesc cu culoarea roșu-portocaliu observată în figură sunt de fapt umplute cu neon. Însemnele de alte culori conțin diferite gaze sau amestecuri de gaze.
Științii au studiat culoarea roz distinctivă a descărcării de gaz creată de hidrogenul gazos. Când un fascicul îngust al acestei lumini a fost privit printr-o prismă, lumina a fost separată în patru linii cu lungimi de undă foarte specifice (și frecvențe, deoarece \(\lambda\) și \(\nu\) sunt invers legate). Un spectru de emisie atomică este modelul de linii format atunci când lumina trece printr-o prismă pentru a o separa în diferitele frecvențe de lumină pe care le conține. Figura de mai jos prezintă spectrul de emisie atomică al hidrogenului.
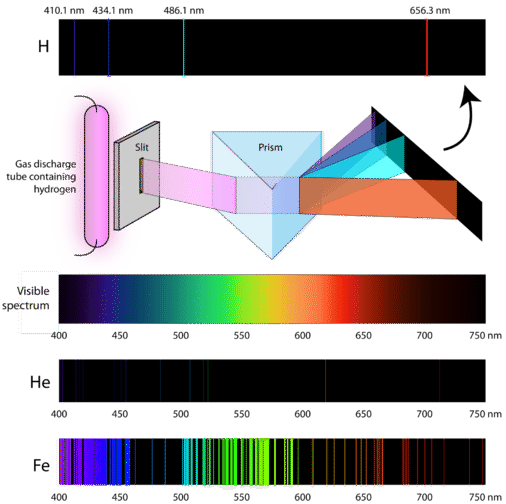
Teoria clasică nu a putut explica existența spectrelor de emisie atomică, cunoscute și sub numele de spectre de emisie de linie. Conform fizicii clasice, un atom în stare fundamentală ar fi capabil să absoarbă orice cantitate de energie și nu doar cantități discrete. De asemenea, atunci când atomii se relaxează înapoi la o stare de energie inferioară, ar putea fi eliberată orice cantitate de energie. Acest lucru ar duce la ceea ce se numește un spectru continuu, în care sunt reprezentate toate lungimile de undă și frecvențele. Lumina albă privită printr-o prismă și un curcubeu sunt exemple de spectre continue. Spectrele de emisie atomică au fost o dovadă în plus a naturii cuantificate a luminii și au condus la un nou model al atomului bazat pe teoria cuantică
.