Tendințe periodice
În primul rând, ne vom concentra asupra atomilor individuali și ne vom gândi la tendințele asociate cu poziția unui element în tabelul periodic. Vom folosi ca prim model compușii organici simpli etanul, metilamina și etanolul, dar conceptele se aplică în egală măsură și la biomolecule mai complexe cu aceleași funcționalități, de exemplu lanțurile laterale ale aminoacizilor alanină (alcan), lizină (amină) și serină (alcool).
Tendința periodică orizontală a acidității și bazicității:
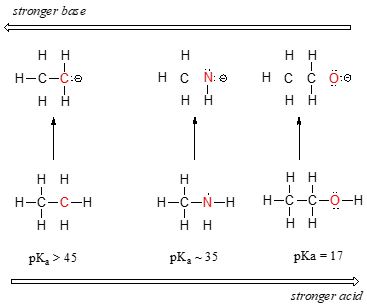
Potem observa o tendință clară a acidității pe măsură ce ne deplasăm de la stânga la dreapta de-a lungul celui de-al doilea rând al tabelului periodic, de la carbon la azot și oxigen. Cheia pentru a înțelege această tendință este de a lua în considerare baza conjugată ipotetică în fiecare caz: cu cât este mai stabilă (mai slabă) baza conjugată, cu atât este mai puternic acidul. Priviți unde ajunge sarcina negativă în fiecare bază conjugată. În baza conjugată a etanului, sarcina negativă este purtată de un atom de carbon, în timp ce pe baza conjugată a metilaminei și a etanolului sarcina negativă este localizată pe un azot și, respectiv, pe un oxigen. Amintiți-vă din secțiunea 2.4A că electronegativitatea crește, de asemenea, pe măsură ce ne deplasăm de la stânga la dreapta de-a lungul unui rând al tabelului periodic, ceea ce înseamnă că oxigenul este cel mai electronegativ dintre cei trei atomi, iar carbonul cel mai puțin.
Nota
Cu cât un atom este mai electronegativ, cu atât este mai capabil să poarte o sarcină negativă. Bazele mai slabe au sarcini negative pe atomi mai electronegativi; bazele mai puternice au sarcini negative pe atomi mai puțin electronegativi.
Așa, anionul metoxid este cel mai stabil (cea mai mică energie, cel mai puțin bazic) dintre cele trei baze conjugate, iar anionul carbanion de etil este cel mai puțin stabil (cea mai mare energie, cel mai bazic). Invers, etanolul este cel mai puternic acid, iar etanul cel mai slab acid.
Când ne deplasăm pe verticală în cadrul unei anumite coloane a tabelului periodic, observăm din nou o tendință periodică clară în ceea ce privește aciditatea. Acest lucru este cel mai bine ilustrat cu haloacizii și halogenurile: bazicitatea, ca și electronegativitatea, crește pe măsură ce ne deplasăm în susul coloanei.
Tendința periodică verticală a acidității și bazicității:

În mod invers, aciditatea în haloacizi crește pe măsură ce ne deplasăm în josul coloanei.
Pentru a da sens acestei tendințe, vom lua din nou în considerare stabilitatea bazelor conjugate. Deoarece fluorul este cel mai electronegativ element halogenat, ne-am putea aștepta ca fluorura să fie, de asemenea, cel mai puțin bazic ion halogenat. Dar, de fapt, este cel mai puțin stabil și cel mai bazic! Se pare că, atunci când ne deplasăm pe verticală în tabelul periodic, dimensiunea atomului prevalează asupra electronegativității sale în ceea ce privește bazicitatea. Raza atomică a iodului este de aproximativ două ori mai mare decât cea a fluorului, astfel încât, într-un ion iodură, sarcina negativă este răspândită pe un volum semnificativ mai mare:

Aceasta ilustrează un concept fundamental în chimia organică:
Cargiile electrostatice, fie ele pozitive sau negative, sunt mai stabile atunci când sunt „răspândite” pe o suprafață mai mare.
Vom vedea această idee exprimată din nou și din nou pe parcursul studiului nostru de reactivitate organică, în multe contexte diferite. Deocamdată, aplicăm conceptul doar la influența razei atomice asupra rezistenței bazei. Deoarece fluorura este cea mai puțin stabilă (cea mai bazică) dintre bazele conjugate ale halogenurilor, HF este cel mai puțin acid dintre haloacizi, fiind doar puțin mai puternic decât un acid carboxilic. HI, cu un \(pK_a\) de aproximativ -9, este aproape la fel de puternic ca acidul sulfuric.
Mai important pentru studiul chimiei organice biologice, această tendință ne spune că tiolii sunt mai acizi decât alcoolii. \(pK_a\) al grupului tiol de pe lanțul lateral al cisteinei, de exemplu, este de aproximativ 8,3, în timp ce \(pK_a\) pentru grupul alcool de pe lanțul lateral al serinei este de ordinul a 17.
Îți amintești conceptul de „forță motrice” care a fost introdus în secțiunea 6.2? Amintiți-vă că forța motrice pentru o reacție se bazează de obicei pe doi factori: stabilitatea relativă a sarcinii și energia totală relativă a legăturii. Să vedem cum se aplică acest lucru la o reacție acido-bazică simplă între acidul clorhidric și ionul fluorură:
\
Știm că HCl (\(pK_a\) -7) este un acid mai puternic decât HF (\(pK_a\) 3.2), deci echilibrul reacției se află de partea produsului: reacția este exergonică, iar o „forță motrice” împinge reactantul spre produs.
Ce explică această forță motrice? Să luăm în considerare mai întâi factorul de sarcină: după cum tocmai am învățat, ionul clorură (pe partea produsului) este mai stabil decât ionul fluorură (pe partea reactantului). Acest lucru explică parțial forța motrice care trece de la reactant la produs în această reacție: trecem de la un ion mai puțin stabil la un ion mai stabil.
Cum rămâne cu energia totală de legătură, celălalt factor al forței motrice? Dacă consultați un tabel al energiilor de legătură, veți vedea că legătura H-F de pe partea produsului este mai energetică (mai puternică) decât legătura H-Cl de pe partea reactantului: 570 kJ/mol vs 432 kJ/mol, respectiv). Acest lucru contribuie, de asemenea, la forța motrice: trecem de la o legătură mai slabă (mai puțin stabilă) la o legătură mai puternică (mai stabilă).
.