24th Annual Glaucoma Report
Căutați linkurile de mai jos pentru a citi alte articole din actualizarea anuală privind glaucomul:
Glaucoma Care with Laser Precision
MIGS Madness: Un atlas de opțiuni
Controlul operațiilor invazive de glaucom
Glaucom: Lifestyles of the Antioxidant Rich and Famous (Earn 2 CE Credits)
Experții nu au ajuns încă la un consens asupra unei etiologii universal acceptate a glaucomului. Cu toate acestea, ei sunt de acord asupra unui lucru: scăderea presiunii intraoculare (PIO) este singurul factor de risc modificabil pentru încetinirea progresiei acestuia. Farmacoterapia topică este abordarea tradițională de primă linie, iar opțiunile sunt mai abundente ca niciodată.
Acest articol, partea a treia a seriei noastre Take Charge of Glaucoma, explorează numeroasele medicamente pe care le pot folosi medicii OD, cu sfaturi despre când să folosească fiecare terapie pentru fiecare pacient.
Autonomie precoce
Medicamentele care acționează asupra sistemului nervos autonom (de ex, colinergicele și adrenergicele) au stat la baza terapiei glaucomului încă din anii 1800.1,2 Colinergicele induc miosul, care întinde și stimulează plasa trabeculară (TM) pentru a crește fluxul apos acolo și spre canalul Schlemm.3 Membrii acestei clase includ pilocarpina, carbacholul, fizostigmina, neostigmina și ecotiofatul. Dintre aceștia, doar pilo este încă utilizat în mod curent. Tratamentul prezintă un răspuns în funcție de doză, cu o scădere a PIO de aproximativ 20% atunci când este prescris QID.4
Take Charge of Glaucoma
Să urmați linkurile de mai jos pentru a citi alte articole din seria noastră de patru părți despre glaucom:
Partea întâi: Glaucomul: O cruciadă a asistenței medicale primare
Partea a doua: Pregătirea setului de instrumente de diagnosticare
Partea a patra: Jucați un rol în îngrijirea postoperatorie a glaucomului
Deși eficientă, utilizarea colinergicelor este limitată de efectele sale secundare oculare și sistemice. Acestea includ spasmul mușchilor ciliari (cu cefalee asociată și miopie indusă), miopie, toxicitate corneană, roșeață, uveită, posibila formare de cataractă, depresie respiratorie și tulburări gastrointestinale. Mai mult, medicamentele mai noi au o eficacitate mai mare de scădere a PIO, ceea ce face ca substanțele colinergice să fie rezervate pentru cazuri specifice în care efectul mioritic poate avea un beneficiu suplimentar, cum ar fi închiderea acută a unghiului.
Agoniștii adrenergici, pe de altă parte, au impact asupra receptorilor alfa sau beta adrenergici (sau asupra ambelor, dacă sunt neselectivi). Epinefrina, principalul agent neselectiv, reduce PIO prin diminuarea mai întâi a producției apoase și apoi prin creșterea debitului de ieșire prin TM.5 Din păcate, are o aplicare limitată din cauza efectelor secundare sistemice semnificative. Dipivefrina, un promedicament al epinefrinei dezvoltat în anii 1970, permite utilizarea unor concentrații mult mai mici ale compusului părinte, cu mai puține efecte sistemice.6 Adrenergicii neselectivi au o utilizare minimă în prezent, cu excepția cazurilor în care alte medicamente pot fi contraindicate.
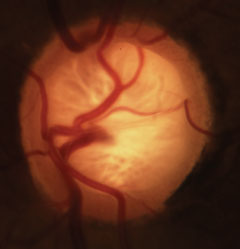
Cupaj glaucomatos cu pierderea caracteristică a marginii neuroretiniene, a laminei și alterarea vasculaturii. Faceți clic pe imagine pentru a o mări.
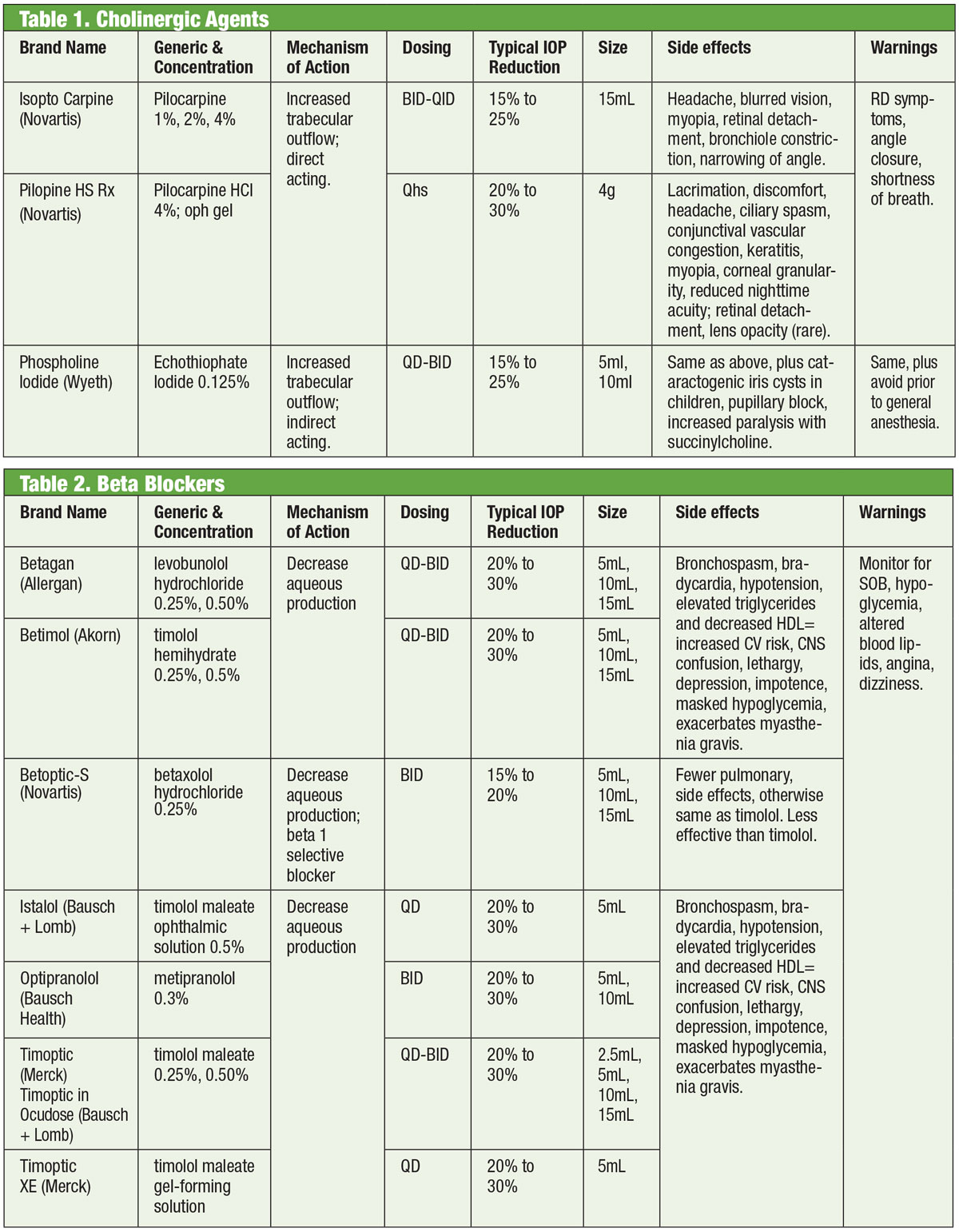
Beta-blocante
Antagoniștii adrenergici, sau beta (β)-blocantele, inhibă producția apoasă și reprezintă standardul după care sunt comparate noile medicamente. În mod specific, β-blocantele reduc ultrafiltrarea, ceea ce limitează disponibilitatea substratului umorii apoase disponibil pentru transmiterea în camera posterioară.1,7,8 Aceste medicamente pot fi neselective, ceea ce înseamnă că inhibă ambele izoforme ale receptorilor β-adrenergici (β1 și β2), sau cardioselective, care au o afinitate mult mai mare pentru receptorul β1. β2 este adreno-receptorul predominant al ochiului, astfel încât agenții neselectivi vor avea un impact mai mare asupra controlului PIO.9,10
Blocantele β-topice includ timolol, levobunolol, metipranolol, carteolol și betaxololol. Doar betaxololul este cardioselectiv – ceea ce îl face util în anumite contraindicații, dar poate fi mai puțin eficient în reducerea PIO.11 β-blocantele reduc PIO cu 20% până la 30% și pot fi administrate de două ori pe zi. Acestea pot fi, de asemenea, administrate o dată pe zi, în special atunci când se utilizează soluții gelatinoase, datorită timpului crescut de contact ocular.12,13 Antagoniștii adrenergici pot avea un impact mai mic în timpul somnului, astfel încât trebuie să se acorde atenție atunci când β-blocantele sunt administrate aproape de ora de culcare, în special dacă sunt prescrise ca regim o dată pe zi.14,15 Dacă pacienții iau β-blocante sistemice, efectul hipotensiv ocular al β-blocantelor topice este redus, iar alte clase de medicamente topice ar putea fi luate în considerare.16
Deși această clasă de medicamente trebuie evitată în cea mai mare parte în afecțiuni pulmonare sau cardiace, în cazuri selecționate poate fi rezonabil să se ia în considerare terapia cu beta-blocante. Cu toate acestea, acest lucru trebuie făcut cu acordul specialistului corespunzător (cardiologie sau pneumologie).
Tabele: Bruce Onofrey, OD, RPh. Faceți clic pe imagine pentru a o mări.
În general, totuși, utilizarea β-blocantelor trebuie evitată la cei cu bloc atrioventricular, bradicardie sinusală și boală pulmonară obstructivă.17
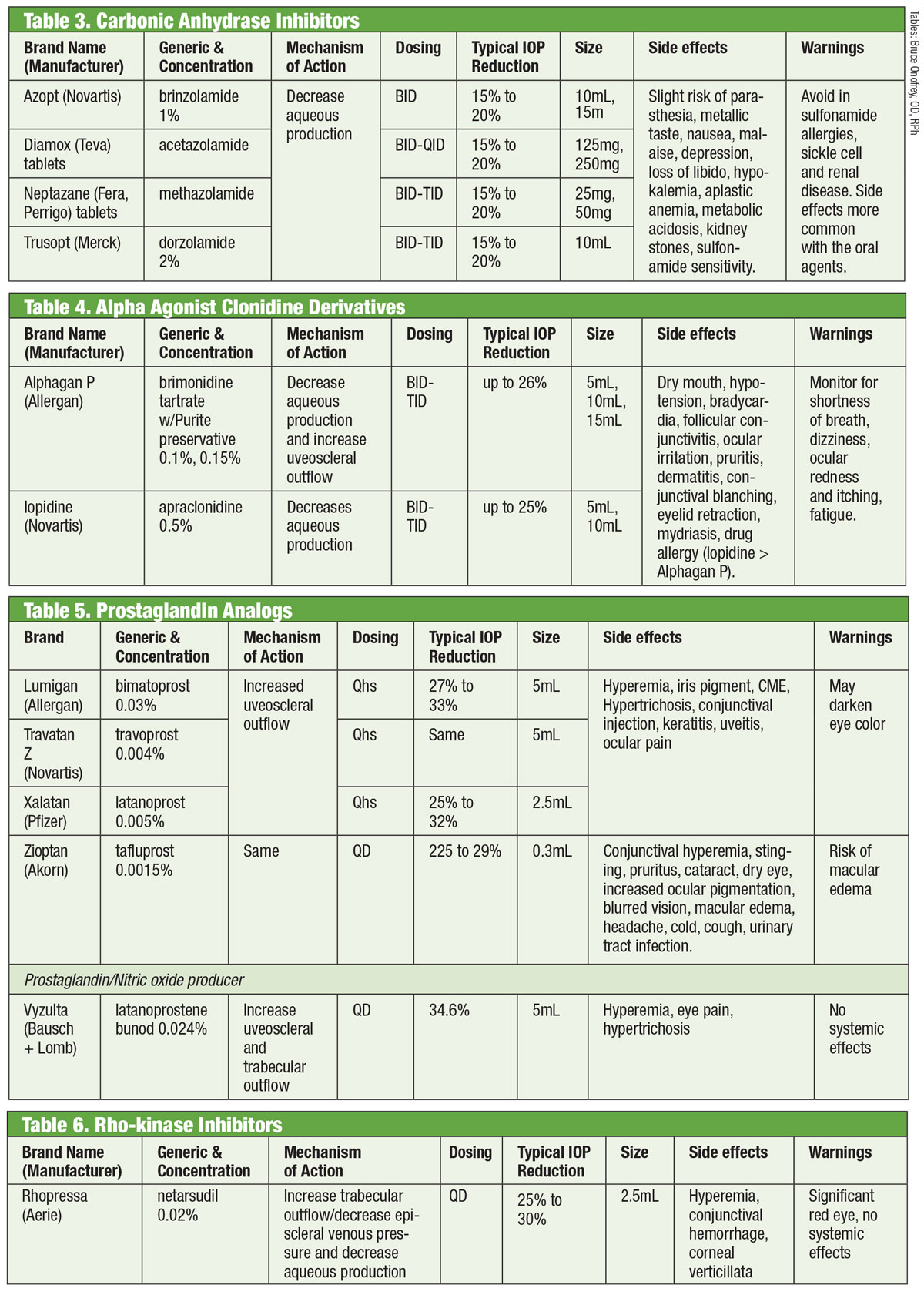
Inhibitori ai anhidrazei carbonice
Cercetătorii au recunoscut capacitatea inhibitorilor anhidrazei carbonice (IAC) pe cale orală de a scădea PIO încă din anii 1950.18 Ei realizează acest lucru prin suprimarea producției apoase.18 Cu toate acestea, efectele secundare sistemice (cum ar fi oboseala, tulburările gastrointestinale și parestezia) limitează utilizarea lor cronică în glaucom.18 IAC pe cale orală sunt încă utilizate în cazurile în care IAC topice cauzează hipersensibilitate sau când utilizarea picăturilor este exclusă, precum și în cazurile de închidere acută a unghiului.18 Încercările de a formula o varietate topică au avut succes odată cu introducerea dorzolamidei la mijlocul anilor 1990 și, la scurt timp după aceea, a brinzolamidei.19
Există cel puțin șapte izoenzime diferite ale anhidrazei carbonice (CA), CA-II din procesele ciliare fiind predominant implicată în producția apoasă.18 Atât dorzolamida, cât și brinzolamida sunt inhibitori puternici ai acestei izoenzime, dar au câteva diferențe relevante din punct de vedere clinic. De exemplu, dorzolamida are un pH de 5,6, în timp ce brinzolamida are un pH de 7,5. În plus, brinzolamida este disponibilă sub formă de suspensie. Acestea sunt doar câteva dintre proprietățile care pot explica efectele secundare individuale ale produselor, care pot include înțepături în cazul dorzolamidei și vedere încețoșată în cazul brinzolamidei.19
Deși medicamentele sunt etichetate de FDA pentru o dozare TID, unii practicieni optează pentru administrarea BID. În cazul brinzolamidei, studiile de fază III raportează reduceri ale PIO echivalente din punct de vedere clinic cu regimuri BID sau TID.20 Alții nu raportează diferențe semnificative din punct de vedere statistic între administrarea BID sau TID în cazul dorzolamidei.18 Alternativ, alții susțin administrarea TID pentru monoterapie și administrarea BID atunci când este utilizată ca terapie adjuvantă.21
Tabele: Bruce Onofrey, OD, RPh. Faceți clic pe imagine pentru a o mări.
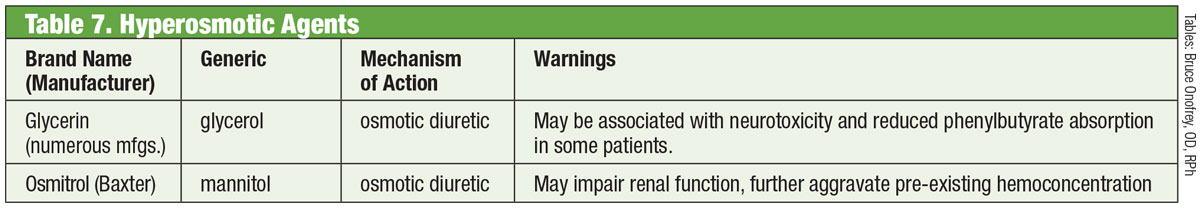
Agonisti alfa
Clonidina a reprezentat cel mai timpuriu alfa agonist (AA) eficient pentru scăderea PIO. Cu toate acestea, chiar și sub formă topică a produs efecte secundare sistemice profunde de bradicardie, sedare și hipotensiune arterială.22 Substituția grupului amidă al apraclonidinei a diminuat penetrarea în bariera hemato-encefalică și, prin urmare, efectele secundare. Din păcate, eficacitatea sa diminuată în timp și o incidență crescută a alergiilor oculare o limitează la o utilizare pe termen scurt.
Introdusă în 1997, brimonidina este un AA puternic, cu o selectivitate de 32 de ori mai mare pentru adrenoreceptorii β2 decât apraclonidina.22 Reduce PIO printr-un mecanism dublu de scădere a producției apoase și de creștere a fluxului uveoscleral.23 Ca și predecesorul său, are o rată de alergie notabilă (până la 20%), care poate apărea până la opt luni de la inițierea tratamentului.22 Au fost dezvoltate trei formulări, fiecare cu eficacitate similară: 0,2% cu clorură de benzalconiu (BAK); și 0,15% și 0,1% cu conservantul Purite.24 Allergan a renunțat de atunci la formularea cu conservant BAK.
The Straight Dope
Marijuana medicală a făcut mare vâlvă în ultima vreme, datorită unei serii de modificări legislative în Statele Unite. Deși a fost cercetată ca metodă de reducere a PIO încă din anii 1970, cercetătorii au constatat că este capabilă să scadă PIO doar pentru perioade scurte de timp. Acest lucru, împreună cu profilul său de efecte secundare destul de mare, îl face un candidat slab pentru tratament. Cu toate acestea, cercetările spun că ar putea avea un rol de jucat pentru „pacienții cu glaucom în stadiu terminal care au eșuat în terapia medicală maximă și în intervenția chirurgicală sau care sunt candidați slabi la intervenții chirurgicale.”
Sun X, Xu C, Chadha N,et al. Marijuana pentru glaucom: o rețetă pentru dezastru sau un tratament? Yale J Biol Med. 2015 Sep; 88(3): 265-9.
Chiar dacă efectele secundare se corelează în cea mai mare parte cu utilizarea prostaglandinelor, literatura de specialitate arată uveita anterioară indusă de brimonidină. 25 Durata a variat de la șapte zile la cinci ani, cu o medie de aproape 20 de luni.
Analogi de prostaglandine
Acestea asigură cea mai robustă reducere a PIO dintre toate picăturile prin creșterea fluxului apoasă uveosclerală. Analogii de prostaglandină (PGA) se leagă de receptorii din corpul ciliar și induc relaxarea mușchiului neted și modifică matricea extracelulară din cadrul mușchiului ciliar pentru a crește fluxul apos prin căile uveosclerale.26 Administrate o dată pe zi, de obicei la culcare, PGA-urile produc o reducere a PIO de 30% până la 35%; opțiunile includ latanoprost, bimatoprost, travoprost și tafluprost (furnizate într-o singură doză, opțiune fără conservanți).26 Cel mai frecvent efect secundar al PGA-urilor este hiperemia conjunctivală, adesea în primele câteva săptămâni după inițierea tratamentului.26 Pot fi observate, de asemenea, iritații oculare, exacerbarea afecțiunilor inflamatorii existente (edem macular, irita), atrofia plăcii adipoase periorbitale, pigmentarea pielii perioculare, a genelor și a irisului și hipertricoza.26
O nouă variantă în categoria analogilor de prostaglandine este latanoprostene bunod 0,024%. Acest compus are un mecanism dublu: creșterea debitului uveoscleral și creșterea debitului din plasa trabeculară prin impactul oxidului nitric.27 Ochiul descompune latanoprostenul bunod de două ori pentru a obține componentele active acidul latanoprost și oxidul nitric.28 Acesta din urmă are un impact asupra unei căi de semnalizare care relaxează componentele contractile din TM, ceea ce crește fluxul de ieșire.28 Impactul suplimentar scade PIO >1 mm Hg față de latanoprostul singur în mai multe momente de timp, cu o reducere totală a PIO variind de la 7,5 mm Hg la 9,1 mm Hg. Efectele secundare cu latanoprostene bunod au fost comparabile cu cele ale latanoprostului singur, cu posibil mai puțină pigmentare perioculară și hipertricoză, conform investigatorilor.28,29
Inhibitori de ROCK
Într-un ochi normal, principala cale de drenaj pentru umoarea apoasă este TM. Rezistența umorului apos prin această structură este crescută la pacienții cu glaucom, crescând PIO.30 Până de curând, medicamentele pentru glaucom nu au reușit să vizeze această structură. Acest lucru s-a schimbat în 2017, odată cu introducerea Rhopressa (netarsudil 0,02%, Aerie), un inhibitor al rho-kinazei (ROCK).
Tabelul: Bruce Onofrey, OD, RPh. Faceți clic pe imagine pentru a o mări.
Rho-kinaza este exprimată pe scară largă în multe țesuturi, inclusiv în TM, unde promovează asamblarea fibrelor de tensiune de actină și reglează contracția celulară.31 Inhibitorii ROCK cresc fluxul apos prin diminuarea contracției celulare determinate de actină și miozină și prin reducerea producției de proteine din matricea extracelulară.32 Rhopressa are, de asemenea, acțiune inhibitoare împotriva transportatorului de noradrenalină (NET), ceea ce o face un inhibitor ROCK/NET. Mecanismul NET poate fi rezultatul reducerii fluxului sanguin către corpul ciliar prin vasoconstricția indusă de norepinefrină, ceea ce duce la scăderea producției apoase.33 În plus, netarsudilul scade și presiunea venoasă episclerală (EVP), oferind astfel multiple căi de reducere a PIO.32 Cel mai frecvent efect secundar ocular este hiperemia oculară (aproximativ jumătate dintre pacienții tratați), care în cea mai mare parte este ușoară, tranzitorie și se rezolvă de la sine.32
De remarcat, rho însuși joacă un rol important în creșterea și ghidarea axonilor, precum și în reglarea supraviețuirii și morții neuronale.34 Cercetătorii au descoperit că, în urma unei leziuni a nervului optic, aplicarea topică de netarsudil reduce moartea celulelor ganglionare retiniene și favorizează regenerarea axonală.34
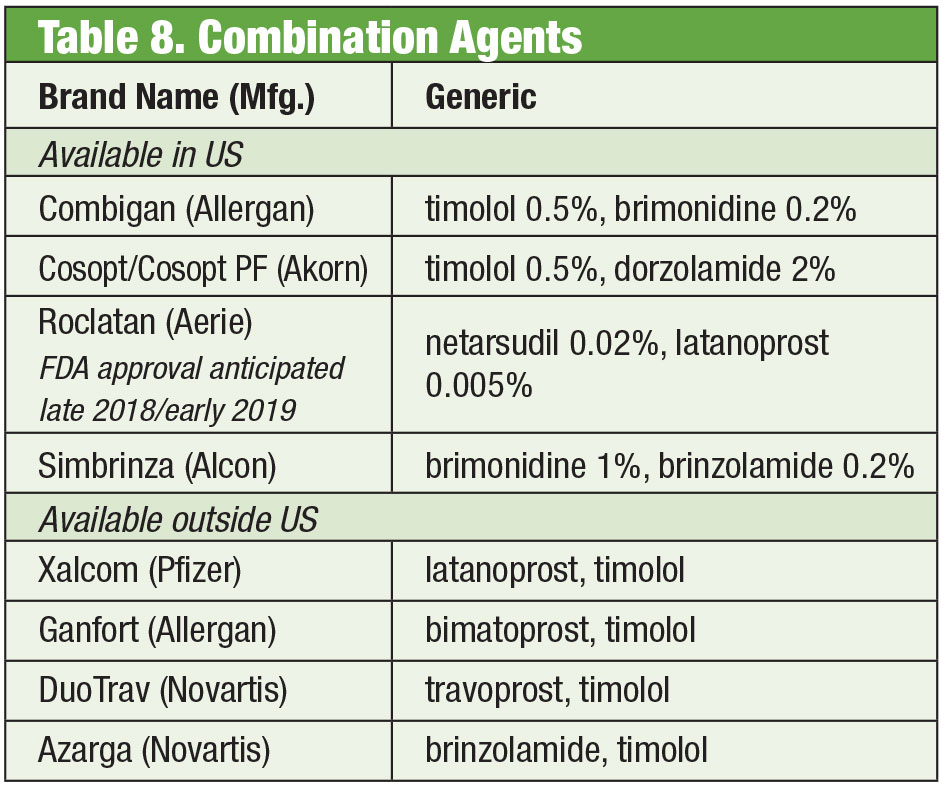
Să intrăm în combinație
Câteodată pacienții au nevoie de mai mult decât ceea ce oferă produsele din comerț. Sensibilitatea pacientului sau toxicitatea suprafeței oculare ca urmare a utilizării cronice a conservanților poate duce la căutarea unor alternative. Unele medicamente compuse sunt disponibile fără conservanți. În cazul în care conformitatea este o problemă, aceste amestecuri pot conține până la patru medicamente într-un singur flacon. Mai mult, multe combinații fixe au fost utilizate în mod eficient în afara Statelor Unite, dar nu sunt aprobate în prezent de FDA; prepararea medicamentelor combinate oferă medicilor americani acces la aceste regimuri. În cazul în care costul este o limitare, preparatele combinate ar putea fi un avantaj suplimentar. În timp ce produsul preparat nu este adesea acoperit de planul de asigurare al pacientului, prețul unuia sau a două produse combinate poate fi mai rentabil decât cel al mai multor opțiuni cu un singur medicament, chiar și al formulărilor generice. Două farmacii de compoziție oferă mai multe variante prestabilite: Simple Drops de la Imprimis Pharmaceuticals și linia de produse Omni de la Ocular Science. Personalizarea suplimentară este posibilă și de la fiecare dintre ele.
Deși agenții individuali sunt aprobați de FDA, anumite combinații pot să nu fie. Depinde de practician să cântărească riscurile și beneficiile conformării.
Produse compuse pentru glaucom:
Simple Drops (Imprimis Pharmaceuticals)
Toate disponibile fără conservanți.
– Tim-Lat PF (timololol/latanoprost)
– Brim-Dor PF (brimonidină/dorzolamidă)
– Tim-Brim-Dor PF (timololol/brimonidină/dorzolamidă)
– Tim-Dor-Lat PF (timolol/dorzolamidă/latanoprost)
– Tim.Brim-Dor-Lat PF (timololol/brinzolamidă/dorzolamidă/latanoprost)
– Dor-Tim (dorzolamidă/timololol)
– Dorzolamidă PF
– Latanoprost PF
Omni Drops (Ocular Science)
Conține clorură de benzalconiu, dar în concentrații mai mici (0.001%) decât formulele generice obișnuite (0,002%).
– Timolol/latanoprost
– Timolol/brimonidină/dorzolamidă (formula AM)*
– Timolol/brimonidină/dorzolamidă/latanoprost (formula PM)*
* Destinate a fi utilizate la unison, versiunea AM fiind lipsită de prostaglandină, care în mod obișnuit se administrează o singură dată pe zi.
Produse combinate fixe
În ciuda eficacității acestor produse individuale, este obișnuit ca mulți pacienți cu glaucom să aibă nevoie de terapii multiple pentru a-și controla afecțiunea. 35 Atunci când este necesară o terapie dublă, poate fi cel mai bine să se ofere același distribuitor, promovând o complianță crescută și reducând impactul asupra suprafeței oculare din cauza toxicității.36 Timololul se asociază cu brimonidina, (sub formă de Combigan, Allergan) și dorzolamida (sub formă de Cosopt, Akorn), ambele administrate de două ori pe zi, cu o opțiune fără conservanți disponibilă pentru produsul timololol-dorzolamida. O altă combinație de două ori pe zi – Simbrinza – cuplează brimonidina și dorzolamida. Combinațiile fixe prezintă o bună eficacitate atât ca terapie primară, cât și în plus față de PGA-uri. Efectele secundare sunt comparabile cu cele ale componentelor individuale.
Aderarea/percepția pacientului
Deși decizia de a recomanda un tratament poate fi complexă și depinde de mulți factori, odată ce medicul și pacientul sunt de acord să inițieze terapia, trebuie recunoscute anumite fapte de fond și trebuie utilizate principii de bază.
Click pe imagine pentru mărire.
Progresia câmpului vizual și severitatea bolii sunt legate de o aderență slabă.37 Pacienții cu afecțiuni medicale cronice utilizează, în medie, între 30% și 70% din dozele de medicamente prescrise, iar 50% își întrerup medicamentele în primele câteva luni de tratament, conform unui studiu.38 Aderența la medicamentele pentru glaucom este la fel de slabă ca în cazul altor afecțiuni cronice.38 În consecință, poate exista un decalaj de eficacitate-eficacitate în care, deși s-a dovedit că medicamentele topice sunt eficiente în studiile clinice mari, în practică pot fi ineficiente din cauza nerespectării de către pacienți.39
Factori majori care contribuie la o aderență slabă în glaucom sunt, printre altele; profilul de efecte secundare al medicamentelor, costul terapiei, educația pacientului și relația medic-pacient.40 În plus, boala poate fi asimptomatică până târziu în evoluție, cu lipsa de conștientizare a pierderii câmpului vizual.41
Și acum pentru ceva complet diferit
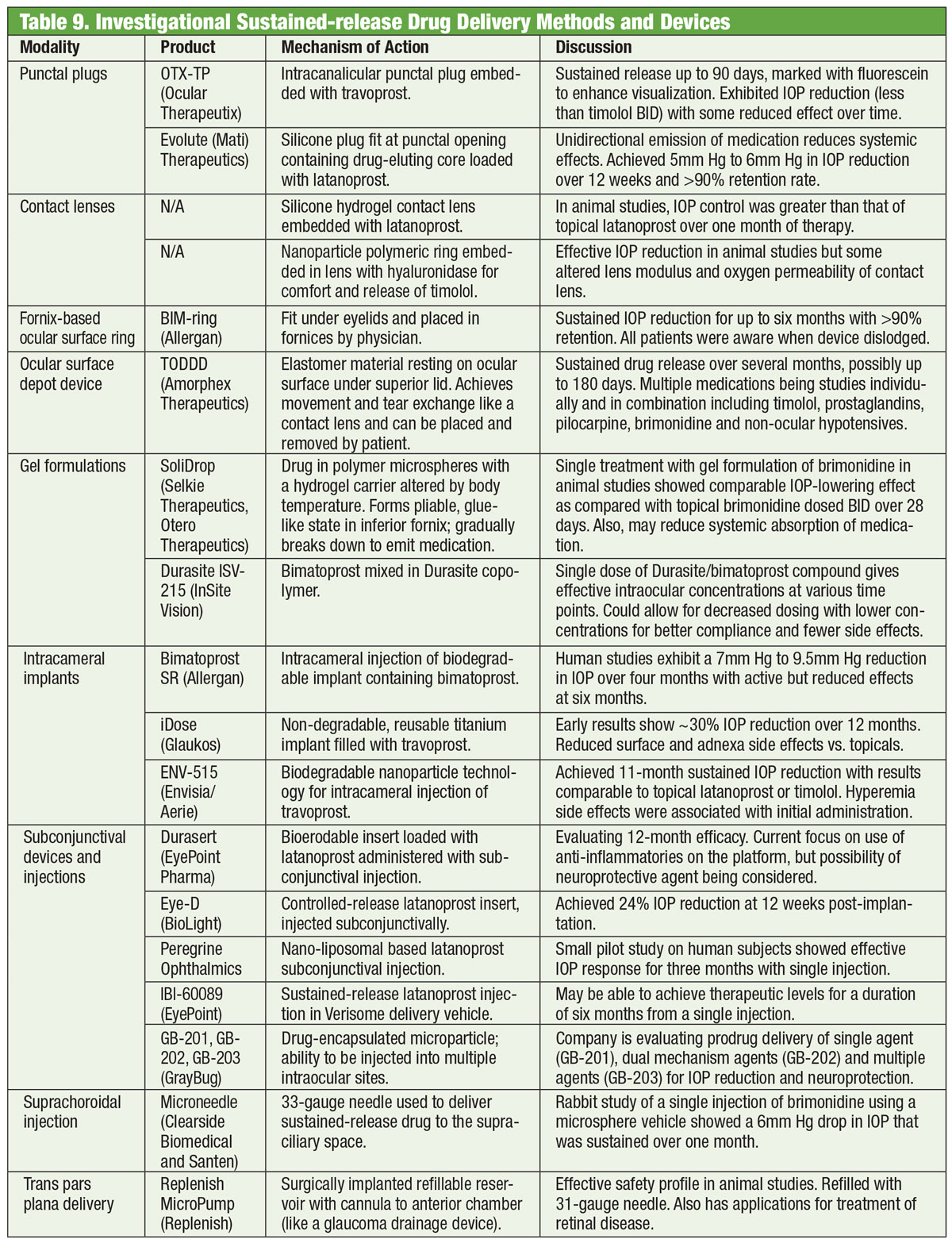
Medicamentele au fost coloana vertebrală a managementului glaucomului timp de mai bine de un secol, iar dezvoltarea de noi medicamente continuă neabătut. Dar unii cercetători caută alternative dincolo de flacon. Ochelarii încorporați cu o bobină electromagnetică, cuplată cu o lentilă de contact care conține o urmă de aur, ar putea într-o zi să ajute la scăderea PIO. Dezvoltată de o companie numită Bionode, combinația este concepută pentru a genera un curent electric care trece prin mușchii ciliari pentru a stimula calea naturală de drenaj și a scădea PIO.
American Academy of Oftalmologie. Ochelarii ar putea într-o zi să trateze glaucomul. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Accesat la 3 iulie 2018.
O barieră suplimentară în calea aderenței este dificultatea cu instilarea picăturilor și programul de dozare.42 De fapt, până la 80% dintre pacienți își contaminează picăturile atingându-și fața, până la 61% nu instilează exact o picătură și, cel mai important, până la 37% ratează ochiul cu picătura.43 Practicianul nu trebuie să presupună niciodată că pacientul este competent în ceea ce privește instilarea picăturilor. Înainte de inițierea tratamentului cu picături, învățați pacientul cum să instileze picăturile în mod corespunzător și cereți-i să demonstreze cu succes instilarea înainte de a părăsi cabinetul. Acest lucru poate fi delegat în mod eficient unui tehnician optometrist și poate fi întărit cu o broșură educațională privind tehnica (PDF imprimabil la www.glaucoma.org/treatment/eyedrop-tips.php), precum și cu utilizarea de videoclipuri precum cel produs de Glaucoma Research Foundation (www.glaucoma.org/treatment/putting-in-eye-drops.php).
Dacă pacientul are dificultăți semnificative în instilarea picăturilor oculare, un dispozitiv mecanic de dozare poate îmbunătăți probabilitatea de succes. Aderența la programul corect de dozare se îmbunătățește prin utilizarea de memento-uri automate bazate pe telecomunicații, aplicații de reamintire pe bază de smartphone și tabletă.44,45 O combinație de educație în cabinet, stabilirea de obiective, regim simplificat de picături și tehnologie ar trebui să fie adoptată pentru a îmbunătăți aderența.46 Abordarea barierelor cunoscute în ceea ce privește aderența la medicație este un prim pas necesar spre succes.
Diminuarea presiunii
PIO este singurul factor de risc glaucomatos cunoscut care poate fi modificat, iar scăderea acesteia s-a dovedit în mod incontestabil că reduce riscul de progresie a bolii.47,48 Scăderea eficientă a PIO devine astfel obiectivul atunci când se tratează pacienții cu glaucom. După ce boala este clasificată cu exactitate, se stabilește de obicei un obiectiv terapeutic. Modelele de practică preferate în Statele Unite sugerează utilizarea unui interval țintă de PIO pe care medicul consideră că va reduce prospectiv riscul de orbire pe durata vieții pacienților, minimizând în același timp povara legată de tratament.49-52
Deși mai multe metodologii pot ajuta la determinarea unei PIO țintă inițiale (PIO prag, calculată, o mărime care se potrivește tuturor), metoda cea mai simplă și cea mai bazată pe dovezi este de a reduce PIO cu un procent față de PIO diurnă de vârf de bază la care se produc leziuni ale nervului optic. PIO este dinamică și prezintă fluctuații pe termen scurt și lung, ceea ce face ca tonometria disponibilă în prezent să nu fie perfect reproductibilă. Prin urmare, se recomandă ca medicul să obțină mai multe citiri ale PIO la diferite momente ale zilei înainte de inițierea tratamentului pentru a încerca să stabilească un vârf diurn al PIO pe care să se bazeze intervalul țintă.53-55 Cu toate acestea, în lipsa obținerii mai multor curbe ale PIO pe 24 de ore, este puțin probabil ca un vârf adevărat să fie vreodată capturat. Clinicianul va trebui, în cele din urmă, să evalueze succesul tratamentului prin reducerea ratei de progresie la testele structurale și funcționale.48,56,57
Reducerile procentuale recomandate ale PIO țintă variază între 20% și 50% în funcție de afecțiune (de ex, suspect de glaucom, hipertensiune oculară, glaucom cu tensiune normală, glaucom cu tensiune înaltă, glaucom cu închidere unghiulară), severitatea de bază a bolii și speranța de viață.58-61
Tabelul: Bruce Onofrey, OD, RPh. Faceți clic pe imagine pentru a o mări.
Pentru început
PGA-urile sunt aprobate pentru tratamentul de primă linie în Statele Unite și sunt mai eficiente în reducerea PIO, au un profil de efecte secundare relativ limitat și se administrează mai puțin frecvent (o dată pe zi) decât alte clase de medicamente.62,63
După ce este selectat un agent specific, pacientul ar trebui să fie revăzut în cel mult patru săptămâni pentru a evalua eficacitatea picăturii, pentru a preveni orice evenimente adverse care pot apărea, pentru a asigura aderența pacientului și pentru a întări valoarea tratamentului.
În cele din urmă, o educație adecvată și o urmărire vigilentă cu teste structurale și funcționale vor ajuta la minimizarea pierderii vederii.
Dr. Dorkowski este coordonatorul clinic pentru programul de îngrijire la domiciliu/viețuire asistată la SCO.
Dr. Williamson este supervizorul rezidențiatului la Memphis VA Medical Center.
Dr. Rixon este medic curant la Memphis VA și este membru al Societății Optometrice de Glaucom.
Dr. Onofrey este autorul cărții The Ocular Therapeutics Handbook.
1. Zimmerman TJ, William P. BogerIII. Agenții blocanți beta-adrenergici și tratamentul glaucomului. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. O istorie a farmacologiei glaucomului. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Direct effects of muscarinic agents on the outflow pathways in human eyes. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. The dose response of human intraocular pressure to pilocarpine. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. Mecanismul de acțiune al medicamentelor adrenergice în glaucom. Investig Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalil epinefrina: un nou pro-drog în tratamentul glaucomului. Ophthalmology. 1978;85(3):268-75.
7. Neufeld AH. Studii experimentale privind mecanismul de acțiune al timololului. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. Mecanismul timololului în scăderea presiunii intraoculare: La ochiul normal. Arch Ophthalmol. 1978;96(11):2045-8.
9. Trope GE, Clark B. Receptorii beta adrenergici în procesele ciliare pigmentate. Br J Ophthalmol. 1982;66:788-92.
10. Wax MB, Molinoff PB. Distribuția și proprietățile receptorilor beta-adrenergici în corpul iris-ciliar uman. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Hertzmark E, Walker AM, Epstein DL. O comparație dublu-mascată a betaxololului vs timololol în tratamentul glaucomului cu unghi deschis. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Beta-blocante oftalmologice de la timolol. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. Evaluarea timololului în glaucomul cronic cu unghi deschis: O dată pe zi vs de două ori pe zi. Arch Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. Efectele timololului, epinefrinei și acetazolamidei asupra fluxului apos în timpul somnului. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. Circadian intraocular pressure variation with beta-blockers. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. Efectele tratamentului sistemic cu beta-blocante asupra eficacității și siguranței brimonidinei și timololului topic. Grupurile de studiu 1 și 2 ale brimonidinei. Ophthalmology. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaucomul și bolile sistemice. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. Proprietăți farmacologice și hipotensive oculare ale inhibitorilor topici ai anhidrazei carbonice. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Livrarea topică a medicamentelor la nivelul ochiului: dorzolamida. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamida suspensie oftalmică: o revizuire a farmacologiei și a utilizării sale în tratamentul glaucomului cu unghi deschis și al hipertensiunii oculare. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. Compararea efectului aditiv de scădere a presiunii intraoculare al latanoprostului și al dorzolamidei atunci când sunt adăugate la timolol la pacienții cu glaucom cu unghi deschis sau hipertensiune oculară: un studiu multicentric, randomizat, deschis, în Grecia. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. Incidența alergiei la brimonidină la pacienții anterior alergici la apraclonidină. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. Eficacitatea și siguranța brimonidinei ca terapie adjuvantă pentru pacienții cu presiune intraoculară crescută într-un studiu comunitar larg, deschis, cu etichetă deschisă. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidină-purită 0,1% versus brimonidină-purită 0,15% de două ori pe zi în glaucom sau hipertensiune oculară: un studiu randomizat pe 12 luni. Curr Med Res Opin. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Uveita anterioară indusă de brimonidină. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Gabelt BT, Kaufman PL. Actualizare privind mecanismul de acțiune al prostaglandinelor topice pentru reducerea presiunii intraoculare. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. Eficacitatea latanoprostene bunod 0,024% comparativ cu timolol 0,5% în scăderea presiunii intraoculare timp de 24 de ore. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprostene bunod soluție oftalmică 0,024% pentru scăderea PIO în glaucom și hipertensiune oculară. Expert Opin Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. Compararea latanoprostene bunod 0,024% și a maleatului de timolol 0,5% în glaucomul cu unghi deschis sau în hipertensiunea oculară: Studiul LUNAR. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. Rețeaua trabeculară: O revizuire de bază a formei și funcției. J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-2838-02-0017. Accesat la 29 iunie 2018.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. Discovery of the ROCK inhibitor netarsudil for the treatment of open-angle glaucoma. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. Two phase 3 clinical trials comparing the safety and efficacy of netarsudil to timolol in patients with elevated intraocular pressure: rho kinase elevated iop treatment trial 1 and 2 (ROCKET-1 and ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. Descoperirea și dezvoltarea preclinică a netarsudilului, un nou agent hipotensiv ocular pentru tratamentul glaucomului. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Sang A, Wang Y, et al. Administrarea topică a unui inhibitor de rock / netudarsud promovează supraviețuirea celulelor ganglionare retiniene și regenerarea axonului după leziuni ale nervului optic. Exp Eye Res. 2017;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Modele de terapie adjuvantă la pacienții cu glaucom care utilizează analogi de prostaglandină. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Combinații fixe. Glaucomul astăzi. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Pasinetti G, Scudeller L, et al. Se corelează ratele de aderență și progresia câmpului vizual glaucomatos? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Using pharmacy claims data to study adherence to glaucoma medications: methodology and findings of the Glaucoma Adherence and Persistency Study (GAPS). Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Stamper R, et al. Eficacitatea medicației de reducere a presiunii intraoculare determinată prin spălare. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. Why do people (still) go blind from glaucoma? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. A view on glaucoma-Are we seeing it clearly? Eye. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. The most common barriers to glaucoma medication adherence: A cross-sectional survey (Un studiu transversal). Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Instilarea picăturilor și glaucomul. Curr Opin Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Automated telecommunication-based reminders and adherence with once-daily glaucoma medication doing: The automated dosing reminder study. JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. The Wills eye glaucoma app: Interesul pacienților și al celor care îi îngrijesc într-o aplicație pentru glaucom bazată pe smartphone și tabletă. J Glaucoma. 2016;25(9):e787-e791.
46. Joseph A, Pasquale LR. Atributele asociate cu aderența la terapia medicală a glaucomului și efectele sale asupra rezultatelor glaucomului: O revizuire bazată pe dovezi și strategii potențiale pentru îmbunătățirea aderenței. Semin Ophthalmol. 2017;32(1):86-90.
47. Clement CI, Bhartiya S, Shaarawy T. Noi perspective privind presiunea intraoculară țintă. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Personalizarea presiunii intraoculare: Presiunea intraoculară țintă în contextul monitorizării presiunii intraoculare de 24 de ore. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. Presiunea țintă în terapia glaucomului. J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. Îngrijirea pacientului cu glaucom cu unghi deschis. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Reducerea agresivă timpurie a presiunii intraoculare, presiunea intraoculară țintă și un concept nou pentru îngrijirea glaucomului. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr. BE, Rosenberg LF, Gedde SJ, et al. Primary open-angle glaucoma Preferred Practice Pattern guidelines. Ophthalmology. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. Modelele de presiune intraoculară diurnă nu sunt repetabile pe termen scurt la persoanele sănătoase. Ophthalmology. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhDemail, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. Reproductibilitatea pe termen lung a modelelor de presiune intraoculară diurnă la pacienții cu glaucom. Ophthalmology. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Variabilitatea de zi cu zi a presiunii intraoculare în glaucom și hipertensiune oculară. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Utilitatea clinică a monitorizării presiunii intraoculare în afara orelor normale de consultație la pacienții cu glaucom. Arch Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Peak intraocular pressure and glaucomatous progression in primary open-angle glaucoma. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Reducerea presiunii intraoculare și progresia glaucomului: Results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. Studiul de intervenție asupra glaucomului avansat (AGIS): Relația dintre controlul presiunii intraoculare și deteriorarea câmpului vizual. Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Progresia câmpului vizual în cadrul studiului colaborativ privind tratamentul inițial al glaucomului. Impactul tratamentului și al altor factori de bază. Ophthalmology. 2009;116(2):200-207.e1.
62. Albert A. Latanoprost în tratamentul glaucomului. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. Impactul introducerii latanoprostului generic asupra aderenței la medicația pentru glaucom. Ophthalmology. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. A randomised, controlled comparison of latanoprostene bunod and latanoprost 0.005% in the treatment of ocular hypertension and open angle glaucoma: Studiul VOYAGER. Br J Ophthalmol. 2015;99(6):738-45.