Lipofilicitatea este probabil cea mai importantă proprietate fizico-chimică a unui potențial medicament, joacă un rol în solubilitate, absorbție, penetrare în membrană, legare la proteinele plasmatice, distribuție, penetrare în SNC și repartiție în alte țesuturi sau organe, cum ar fi ficatul, și are un impact asupra căilor de eliminare. Este important în recunoașterea ligandului, nu numai la proteina țintă, ci și în interacțiunile cu CYP450, legarea HERG și inducția enzimatică mediată de PXR.
LogP este o componentă a Regulii de 5 a lui Lipinski, o regulă empirică pentru a prezice solubilitatea și permeabilitatea care a devenit un substitut pentru similitudinea cu un medicament.
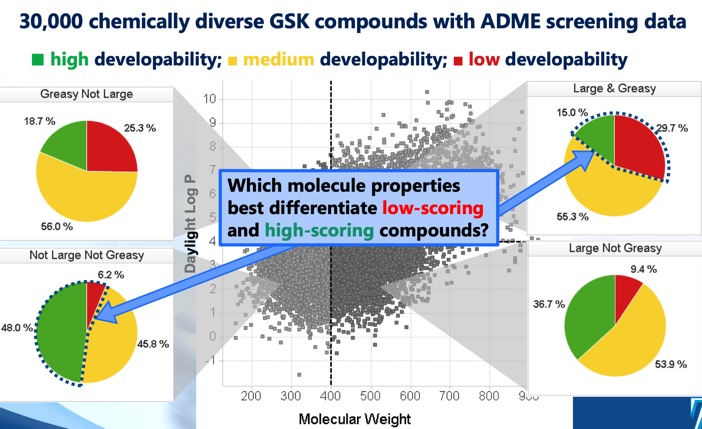
Scorul de dezvoltabilitate DOI identifică patru regiuni distincte cLog P/greutate moleculară care definesc spațiul chimic optim și suboptimal, precum și un scor de dezvoltabilitate derivat din modele de regresie care utilizează date de screening de solubilitate, permeabilitate, legare la proteine și inhibiție 3A4. În timp ce sectorul MWt <400, cLogP <4 sugera cele mai mari șanse de succes, s-a observat că și sectorul MWt >400, cLogP >4 includea unele molecule care pot fi dezvoltate, deși cu o șansă de succes mult mai mică.
Măsura cea mai frecvent utilizată a lipofilicității este LogP, care reprezintă coeficientul de partiție al unei molecule între o fază apoasă și una lipofilă, de obicei octanol și apă.
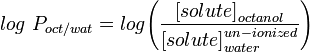
Măsurarea LogP poate fi efectuată în mai multe moduri, cel mai comun fiind metoda agitației în flacon, care constă în dizolvarea unei părți din solutul în cauză într-un volum de octanol și apă, agitarea pentru o perioadă de timp, apoi măsurarea concentrației de solut în fiecare solvent. Această metodă poate consuma mult timp, în special dacă nu există o metodă spectroscopică rapidă pentru a măsura concentrația moleculei în faze. O metodă mai rapidă de determinare a log P utilizează cromatografia lichidă de înaltă performanță. Log P al unui solut poate fi determinat prin corelarea timpului său de retenție cu compuși similari cu valoare log P cunoscută doi.
Calcularea lipofilicității
De obicei, nu este practic să se determine experimental log P al fiecărui compus realizat (și poate fi de interes să se calculeze log P înainte de sinteză) și astfel se folosesc rezultate calculate, existând o serie de instrumente software disponibile atât desktop cât și online (nu se folosesc pentru compuși confidențiali).
Multe dintre aceste aplicații funcționează prin utilizarea unui set mare de date de antrenament cu valori cunoscute pentru a determina contribuțiile fragmentelor pentru sub-structuri și grupuri funcționale, însă logP nu este o proprietate aditivă simplă și sunt necesari termeni de corecție pentru a permite efecte de proximitate, legături H, efecte electronice etc., așa cum se arată în exemplele de mai jos.
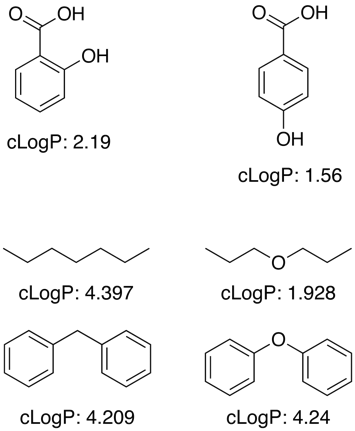
Pentru grupuri funcționale necunoscute, programele fac adesea aproximări folosind contribuțiile atomilor individuali.
Diferitele metodologii de calcul al logP pot fi împărțite în trei abordări diferite.
Atomică (de ex. „AlogP”, ) &Atomic îmbunătățit / Hibrid („XlogP”, „SlogP”)
Fragment („ClogP”, KlogP, ACD/logP)
Metode bazate pe proprietăți („MlogP”, „VlogP”, „MClogP”, „TlogP”)
LogP atomic consideră că fiecare atom are o contribuție la logP și că contribuțiile la valoarea finală sunt pur aditive. Cu toate acestea, este clar că un azot dintr-o amidă este diferit de un azot dintr-o amină sau piridină, Enhanced Atomic ia în considerare tipul de atom.
Metodele cu fragmente utilizează un set mare de date de instruire cu valori cunoscute pentru a determina contribuțiile fragmentelor pentru sub-structuri și grupe funcționale, împreună cu termeni de corecție pentru a lua în considerare efectele de proximitate. Aceste metode recurg adesea la modele atomice pentru grupurile funcționale noi.
Metodele bazate pe proprietăți tind să fie solicitante din punct de vedere computațional și nu sunt cu adevărat adecvate pentru testarea unor seturi de date mari.
Pentru că seturile de instruire și algoritmii variază de la o aplicație la alta, este foarte important să nu se combine rezultatele calculate cu ajutorul unor instrumente diferite.
Câteva dintre instrumente permit utilizatorului să extindă setul de antrenament folosind valori măsurate în cadrul companiei, acest lucru poate fi esențial atunci când se explorează grupuri funcționale sau schelere noi.
LogD
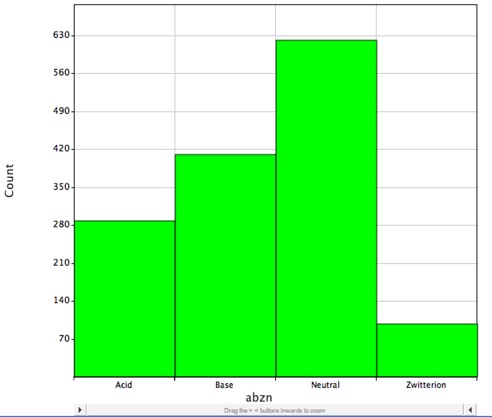
Cu toate acestea, majoritatea medicamentelor cunoscute conțin grupuri ionizabile, așa cum se arată în histograma de mai jos, aceasta arată distribuția medicamentelor cu molecule mici cu DrugBank și este probabil să fie încărcate la pH fiziologic, iar LogP descrie corect doar coeficientul de partiție al moleculelor neutre (neîncărcate).
LogD constanta de distribuție este un descriptor mai bun al lipofilicității unei molecule. Aceasta poate fi determinată într-un mod similar cu LogP, dar în loc să se folosească apă, faza apoasă este ajustată la un anumit pH cu ajutorul unui tampon. Astfel, Log D depinde de pH, de aceea trebuie să se precizeze pH-ul la care a fost măsurat Log D. De un interes deosebit este log D la pH = 7,4 (pH-ul fiziologic al serului sanguin).
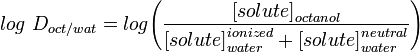
Aplicații precum Marvin permit utilizatorului să calculeze log D, dar și să afișeze profilul de distribuție a pH-ului, așa cum se arată mai jos pentru Warfarină.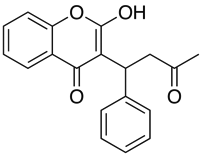
Pentru compușii cu un pKa apropiat de pH-ul fiziologic, poate fi esențial să se ia în considerare care ar putea fi de fapt forma ionizată predominantă.
Acest lucru poate fi, de asemenea, valoros atunci când ne gândim la absorbția din diferite regiuni ale canalului alimentar, unde pH-ul variază de la 1-3 în stomac la 7-8 în ileon.
Contribuțiile diferitelor grupe funcționale la LogD au fost explorate „LogD contributions of substituents commonly used in medicinal chemistry” DOI, acest studiu a folosit analiza perechilor moleculare potrivite a valorilor LogD experimentale de la câteva mii de compuși colectate prin metoda shake-flask la pH = 7,4. Ei au raportat diferența deltaLogD medie pentru anumite perechi moleculare, iar rezultatele sunt prezentate mai jos pentru cazul în care grupul funcțional se află în orice poziție pe inelul fenil. Am inclus, de asemenea, LogD calculat folosind software-ul Chemaxon.
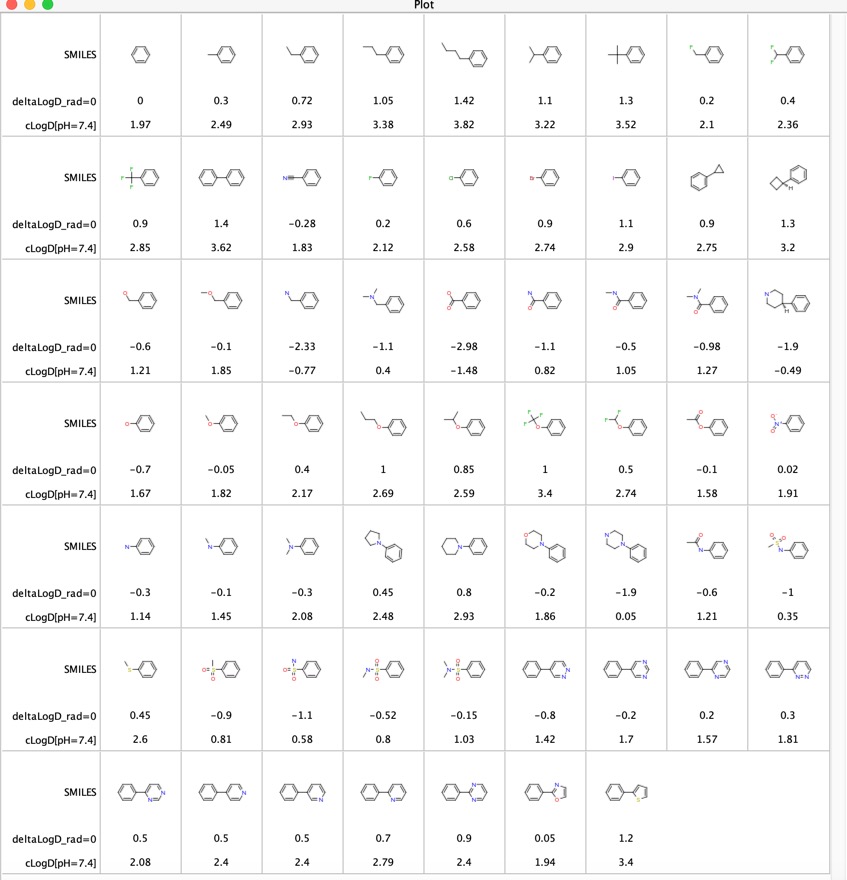
Este un tabel util pentru compararea grupărilor funcționale, în special ultimele 11 intrări compară influența pe care o au diferiți heterocicluri asupra LogD. Acești heterocicluri sunt adesea utilizați ca înlocuitori bioizosterici pentru un inel fenil.
M-am gândit că ar putea fi interesant să comparăm diferențele LogD determinate folosind perechile moleculare potrivite (deltaLogD_rad=0) cu valorile determinate folosind LogD calculat de Chemaxon (deltacLogD). După cum puteți vedea mai jos, există o corespondență destul de bună.
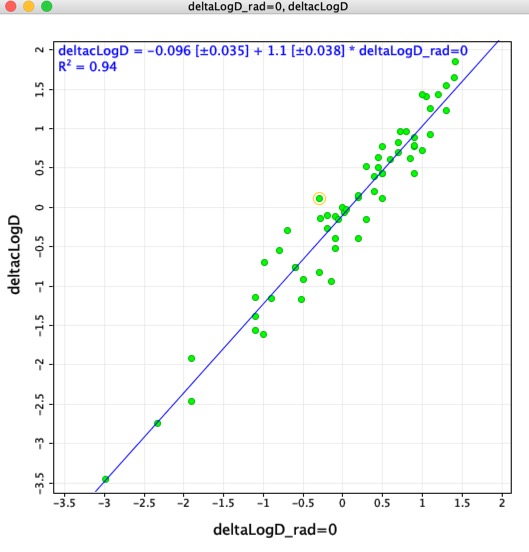
Rețineți Deoarece seturile de antrenament și algoritmii variază de la o aplicație la alta, este foarte important să nu combinați rezultatele calculate cu ajutorul unor instrumente diferite.
Este important să fiți circumspecți că orice îmbunătățire a afinității de legare nu este în întregime determinată de o creștere a LogD, este adesea util să reprezentați pur și simplu afinitatea de legare în funcție de LogD. Cele mai interesante modificări ale compușilor nu sunt neapărat cele care determină cea mai mare creștere a afinității, ci pot fi cele care determină o creștere a afinității fără o creștere corespunzătoare a lipofilicității. Dacă ne uităm la tabelul de mai jos, există o serie de compuși cu afinitate foarte mare.
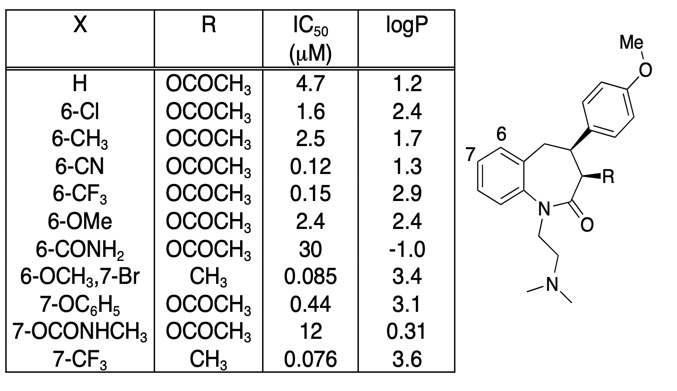
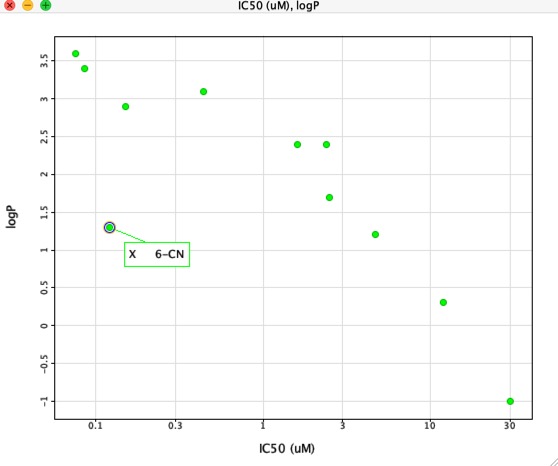
Cu toate acestea, dacă reprezentăm grafic IC50 față de LogP, așa cum se arată mai jos, există o corelație foarte clară între LogP și IC50, însă un compus este clar diferit. Substituentul 6-CN dă o creștere a afinității fără o creștere corespunzătoare a LogP.
Lipofilicitatea este, de asemenea, o componentă importantă, multe dintre responsabilitățile în afara țintei, inclusiv legarea de proteinele plasmatice (în special albumina), HERG, interacțiunile CYP, transporatorii, au corelații puternice cu lipofilicitatea și au existat o serie de studii care leagă un logP ridicat de probabilitatea de eșec al compușilor în dezvoltare ca urmare a caracteristicilor ADMET (absorbție, distribuție, metabolizare, excreție și toxicitate) slabe. În schimb, este clar de multe ori că este nevoie de o anumită dimensiune și lipofilicitate pentru a obține niveluri rezonabile de afinitate. Echilibrarea acestor cerințe reprezintă o provocare cheie în descoperirea medicamentelor și se sugerează ca chimiștii să vizeze punctul ideal MWt 250-500 și LogP 2-4. O consecință a acestei abordări este necesitatea de a prioritiza compușii cu greutate moleculară mică și mai puțin lipofilici din screening. Obiectivul inițial al chimiei medicinale ar trebui să fie acela de a selecta puncte de plecare de bună calitate și apoi de a controla în mod eficient modificările proprietăților fizico-chimice în timpul procesului de optimizare.
Merită citit
Finding the sweet spot: the role of nature and nurture in medicinal chemistry DOI
Lipophilic efficiency: the most important efficiency metric in medicinal chemistry DOI
Ultima actualizare 12 ianuarie 2019
.