Obiective de învățare
- Să descrie caracteristicile unui gaz.
Cele trei faze (sau stări) comune ale materiei sunt gazele, lichidele și solidele. Gazele au cea mai mică densitate dintre cele trei, sunt foarte ușor de comprimat și umplu complet orice recipient în care sunt plasate. Gazele se comportă astfel deoarece forțele lor intermoleculare sunt relativ slabe, astfel încât moleculele lor se mișcă în mod constant independent de celelalte molecule prezente. Solidele, în schimb, sunt relativ dense, rigide și incompresibile, deoarece forțele lor intermoleculare sunt atât de puternice încât moleculele sunt practic blocate pe loc. Lichidele sunt relativ dense și incompresibile, la fel ca și solidele, dar curg ușor pentru a se adapta la forma recipientelor lor, ca și gazele. Prin urmare, putem concluziona că suma forțelor intermoleculare din lichide se situează între cele ale gazelor și cele ale solidelor. Figura 10.1.1 compară cele trei stări ale materiei și ilustrează diferențele la nivel molecular.
Figura 10.1.1 O substanță diatomică (O2) în stare solidă, lichidă și gazoasă
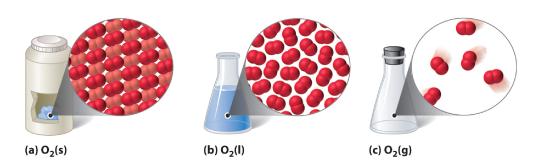
(a) O2 în stare solidă are un volum și o formă fixă, iar moleculele sunt strânse laolaltă. (b) O2 lichid se conformează formei recipientului său, dar are un volum fix; conține molecule relativ dens împachetate. (c) O2 gazos își umple complet recipientul – indiferent de mărimea sau forma recipientului – și este format din molecule foarte separate.
Starea unei anumite substanțe depinde foarte mult de condiții. De exemplu, H2O se găsește în mod obișnuit în toate cele trei stări: gheață solidă, apă lichidă și vapori de apă (forma sa gazoasă). În majoritatea condițiilor, întâlnim apa ca lichid esențial pentru viață; o bem, gătim cu ea și facem baie în ea. Atunci când temperatura este suficient de rece pentru a transforma lichidul în gheață, putem schia sau patina pe ea, o putem împacheta într-un bulgăre de zăpadă sau într-un con de zăpadă și chiar putem construi locuințe cu ea. Vaporii de apăDistincția dintre un gaz și un vapor este subtilă: termenul de vapori se referă la forma gazoasă a unei substanțe care este lichidă sau solidă în condiții normale (25°C, 1,0 atm). Astfel, azotul (N2) și oxigenul (O2) sunt denumite gaze, dar apa gazoasă din atmosferă se numește vapori de apă. este o componentă a aerului pe care îl respirăm și este produsă ori de câte ori încălzim apă pentru a găti alimente sau pentru a face cafea sau ceai. Vaporii de apă la temperaturi mai mari de 100°C se numesc abur. Aburul este utilizat pentru a acționa utilaje mari, inclusiv turbine care generează energie electrică. Proprietățile celor trei stări ale apei sunt rezumate în tabelul 10.1.1
Structura geometrică și proprietățile fizice și chimice ale atomilor, ionilor și moleculelor nu depind, de obicei, de starea lor fizică; moleculele individuale de apă din gheață, apă lichidă și abur, de exemplu, sunt toate identice. În schimb, proprietățile macroscopice ale unei substanțe depind în mare măsură de starea sa fizică, care este determinată de forțele intermoleculare și de condiții precum temperatura și presiunea.
Figura 10.1.2 prezintă locațiile din tabelul periodic ale acelor elemente care se găsesc în mod obișnuit în stare gazoasă, lichidă și solidă. Cu excepția hidrogenului, elementele care apar în mod natural sub formă de gaze se află în partea dreaptă a tabelului periodic. Dintre acestea, toate gazele nobile (grupa 18) sunt gaze monatomice, în timp ce celelalte elemente gazoase sunt molecule diatomice (H2, N2, O2, F2 și Cl2). De asemenea, oxigenul poate forma un al doilea alotrop, molecula triatomică extrem de reactivă, ozonul (O3), care este, de asemenea, un gaz. În schimb, bromul (sub formă de Br2) și mercurul (Hg) sunt lichide în condiții normale (25°C și 1,0 atm, denumite în mod obișnuit „temperatura și presiunea camerei”). Galliul (Ga), care se topește la doar 29,76°C, poate fi transformat în lichid prin simpla ținere în mână a unui recipient cu el sau prin păstrarea lui într-o cameră fără aer condiționat într-o zi călduroasă de vară. Restul elementelor sunt toate solide în condiții normale.
Figura 10.1.2 Elemente care apar în mod natural sub formă de gaze, lichide și solide la 25°C și 1 atm
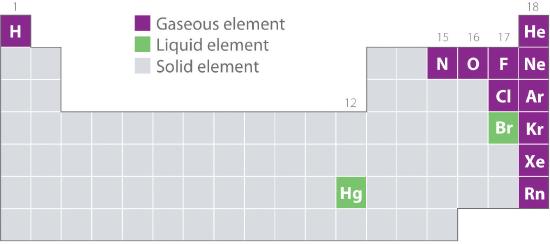
Gazele nobile și mercurul apar ca specii monatomice, în timp ce toate celelalte gaze și bromul sunt molecule diatomice.
Multe dintre elementele și compușii pe care i-am întâlnit până acum se găsesc de obicei sub formă de gaze; unele dintre cele mai comune sunt enumerate în tabelul 10.1.2 . Substanțele gazoase includ multe hidruri binare, cum ar fi halogenurile de hidrogen (HX); hidruri ale calcogenilor; hidruri ale elementelor din grupa 15 N, P și As; hidruri ale elementelor din grupa 14 C, Si și Ge; și diboran (B2H6). În plus, mulți dintre oxizii covalenți simpli ai nemetalelor sunt gaze, cum ar fi CO, CO2, NO, NO2, SO2, SO3 și ClO2. Mulți dintre compușii organici cu masă moleculară redusă sunt, de asemenea, gaze, inclusiv toate hidrocarburile cu patru sau mai puțini atomi de carbon și moleculele simple, cum ar fi eterul dimetilic , clorura de metil (CH3Cl), formaldehida (CH2O) și acetaldehida (CH3CHO). În cele din urmă, agenții frigorifici, cum ar fi clorofluorocarburile (CFC) și hidroclorofluorocarburile (HCFC), sunt gaze care pot fi ușor lichefiate prin comprimare și, la rândul lor, lichidele pot fi transformate în gaze prin scăderea presiunii asupra lichidelor. Schimbarea de fază de la lichid la gaz în tuburile din interiorul frigiderului răcește, în timp ce compresia în serpentinele din partea de jos sau din spate a frigiderului încălzește încăperea. Amoniacul și SO2 sunt alte gaze compresibile care au fost folosite ca agenți frigorifici, dar nu pot fi utilizate în case din cauza naturii lor otrăvitoare. Amoniacul este încă utilizat ca agent frigorific în marile spații comerciale datorită eficienței și costului său scăzut.
Toate substanțele gazoase menționate anterior (altele decât gazele nobile monatomice) conțin legături covalente sau covalente polare și sunt molecule nepolare sau polare. În schimb, atracțiile electrostatice puternice din compușii ionici, cum ar fi NaBr (punct de fierbere = 1390°C) sau LiF (punct de fierbere = 1673°C), le împiedică să existe ca gaze la temperatura și presiunea camerei. În plus, cei mai ușori membri ai oricărei familii de compuși sunt cel mai probabil gaze, iar punctele de fierbere ale compușilor polari sunt, în general, mai mari decât cele ale compușilor nepolari cu masă moleculară similară. Prin urmare, într-o anumită serie de compuși, membrii cei mai ușori și mai puțin polari sunt cei mai susceptibili de a fi gaze. Cu relativ puține excepții, totuși, compușii cu mai mult de aproximativ cinci atomi din perioada 2 sau mai jos sunt prea grei pentru a exista ca gaze în condiții normale.
Rețineți modelul
Substanțele gazoase conțin adesea legături covalente sau covalente polare, există ca molecule nepolare sau ușor polare, au mase moleculare relativ mici și conțin cinci sau mai puțini atomi din perioadele 1 sau 2.
În timp ce gazele au o gamă largă de utilizări, se crede că o utilizare deosebit de sinistră a unei substanțe gazoase a fost folosită de persani asupra orașului roman Dura din estul Siriei în secolul al III-lea d.Hr. Persanii au săpat un tunel pe sub zidul orașului pentru a intra în oraș și a-l cuceri. Dovezile arheologice sugerează că, atunci când romanii au răspuns cu contra-tuneluri pentru a opri asediul, perșii au aprins bitumul și cristalele de sulf pentru a produce un gaz dens și otrăvitor. Este probabil ca burdufurile sau coșurile de fum să fi distribuit gazele toxice. Rămășițele a aproximativ 20 de soldați romani au fost descoperite la baza zidului orașului, la intrarea într-un tunel care avea mai puțin de 2 m înălțime și 11 m lungime. Deoarece este foarte puțin probabil ca perșii să fi măcelărit atât de mulți romani la intrarea într-un spațiu atât de restrâns, arheologii speculează că vechii persani au folosit războiul chimic pentru a cuceri cu succes orașul.
Exemplu 10.1.1
Ce compuși ați prezice că sunt gaze la temperatura și presiunea camerei?
- ciclohexen
- carbonat de litiu
- ciclobutan
- oxid de vanadiu(III)
- acid benzoic (C6H5CO2H)
Dat: compuși
Întrebare: starea fizică
Strategie:
A Decideți dacă fiecare compus este ionic sau covalent. Un compus ionic este cel mai probabil un solid la temperatura și presiunea camerei, în timp ce un compus covalent poate fi un solid, un lichid sau un gaz.
B Dintre compușii covalenți, cei care sunt relativ nepolari și au mase moleculare mici sunt cel mai probabil gaze la temperatura și presiunea camerei.
Soluție:
A Carbonatul de litiu este Li2CO3, care conține ioni Li+ și CO32-, iar oxidul de vanadiu(III) este V2O3, care conține ioni V3+ și O2-. Amândoi sunt compuși în principal ionici care se așteaptă să fie solizi. Restul de trei compuși sunt toți covalenți.
B Acidul benzoic are mai mult de patru atomi de carbon și este polar, deci nu este probabil să fie un gaz. Atât ciclohexena, cât și ciclobutanul sunt în esență molecule nepolare, dar ciclobutanul (C4H8) are o masă moleculară semnificativ mai mică decât ciclohexena (C6H10), care, din nou, are mai mult de patru atomi de carbon. Prin urmare, preconizăm că ciclobutanul este cel mai probabil un gaz la temperatura și presiunea camerei, în timp ce ciclohexena este un lichid. De fapt, cu un punct de fierbere de numai 12°C, în comparație cu 83°C pentru ciclohexen, ciclobutanul este într-adevăr un gaz la temperatura și presiunea camerei.
Exercițiu
Ce compuși ați prezice că sunt gaze la temperatura și presiunea camerei?
- n-butanol
- fluorură de amoniu (NH4F)
- ClF
-
oxid de etilenă
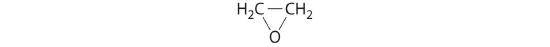
- HClO4
Răspuns: c; d
Rezumat
Materia în vrac poate exista în trei stări: gaz, lichid și solid. Gazele au cea mai mică densitate dintre cele trei, sunt foarte compresibile și își umplu complet recipientele. Elementele care există sub formă de gaze la temperatura și presiunea camerei sunt grupate în partea dreaptă a tabelului periodic; ele apar fie sub formă de gaze monatomice (gazele nobile), fie sub formă de molecule diatomice (unii halogeni, N2, O2). Mulți compuși anorganici și organici cu patru sau mai puțini atomi care nu sunt hidrogen sunt, de asemenea, gaze la temperatura și presiunea camerei. Toate substanțele gazoase se caracterizează prin interacțiuni slabe între moleculele sau atomii constituenți.
Key Takeaway
- Moleculele din substanțele gazoase conțin adesea legături covalente sau covalente polare, sunt molecule nepolare sau ușor polare și au mase moleculare relativ mici.
Probleme conceptuale
-
Explicați diferențele dintre proprietățile microscopice și cele macroscopice ale materiei. Punctul de fierbere al unui compus este o proprietate microscopică sau macroscopică? masa moleculară? De ce?
-
Determinați dacă punctul de topire, momentul de dipol și conductivitatea electrică sunt proprietăți macroscopice sau microscopice ale materiei și explicați raționamentul dumneavoastră.
-
Cum influențează proprietățile microscopice ale materiei proprietățile macroscopice? Puteți corela masa moleculară cu punctul de fierbere? De ce sau de ce nu? Poate fi legată polaritatea de punctul de fierbere?
-
Pentru o substanță care are faze gazoase, lichide și solide, aranjați aceste faze în ordinea creșterii
- densității.
- intensității interacțiunilor intermoleculare.
- compresibilitatea.
- mișcarea moleculară.
- ordinea în dispunerea moleculelor sau atomilor.
-
Explicați ce este greșit în această afirmație: „Starea materiei determină în mare măsură proprietățile moleculare ale unei substanțe.”
-
Descrieți cei mai importanți factori care determină starea unui anumit compus. Ce condiții externe influențează existența unei substanțe în oricare dintre cele trei stări ale materiei?
-
Ce elemente din tabelul periodic există sub formă de gaze la temperatura și presiunea camerei? Dintre acestea, care sunt molecule diatomice și care sunt monatomice? Ce elemente sunt lichide la temperatura și presiunea camerei? Ce porțiune din tabelul periodic conține elemente ale căror hidruri binare sunt cel mai probabil gaze la temperatura camerei?
-
Este corectă următoarea observație? „Aproape toate hidrurile binare nemetalice sunt gaze la temperatura camerei, dar hidrurile metalice sunt toate solide.” Explicați raționamentul dumneavoastră.
-
Este corectă următoarea observație? „Toate hidrurile calcogenilor sunt gaze la temperatura și presiunea camerei, cu excepția hidrurei binare a oxigenului, care este un lichid.” Explicați raționamentul dumneavoastră. V-ați aștepta ca 1-cloropropanul să fie un gaz? iodopropanul? De ce?
-
Explicați de ce compușii ionici nu sunt gaze în condiții normale.
Răspunsuri
-
-
-
-
.
-
-
Proprietățile moleculare ale unei substanțe controlează starea sa de materie într-un anumit set de condiții, și nu invers. Prezența unor forțe intermoleculare puternice favorizează o stare condensată a materiei (lichidă sau solidă), în timp ce interacțiunea intermoleculară foarte slabă favorizează starea gazoasă. În plus, forma moleculelor dictează dacă o fază condensată este lichidă sau solidă.
-
-
Elementele care există sub formă de gaze se găsesc în principal în colțul din dreapta sus și în partea dreaptă a tabelului periodic. Următoarele elemente există ca gaze: H, He, N, O, F, Ne, Ne, Cl, Ar, Kr, Xe și Rn. Astfel, jumătate dintre halogeni, toate gazele nobile, precum și cele mai ușoare calcogeni și picnogeni sunt gaze. Dintre acestea, toate, cu excepția gazelor nobile, există sub formă de molecule diatomice. Doar două elemente există sub formă lichidă la o temperatură normală a camerei de 20°C-25°C: mercurul și bromul. Porțiunea din dreapta sus a tabelului periodic include, de asemenea, majoritatea elementelor ale căror hidruri binare sunt gaze. În plus, hidrurile binare ale elementelor din grupele 14-16 sunt gaze.
-
-
-
-
.