US Pharm. 2018;43(12):HS-2-HS-6.
ABSTRACT: Sângerările gastrointestinale (GIB) sunt o sursă semnificativă de spitalizări în Statele Unite. GIB-urile sunt clasificate în două tipuri: hemoragii digestive superioare și hemoragii digestive inferioare. Fiecare tip se poate prezenta cu diferite semne distinctive și necesită un management diferit. GIB superioară este dependentă de terapia endoscopică și poate beneficia de diverse tratamente farmacologice în scenarii specifice, cum ar fi inhibitorii pompei de protoni și macrolidele. Managementul GIB inferioare se concentrează pe colonoscopie și pe tratarea mecanică a sângerărilor, cu puține intervenții farmacologice. Farmaciștii pot oferi servicii eficiente pentru acești pacienți în mai multe puncte de îngrijire a pacienților.
Sângerarea gastrointestinală (GIB) este o problemă medicală relativ frecventă, cauzând o parte semnificativă a morbidității, spitalizărilor și chiar a mortalității anual în Statele Unite. Rata brută estimată de spitalizare secundară oricărui tip de GIB în SUA este estimată la aproximativ 375 la 100.000 pe an.1-3 Pentru evenimentele acute de GIB, unele studii identifică o rată de mortalitate la 30 de zile de până la 14%, în timp ce altele raportează un interval între 6% și 10% pe an, cu rate care cresc la pacienții cu vârsta înaintată și cu un număr mai mare de comorbidități subiacente asociate.4-7 Se estimează că peste 2,5 miliarde de dolari sunt cheltuite anual pentru îngrijirea managementului pacienților internați pentru GIB.8
Datorită naturii GIB, este important să se diferențieze starea de boală, deoarece localizarea hemoragiei poate dicta atât prezentarea, cât și tratamentul (TABELELELE 1-3). Din punct de vedere istoric, distincția dintre GIB superioară (UGIB)și GIB inferioară (LGIB) s-a bazat pe localizarea hemoragiei în raport cu ligamentul lui Treitz.9,10 Cu această definiție, hemoragia proximală față de ligamentul lui Treitz este clasificată ca fiind o UGIB, în timp ce hemoragia distală față de ligamentul lui Treitz este clasificată ca fiind o LGIB. Deși există și alte definiții în unele literaturi, această definiție este în general stabilită în cea mai mare parte a practicii.11,12



La prezentare, workup-ul oricărui GIB suspectat este inițial similar, indiferent de originea sângerării. Evaluarea imediată trebuie să se concentreze pe stabilitatea hemodinamică a pacientului. Această prioritate a fost bine stabilită în alte modele hemoragice și rămâne valabilă în cazurile de GIB.16-18 Trebuie efectuată o evaluare fizică a tensiunii arteriale, a frecvenței cardiace și a stării ortostatice și trebuie asigurată resuscitarea, după caz. Această resuscitare ar trebui să înceapă cu fluide intravenoase, dar poate necesita, de asemenea, transfuzii de hematii.
Evaluarea suplimentară a pacienților care se prezintă cu GIB ar trebui să includă o anamneză concentrată a pacientului, menită să identifice natura, durata și sursa potențială a hemoragiei, precum și teste de laborator (CBC, BMP, studii de coagulare).17,18 Atunci când se evaluează acești pacienți din perspectiva farmacistului, este important să se noteze orice utilizare curentă sau recentă a medicamentelor care pot crește riscul de sângerare, inclusiv agenți precum antiinflamatoarele nesteroidiene, agenții antiplachetare și/sau anticoagulantele. Identificarea timpurie a acestor factori poate contribui la accelerarea atât a diagnosticului, cât și a răspunsului adecvat la tratament.
Evaluarea și stratificarea riscului este utilă din punct de vedere clinic pentru a ajuta la distingerea pacienților cu risc ridicat și scăzut de rezultate adverse.17,18 Prin stratificarea pacienților în grupuri de risc evaluate, se poate lua o decizie inițială în cunoștință de cauză. În mod specific, stratificarea poate oferi o perspectivă asupra unor factori precum momentul efectuării endoscopiei sau colonoscopiei, nivelul necesar de îngrijire și momentul externării. Diferite instrumente stabilite sunt disponibile pentru a ajuta la evaluarea riscului individual.
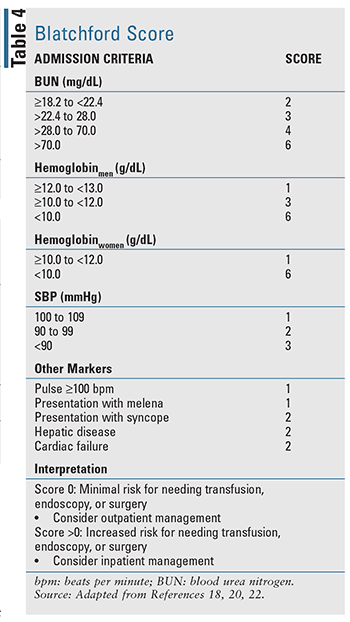
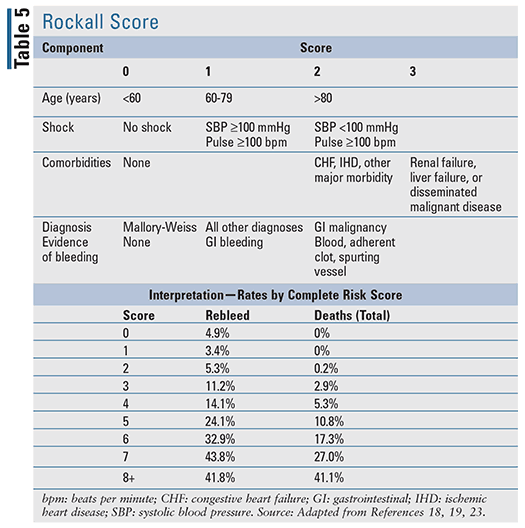
Pentru pacienții cu UGIB acută, există mai multe instrumente de predicție clinică care au fost dezvoltate, inclusiv două instrumente bine evaluate, citate în ghidurile bazate pe dovezi: scorul Blatchford (TABELUL 4) și scorul Rockall (TABELUL 5).17-20 Scorul Rockall utilizează date clinice imediat la prezentare.19 Factorii care evaluează gravitatea hemoragiei, cum ar fi tensiunea arterială sistolică și frecvența cardiacă, sunt evaluați alături de caracteristicile pacientului, cum ar fi vârsta și afecțiunile comorbide, rezultând un instrument de evaluare a rezultatelor prognostice și, eventual, a mortalității. În mod similar, scorul Blatchford utilizează atât date clinice, cât și de laborator pentru a ajuta la predicția riscului de intervenție și a mortalității.20 Pentru LGIB acută, regulile prognostice disponibile pentru evaluarea riscului sunt limitate și mai puțin validate în comparație cu UGIB.22
Farmacoterapia hemoragiei digestive superioare
Inhibitorii pompei de protoni (IPP) sunt clasa de medicamente cea mai asociată cu tratamentul UGIB. La un pacient cu UGIB, acidul gastric poate inhiba agregarea plachetară și slăbi coagularea potențială, ceea ce duce la o afectare a opririi sângerării. Pentru a inhiba acest proces, inhibarea secreției de acid gastric menită să ridice pH-ul stomacal la 6 sau mai mare poate ajuta la stabilizarea cheagurilor și la îmbunătățirea rezultatelor clinice.24
PPI sunt unici prin faptul că au o aplicație potențială atât pre cât și postendoscopie. În cadrul preendoscopiei, ghidurile nu formează un consens cu privire la utilizarea lor, dar acestea pot scădea proporția pacienților cu risc ridicat de stigmate de hemoragie în momentul procedurii.25 În ciuda potențialului beneficiu în această populație, dovezile sugerează că utilizarea IPP nu afectează re-sângerarea, intervenția chirurgicală necesară sau mortalitatea, ceea ce duce la o anumită controversă clinică în ceea ce privește aplicarea lor. Cu toate acestea, pacienții pentru care endoscopia nu poate fi efectuată sau va fi întârziată au demonstrat o scădere potențială a riscului de resângerare prin utilizarea IPP. Dovezile sugerează că IPP scad incidența stigmatelor cu risc ridicat de hemoragie în momentul endoscopiei, dar nu influențează resângerarea, intervenția chirurgicală necesară sau mortalitatea.17,26 După terapia postendoscopică, IPP pot fi utilizate atât în mod acut, cât și cronic.17
Infuzie continuă versus IPP intermitent
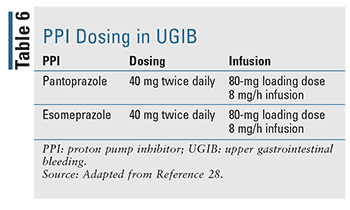
Dosarea și administrarea adecvată a IPP au fost evaluate îndeaproape în ultimii ani (TABELUL 6). O doză de bolus IV urmată de perfuzie a fost mult timp cursul normal al terapiei și rămâne tratamentul de elecție în ghidurile disponibile în prezent, dar datele sugerează că o doză de bolus IV de două ori pe zi este noninferioară în ceea ce privește rezultatele de re-sângerare, mortalitate și durata șederii în spital.17,27 Literatura recentă a demonstrat că utilizarea intermitentă a IPP a fost noninferioară și oferă un beneficiu clar în ceea ce privește doza de medicament, costul și utilizarea resurselor. Autorii sugerează ca ghidurile să fie actualizate pentru a recomanda tratamentul intermitent cu IPP în GIB tratate endoscopic.27 În practică, multe instituții favorizează acum dozarea intermitentă pentru a diminua utilizarea resurselor și costul global.
IPP intravenos versus antagoniști H2 intravenos
Considerând că antagoniștii H2 (H2A) sunt utilizați cu intenții similare în alte stări de boală, utilizarea lor în UGIB a fost investigată alături de IPP. O metaanaliză din 2015 care a evaluat cele două clase în contextul UGIB a constatat că, în timp ce diferența în ceea ce privește mortalitatea s-a dovedit a fi nesemnificativă, rezultate precum rata de sângerare recurentă și rata de primire a intervenției chirurgicale au prezentat un beneficiu clar în cazul IPP. Acest deficit se datorează probabil inferiorității H2A în menținerea pH-ului gastric peste 6,0, pH-ul aproximativ în care pot funcționa procesele de coagulare.29
Macrolide
În efortul de a îmbunătăți vizualizarea în timpul endoscopiei și, astfel, de a diminua nevoia de repetare a endoscopiei, se utilizează în mod obișnuit eritromicina intravenoasă, o macrolidă antimicrobiană care acționează, de asemenea, ca agent prokinetic. O doză unică de 250 mg sau 3 mg/kg este, în general, bine tolerată.17,30 O metaanaliză din 2016 a concluzionat că utilizarea eritromicinei înainte de endoscopie a scăzut semnificativ necesitatea unei a doua examinări endoscopice și durata șederii în spital și, prin urmare, poartă o recomandare de a fi utilizată în ghidurile Societății Europene de Endoscopie Gastrointestinală.30,31
Este corect să ne întrebăm dacă eventualul beneficiu este un efect de clasă sau specific eritromicinei. Azitromicina, o macrolidă în general mai frecvent utilizată, a fost evaluată și pare a fi o alternativă noninferioară la eritromicină. Azitromicina poate prezenta unele avantaje logistice, cum ar fi faptul că nu necesită reconstituire și, în general, o disponibilitate mai mare datorită utilizării sale în tratamentul empiric al pneumoniei.32
Tratament H pylori
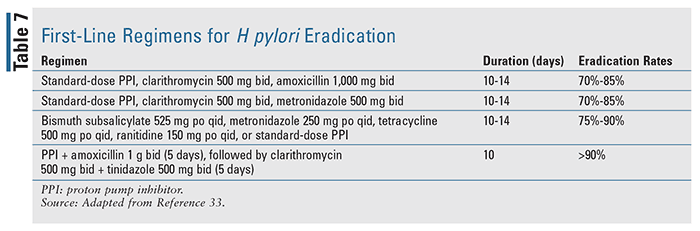
Pacienții diagnosticați cu hemoragii asociate cu infecția cu Helicobacter pylori trebuie tratați prin intermediul unei terapii de eradicare bazate pe ghiduri, cu scopul de a rezolva complet infecția.17 Literatura de specialitate disponibilă indică faptul că eradicarea H pylori este semnificativ mai eficientă decât tratamentul antisecretor singur la pacienții cu UGIB. Regimurile de primă linie pentru eradicarea H pylori sunt detaliate în TABELUL 7, pe baza ghidurilor Colegiului American de Gastroenterologie privind managementul infecției cu H pylori.33 Odată ce infecția este rezolvată, acest grup de pacienți nu are nevoie, de obicei, să primească tratament antisecretor de întreținere, cu excepția cazului în care au nevoie de medicamente antiinflamatoare nesteroidiene sau de tratament antitrombotic, cu care este necesar un tratament antisecretor pe termen lung, deoarece utilizarea acestora poate crește semnificativ riscul de sângerare din nou.17,18
Prezentare generală a tratamentului
După evaluarea inițială și stratificarea riscului și odată ce pacientul este stabil hemodinamic, colonoscopia precedată de curățarea colonului este procedura inițială de diagnosticare pentru majoritatea pacienților care se prezintă cu o LGIB.21 Managementul LGIB include în cea mai mare parte intervenții nefarmacologice; cu toate acestea, există încă oportunități pentru farmaciști de a se implica în îngrijirea pacienților.
Aplicarea IPPPI în LGIB
În comparație cu UGIB, literatura de specialitate disponibilă care evaluează utilizarea IPPPI în LGIB nu arată beneficii. Studiile care au evaluat UGIB și LGIB au demonstrat că, în timp ce IPP nu demonstrează rezultate îmbunătățite în LGIB, acestea pot crește de fapt riscul de LGIB.34 Mecanismele teoretizate pentru acest risc crescut se concentrează adesea pe posibilele modificări ale microbiotei și, prin urmare, pot potența riscul posibil al AINS. Aceste rezultate s-au dovedit controversate; cu toate acestea, ele oferă dovezi că pacienții cu LGIB nu beneficiază de terapia cu IPP. Acest risc potențial trebuie evaluat cu atenție la pacienți, în special la cei cu risc de UGIB, deoarece poate fi necesară o evaluare atentă a raportului risc/beneficiu.34
Rolul farmacistului
Farmaciștii din multe specialități se află într-o poziție unică pentru a ajuta la tratamentul și managementul pacienților cu GIB. Farmaciștii din ambulatoriu se află într-o poziție privilegiată pentru a urmări în mod proactiv potențialii factori de risc la pacienți, inclusiv AINS în doze mari și anticoagulante, și pentru a reduce șansele de GIB în prima linie. În plus, aceștia pot oferi consiliere importantă și optimizarea dozelor pentru pacienți, atât înainte, cât și după un diagnostic de GIB. În mod similar, farmaciștii clinicieni internați pot avea, de asemenea, un rol important în tratamentul GIB. Aceștia pot fi în măsură să ofere asistență în mai multe domenii în timpul evaluării și gestionării inițiale. Reconcilierea inițială a medicației poate dezvălui detalii relevante pentru diagnosticul și tratamentul pacienților, cum ar fi identificarea utilizării AINS sau anticoagulantelor în ambulatoriu. Farmaciștii pot oferi, de asemenea, recomandări echipei de asistență medicală cu privire la medicamentele care pot aduce beneficii pentru fiecare caz de GIB.
1. El-Tawil A. Tendințe privind sângerarea gastrointestinală și mortalitatea: unde ne situăm? World J Gastroenterol. 2012;18(11):1154-1158.
2. Zhao Y, Encinosa W. Spitalizări pentru hemoragii gastrointestinale în 1998 și 2006. Statistical Brief #65. Healthcare Cost and Utilization Project (HCUP) Statistical Briefs. Decembrie 2008.
3. Whelan CT, Chen C, Kaboli P, et al. Upper versus lower gastrointestinal bleeding: a direct comparison of clinical presentation, outcomes, and resource utilization. J Hosp Med. 2010;5(3):141-147.
4. Wilcox CM, Cryer BL, Henk HJ, et al. Mortalitatea asociată evenimentelor de sângerare gastrointestinală: compararea rezultatelor clinice pe termen scurt ale pacienților spitalizați pentru sângerare gastrointestinală superioară și infarct miocardic acut într-un cadru de îngrijire gestionată din SUA. Clin Exp Gastroenterol. 2009;2:21-30.
5. Garcia Rodriguez LA, Ruigómez A, Hasselgren G, et al. Compararea mortalității cauzate de sângerarea ulcerului peptic între pacienții cu sau fără antecedente de ulcer peptic. Epidemiologie. 1998;9(4):452-456.
6. Wilcox CM, Clark WS. Cauze și rezultate ale hemoragiilor gastrointestinale superioare și inferioare: experiența spitalului Grady. South Med J. 1999;92:44-50.
7. Yavorski RT, Wong RK, Maydonovitch C, et al. Analiza a 3.294 de cazuri de hemoragii gastrointestinale superioare în unitățile medicale militare. Am J Gastroenterol. 1995;90:568-573.
8. Johanson JF. Reducerea costurilor hemoragiilor gastrointestinale. Am J Gastroenterol. 1998;93:1384-1385.
9. Scottish Intercollegiate Guidelines Network (SIGN). Managementul hemoragiilor gastrointestinale acute superioare și inferioare. Septembrie 2008. www.sign.ac.uk/assets/sign105.pdf.
10. Kim, SK, Cho CD, Cho CD, Wojtowycz AR. Ligamentul lui Treitz (ligamentul suspensor al duodenului): corelație anatomică și radiografică. Abdom Imaging. 2008;33:395-397.
11. Matthew B, et al. Diagnosticul hemoragiilor gastrointestinale: un ghid practic pentru clinicieni. World J Gastrointest Pathophysiol. 2014;5(4):467-478.
12. Raju GS, et al. Declarația de poziție medicală a Institutului Asociației Americane de Gastroenterologie (AGA) privind sângerările gastrointestinale obscure. Gastroenterologie. 2007;133(5):1694-1696.
13. Tielleman T, Bujanda D, Cryer B, et al. Epidemiologia și factorii de risc pentru sângerarea gastrointestinală superioară. Gastrointest Endosc Clin N Am. 2015;25(3):415-428.
14. Rodriguez-Hernandez H, Rodríguez-Morán M, González JL, et al. Factori de risc asociați cu hemoragia gastrointestinală superioară și cu mortalitatea. Rev Med Inst Mex Seguro Soc. 2009;47(2):179-184.
15. Strate L. Sângerarea digestivă inferioară: epidemiologie și diagnostic. Gastroenterol Clin North Am. 2005;34(4):643-664.
16. Cocchi MN, Kimlin E, Walsh M, et al. Identificarea și resuscitarea pacientului traumatizat în șoc. Emerg Med Clin N Am. 2007;25:623-642.
17. Laine L, Jensen DM. Managementul pacienților cu hemoragie ulceroasă. Am J Gastroenterol. 2012;107:345-360.
18. Siau K, Chapman W, Sharma N, et alManagementul hemoragiei gastrointestinale superioare acute: o actualizare pentru medicul generalist. J R Coll Physicians Edinb. 2017;47:218-230.
19. Rockall T, Logan R, Devlin H, et al. Evaluarea riscului după hemoragia digestivă superioară acută. Gut. 1996;38:316-321.
20. Blatchford O, Murray W, Blatchford M. A risk score to predict need for treatment for uppergastrointestinal haemoragie. Lancet. 2000;356:1318-1321.
21. Recio-Ramirez, JM, Sánchez-Sánchez Mdel P, Peña-Ojeda JA, et al. Capacitatea predictivă a scorului Glasgow-Blatchford pentru stratificarea riscului de hemoragie gastrointestinală superioară într-un departament de urgență. Revista Española de Enfermedades Digestivas. 2015;107(5):262-267.
22. Strate L, Grainek IM. Ghidul clinic ACG: Managementul pacienților cu hemoragie digestivă inferioară acută. Am J Gastroenterol. Publicare online în avans la 1 martie 2016. 2016;111:459-474.
23. Bessa X, O’Callaghan E, Balleste B, et al. Aplicabilitatea scorului Rockall la pacienții supuși terapiei endoscopice pentru hemoragia gastrointestinală superioară. Dig Liver Dis. 2006;38:12-17.
24. Chaimoff C, Creter D, Djaldetti M. Efectul pH-ului asupra activităților plachetare și a factorilor de coagulare. Am J Surg. 1978;136(2):257-259.
25. Sreedharan A, Martin J, Leontiadis GI, et al. Tratamentul cu inhibitor de pompă de protoni inițiat înainte de diagnosticul endoscopic în hemoragia gastrointestinală superioară. Cochrane Database Syst Rev. 2010(7):CD005415.
26. Leontiadis GI , Sharma VK , Howden CW. Terapia cu inhibitori de pompă de protoni pentru sângerarea ulcerului peptic: Meta-analiza colaborării Cochrane a studiilor controlate randomizate. Mayo Clin Proc. 2007;82:286-296.
27. Sachar H, Vaidya K, Laine L, et al. Terapia cu inhibitori de pompă de protoni intermitentă vs. continuă pentru ulcerele hemoragice cu risc ridicat: o revizuire sistematică și o meta-analiză. JAMA Intern Med. 2014;174(11):1755-1762.
28. Cheng H, Sheu B. Inhibitori intravenoși ai pompei de protoni pentru ulcerul hemoragic peptic: beneficii și limite clinice. World J Gastrointest Endosc. 2011;3(3):49-56.
29. Zhang YS, Li Q, Li Q, He BS, et al. Terapia cu inhibitori de pompă de protoni vs terapia cu antagoniști ai receptorilor H2 pentru sângerarea gastrointestinală superioară după endoscopie: o meta-analiză. World J Gastroenterol. 2015;21(20):6341-6351.
30. Rahman R, Nguyen D, Sohail U, et al. Administrarea pre-endoscopică a eritromicinei în sângerarea gastrointestinală superioară: o meta-analiză actualizată și o revizuire sistematică. Ann Gastroenterol. 2016,29:312-317.
31. Gralnek IM, Dumonceau JM, Kuipers EJ, et al. Diagnosticul și managementul hemoragiei gastrointestinale superioare nonvariceale: Ghidul Societății Europene de Endoscopie Gastrointestinală (ESGE). Endoscopie. 2015;47:1-46.
32. Issa D, Solomon S, Di Pace B, et al. A Comparation of Azithromycin to Erythromycin Infusions in Improving Visualization of Endoscopy for Upper Gastrointestinal Bleeding. Congres mondial la ACG2017. Sesiunea 2A.
33. Chey WD, Wong BC. Comitetul pentru parametrii de practică al Colegiului American de Gastroenterologie. Ghidul Colegiului American de Gastroenterologie privind managementul infecției cu Helicobacter pylori. Am J Gastroenterol. 2007; 102:1808-1825.
34. Luée A, Lanas A. Tratamentul cu inhibitori ai pompei de protoni și sângerările gastrointestinale inferioare: echilibrarea riscurilor și beneficiilor. World J Gastroenterol. 2016;22(48):10477-10481.