Instabilitatea structurală a enzimelor
Faptul că situsurile active sunt atât de bine adaptate pentru a asigura condiții de mediu specifice înseamnă, de asemenea, că ele sunt supuse influențelor mediului local. Este adevărat că mărirea temperaturii mediului crește, în general, ratele de reacție, catalizate sau nu de enzime. Cu toate acestea, creșterea sau scăderea temperaturii în afara unui interval optim poate afecta legăturile chimice din cadrul situsului activ în așa fel încât acestea să fie mai puțin potrivite pentru a lega substraturile. Temperaturile ridicate vor duce în cele din urmă la denaturarea enzimelor, ca și a altor molecule biologice, un proces care modifică proprietățile naturale ale unei substanțe. De asemenea, pH-ul mediului local poate afecta, de asemenea, funcția enzimelor. Reziduurile de aminoacizi din situsul activ au propriile lor proprietăți acide sau bazice care sunt optime pentru cataliză. Aceste reziduuri sunt sensibile la schimbările de pH care pot afecta modul în care se leagă moleculele de substrat. Enzimele sunt potrivite pentru a funcționa cel mai bine într-un anumit interval de pH și, la fel ca și în cazul temperaturii, valorile extreme ale pH-ului (acid sau bazic) din mediul înconjurător pot determina denaturarea enzimelor.
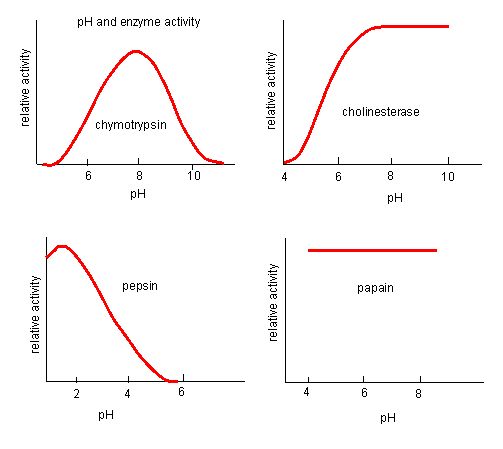
Figura 4. Enzimele au un pH optim. pH-ul la care enzima este cea mai activă va fi pH-ul la care grupele R ale situsului activ sunt protonate/deprotonate astfel încât substratul să poată intra în situsul activ și să poată începe etapa inițială a reacției. Unele enzime au nevoie de un pH foarte scăzut (acid) pentru a fi complet active. În corpul uman, aceste enzime sunt cel mai probabil localizate în partea inferioară a stomacului sau localizate în lizozomi (un organit celular folosit pentru a digera compușii de mari dimensiuni din interiorul celulei).
Sursa: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
Procesul prin care enzimele se denaturează începe, de obicei, cu derularea structurii terțiare prin destabilizarea legăturilor care țin împreună structura terțiară. Legăturile de hidrogen, legăturile ionice și legăturile covalente (punțile disulfidice și legăturile peptidice) pot fi toate întrerupte de modificări mari ale temperaturii și pH-ului. Folosind graficul activității enzimatice și temperatura de mai jos, realizați o poveste energetică pentru enzima roșie. Explicați ce s-ar putea întâmpla de la 37 °C la 95 °C.
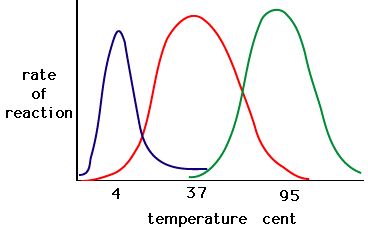
Figura 5. Enzimele au o temperatură optimă. Temperatura la care enzima este cea mai activă va fi, de obicei, temperatura la care structura enzimei este stabilă sau necompromisă. Unele enzime necesită o temperatură specifică pentru a rămâne active și a nu se denatura. Sursa: http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Încadrarea indusă și funcția enzimatică
Pentru mulți ani, oamenii de știință au crezut că legarea enzimei de substrat are loc într-o manieră simplă de „blocare și închidere”. Acest model susținea că enzima și substratul se potrivesc perfect într-un singur pas instantaneu. Cu toate acestea, cercetările actuale susțin o viziune mai rafinată, numită potrivire indusă. Modelul de potrivire indusă extinde modelul de tip „lock-and-key” prin descrierea unei interacțiuni mai dinamice între enzimă și substrat. Pe măsură ce enzima și substratul se întâlnesc, interacțiunea lor provoacă o ușoară schimbare în structura enzimei care confirmă un aranjament de legare mai productiv între enzimă și starea de tranziție a substratului. Această legare favorabilă din punct de vedere energetic maximizează capacitatea enzimei de a-și cataliza reacția.
Când o enzimă se leagă de substratul său, se formează un complex enzimă-substrat. Acest complex scade energia de activare a reacției și favorizează progresia rapidă a acesteia într-unul din mai multe moduri. La un nivel de bază, enzimele promovează reacțiile chimice care implică mai mult de un substrat prin aducerea împreună a substraturilor într-o orientare optimă. Regiunea corespunzătoare (atomi și legături) a unei molecule este juxtapusă la regiunea corespunzătoare a celeilalte molecule cu care trebuie să reacționeze. Un alt mod în care enzimele promovează reacția substraturilor lor este prin crearea unui mediu energetic favorabil în cadrul situsului activ pentru ca reacția să aibă loc. Anumite reacții chimice se pot desfășura mai bine într-un mediu ușor acid sau nepolar. Proprietățile chimice care rezultă din aranjamentul special al reziduurilor de aminoacizi din cadrul unui situs activ creează mediul energetic favorabil pentru ca substraturile specifice ale unei enzime să reacționeze.
Energia de activare necesară pentru multe reacții include energia implicată în contorsionarea ușoară a legăturilor chimice astfel încât acestea să poată reacționa mai ușor. Acțiunea enzimatică poate ajuta acest proces. Complexul enzimă-substrat poate scădea energia de activare prin contorsionarea moleculelor de substrat în așa fel încât să faciliteze ruperea legăturii. În cele din urmă, enzimele pot, de asemenea, să reducă energiile de activare prin participarea la reacția chimică în sine. Reziduurile de aminoacizi pot furniza anumiți ioni sau grupe chimice care formează de fapt legături covalente cu moleculele de substrat ca o etapă necesară a procesului de reacție. În aceste cazuri, este important să ne amintim că enzima va reveni întotdeauna la starea sa inițială la finalizarea reacției. Una dintre proprietățile caracteristice ale enzimelor este că acestea rămân în cele din urmă neschimbate de reacțiile pe care le catalizează. După ce o enzimă a terminat de catalizat o reacție, ea eliberează produsul (produsele) său (sale).
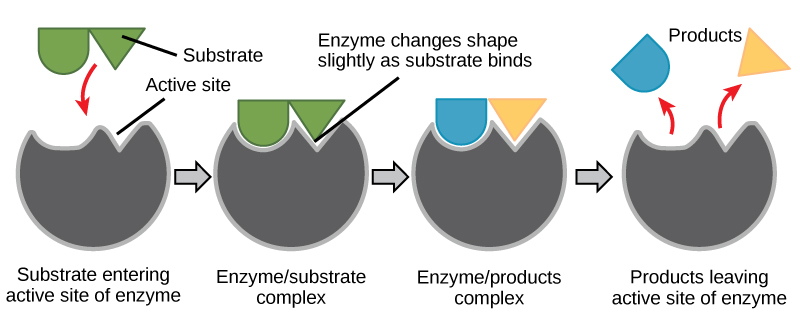
Figura 6. Conform modelului de ajustare indusă, atât enzima, cât și substratul suferă modificări conformaționale dinamice la legare. Enzima conturează substratul în starea sa de tranziție, crescând astfel viteza reacției.
Crearea unei povestiri energetice pentru reacția de mai sus
Utilizând figura 6, răspundeți la întrebările puse în povestirea energetică.
1. Care sunt reactanții? Care sunt produșii?
2. Ce lucru a fost realizat de enzimă?
3. În ce stare se află inițial energia? În ce stare este transformată energia în starea finală? Aceasta ar putea fi încă dificilă, dar încercați să identificați unde se află energia în starea inițială și în starea finală.
.