După ce am stabilit existența nucleului, acum putem analiza dovezile experimentale ale mărimii acestuia, pornind de la experimentul Rutherford.
Rezumat al lecției
- Discuție și exemplu de lucru: Mărimea nucleului (15 minute)
- Discuție: Dimensiunea atomului și a nucleului (10 minute)
- Întrebări ale elevilor: Forțele și cea mai apropiată apropiere (30 minute)
- Discuție: Numărul atomic și sarcina pe un nucleu (5 minute)
- Discuție: Limita superioară a dimensiunii nucleare (30 minute)
- Discuție: O enigmă pentru o lecție viitoare (5 minute)
Discuție și exemplu lucrat: Mărimea nucleului
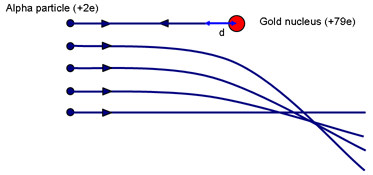
Vă puteți face o idee despre mărimea posibilă a nucleului gândindu-vă la experimentul lui Rutherford. Întrebați: Ce parametru de impact va avea ca rezultat faptul că o particulă se va apropia cel mai mult de nucleu? (O coliziune frontală cu p = 0.)
Principiul conservării energiei este folosit pentru a calcula distanța de cea mai apropiată apropiere ca măsură pentru dimensiunea unui nucleu. Înțelegerea calculului care urmează depinde de faptul dacă elevii au abordat potențialul electric și câmpurile electrice. În mod alternativ, servește ca o bună recapitulare.
Episodul 522-1: Împrăștierea particulelor alfa – distanța celei mai apropiate apropieri (Word, 29 KB)
Episodul 522-2: Distanța celei mai apropiate apropieri (Word, 107 KB)
Când α este adus momentan în repaus (după ce a urcat cât de mult a putut pe dealul electrostatic) se va fi depus muncă împotriva forței de respingere din partea nucleului. Energia cinetică a lui α este stocată în câmpul din jurul nucleului. Când viteza este zero, toată energia este acum stocată în câmp.
Dacă α se oprește momentan când se află la o distanță d de (centrul) nucleului de sarcină Ze, energia din câmp este:
Eα = 14πε0 2e Zed
Acest lucru este egal cu energia cinetică inițială a particulei α. Rutherford a folosit o sursă α care i-a fost dată de Madame Curie. Energia α a fost de ~ 7,7 MeV.
Pentru aur, Z = 79. Rezolvând se obține d ~ 3 × 10-14 m. Comparați această valoare cu diametrul atomilor de aur ~ 3 × 10-10 m. Deci un nucleu este de cel puțin 10 000 de ori mai mic decât un atom. Este important de subliniat că acest calcul oferă o limită superioară a dimensiunii nucleului de aur; nu putem spune că particula alfa atinge nucleul; un α mai energetic ar putea să se apropie și mai mult.
Un atom este în cea mai mare parte gol (motiv pentru care majoritatea as a trecut direct prin el – orice electroni ar împiedica cu greu viteza relativ masivă și mare a lui α).
Discuție: Dimensiunea atomului și a nucleului
Solicitați elevilor dumneavoastră să propună un model la scară a atomului nuclear. De exemplu: dacă un nucleu ar avea un diametru de 1 mm, un atom ar fi de 10 000 de ori mai mare sau 10 m în diametru. Alegeți o poziție potrivită pentru un nucleu de 1 mm (un rulment cu bile mic sau o bilă de Blu-tac). Parcurgeți 5 m (cinci pași mari) până la marginea atomului, unde se află electronii. NB: diagramele din manualele școlare ale unui atom cu un nucleu nu sunt desenate la scară.
Reforțați o imagine precisă punând un elev să se ridice în picioare ca un nucleu, estimați-i circumferința (40 cm?) și întrebați unde ar trebui să se ridice un alt elev pentru a fi la marginea atomului. 104 × 40 cm = 4000 m}, deci raza acestui atom este de 2 km! Verificați cu o hartă locală pentru a găsi o locație cu nume pe care elevii o vor recunoaște și care se află la 2 km distanță.
Întăritor suplimentar: într-un solid în care atomii sunt foarte apropiați, distanța dintre nucleele adiacente ~ dimensiunea unui atom, adică echivalentul a doi elevi care stau la o distanță de 4 km unul de celălalt! Ambele au o dimensiune similară. Aria secțiunii transversale prezentată de un nucleu ~radiul2, deci ~1 × 10-28 m2}.
Întrebați: Cum vă așteptați ca numărul de reflexii să depindă de grosimea foliei metalice care conține nucleele țintă? (Imaginați-vă atomii de aur în straturi, șansa unei devieri crește odată cu grosimea, dar absorbția la intrarea sau la ieșirea din folia din ce în ce mai groasă va împiedica, în cele din urmă, orice creștere suplimentară a numărului de atomi reflectați și detectați.
Este de mare ajutor dacă elevii dvs. își pot aminti următoarele ordine de mărime:
Radiul nucleului atomic ~ 10 -14m
Radiul atomului ~ 10 -10m
Întrebări ale elevilor: Forțele și apropierea cea mai apropiată
Episodul 522-3: Împrăștierea Rutherford: Direcțiile forțelor (Word, 82 KB)
Episodul 522-4: Împrăștierea Rutherford: Energia și cea mai apropiată apropiere (Word, 83 KB)
Discuție: Numărul atomic și sarcina unui nucleu
Rutherford și-a folosit datele pentru a afla sarcina nucleului țintă de aur. Alte experimente pentru a afla sarcina foliilor de Cu, Ag și Pt au dat:
| Numărul atomic | Un experiment de împrăștiere | |
| Cu | 29 | 29.3 × e |
| Ag | 47 | 46.3 × e |
| PT | 78 | 77,4 × e |
Așadar, sarcina electrică pe un nucleu este dată de numărul atomic × e, adică Z e. Cu o singură excepție (hidrogenul, H-1), Z este întotdeauna mai mic decât numărul de masă atomică. Așadar, ce explică această diferență? Atomul trebuie să fie neutru din punct de vedere electric. Rutherford a propus neutronul.
Discuție: Limita superioară a mărimii nucleului
Reamintim că analiza lui Rutherford oferă o limită superioară a mărimii pe nucleu (d ~ 1 α energia particulei). Dimensiunea pe care o măsurați depinde de energia particulei α pe care o folosiți. Așadar, avem nevoie de o altă abordare pentru a afla dimensiunea unui nucleu de aur. Vă puteți gândi la o particulă mai bună pentru a sonda dimensiunea unui nucleu? (Neutronul – fiind neîncărcat, se va apropia mai mult.)
O altă tehnică este împrăștierea inelastică profundă a electronilor. Consultați înapoi dacă ați abordat deja natura ondulatorie a particulelor (undele de Broglie λ = hp), sau acest subiect poate fi introdus aici, dacă doriți. Aparatul de difracție a electronilor are o asemănare de bază cu o împrăștiere de particule. Electronii sunt lansați asupra unei pelicule subțiri – în acest caz de grafit.
Rutherford a fost norocos că lungimea de undă de Broglie a particulelor α (necunoscută de el) era destul de mică, iar repulsia coulombiană se oprește ca apropiindu-se prea mult – altfel efectele de difracție ar fi încurcat datele! (Încercați calculul dacă ați acoperit deja λ = hp.)
Episodul 506-2: Interpretarea modelelor de difracție a electronilor (Word, 30 KB)
Episodul 522-5: Dispersia inelastică profundă (Word, 56 KB)
Episodul 522-6: Electronii măsoară dimensiunea nucleelor (Word, 42 KB)
Discuție: O enigmă pentru o lecție viitoare
Există o problemă fundamentală cu modelul lui Rutherford. Întrebați clasa dumneavoastră: Cum poate un atom cu un nucleu central să fie stabil – de ce nu se prăbușește? Conform electrodinamicii clasice, electronii ar trebui să emită radiații pe măsură ce orbitează și să se rotească în spirală spre interior.
(Este bine să lași o clasă cu o enigmă pentru o lecție viitoare.)
Descărcați acest episod
.