Ley de Decaimiento Radiactivo
Cuando un núcleo individual se transforma en otro con la emisión de radiación, se dice que el núcleo decae. La desintegración radiactiva ocurre para todos los núcleos con \(Z > 82\), y también para algunos isótopos inestables con \(Z < 83\). La tasa de desintegración es proporcional al número de núcleos originales (no desintegrados) N en una sustancia. El número de núcleos que se pierden por desintegración, \(-dN\) en el intervalo de tiempo dt, se escribe
\
donde \(\lambda\) se llama la constante de desintegración. (El signo menos indica que el número de núcleos originales disminuye con el tiempo). En otras palabras, cuantos más núcleos estén disponibles para decaer, más decaerán (en el tiempo dt). La ecuación \ref{eq2} puede reescribirse como
\
Integrando ambos lados de la ecuación, y definiendo \(N_0\) como el número de núcleos en \(t = 0\), obtenemos
\\Ncomo una potencia de \N(e\N), tenemos la ley de desintegración radiactiva.
Ley de desintegración radiactiva
El número total \(N\) de núcleos radiactivos que quedan después de un tiempo \(t\) es
\
donde \(\lambda\) es la constante de desintegración para el núcleo particular.
El número total de núcleos desciende muy rápidamente al principio, y luego más lentamente (Figura \(\PageIndex{2})).
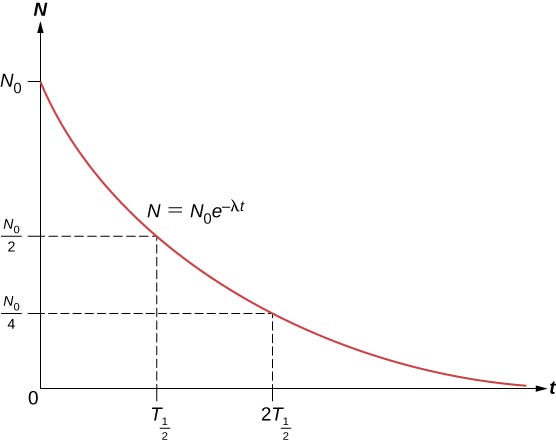
La vida media \((T_{1/2})\Nde una sustancia radiactiva se define como el tiempo que tarda en desintegrarse la mitad de los núcleos originales (o el tiempo en el que queda la mitad de los núcleos originales). Las vidas medias de los isótopos inestables se muestran en la tabla de núclidos. El número de núcleos radiactivos que quedan después de un número entero (n) de semividas es, por lo tanto,
\Nsegún la constante de desintegración ((\lambda)\N) es grande, la semivida es pequeña, y viceversa. Para determinar la relación entre estas cantidades, observe que cuando \(t = T_{1/2}\), entonces \(N = N_0/2\).
Por lo tanto, la ecuación \ref{eq5} puede ser reescrita como
\
Dividiendo ambos lados por \(N_0\) y tomando el logaritmo natural se obtiene
\\Nque se reduce a
\N
Así, si conocemos la vida media T1/2 de una sustancia radiactiva, podemos encontrar su constante de desintegración. El tiempo de vida \(\overline{T}\) de una sustancia radiactiva se define como la cantidad media de tiempo que existe un núcleo antes de decaer. El tiempo de vida de una sustancia es simplemente el recíproco de la constante de desintegración, que se escribe como
\
La actividad A se define como la magnitud de la tasa de desintegración, o
\
El cambio infinitesimal dN en el intervalo de tiempo dt es negativo porque el número de partículas progenitoras (no desintegradas) está disminuyendo, por lo que la actividad (A) es positiva. Definiendo la actividad inicial como \(A_0 = \lambda N_0\), tenemos que
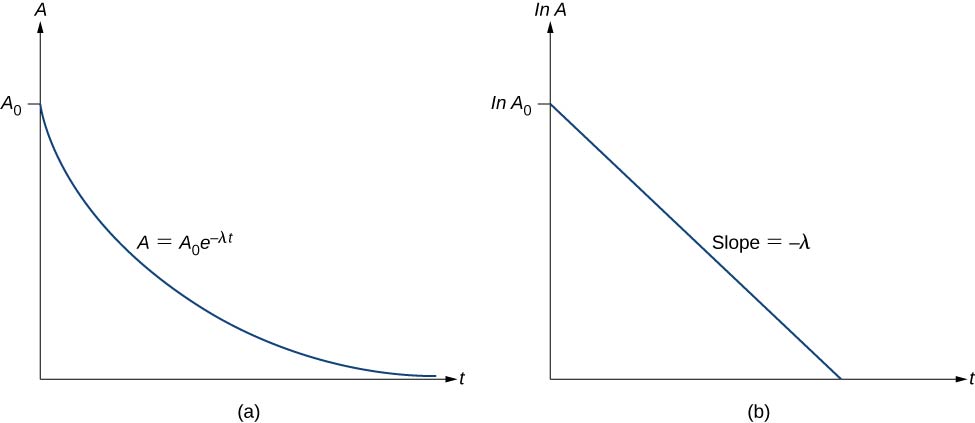
\nla actividad A de una sustancia radiactiva disminuye exponencialmente con el tiempo (Figura (\PageIndex{3}\)).
Ejemplo \(\PageIndex{1}\a): Constante de desintegración y actividad del estroncio-90
La vida media del estroncio-90, \(\ce{_{38}^{90}Sr}\), es de 28,8 y. Encuentre (a) su constante de desintegración y (b) la actividad inicial de 1,00 g del material.
Estrategia
Podemos encontrar la constante de desintegración directamente a partir de la ecuación \ref{eq8}. Para determinar la actividad, primero necesitamos encontrar el número de núcleos presentes.
Solución
a. La constante de desintegración se halla en
\N-
b. La masa atómica de \(_{38}^{90}Sr\) es de 89,91 g. Utilizando el número de Avogadro \(N_A = 6,022 \times 10^{23}\) átomos/mol, encontramos el número inicial de núcleos en 1,00 g del material:
A partir de esto, encontramos que la actividad \(A_0\) a \(t = 0\) para 1.00 g de estroncio-90 es
\
Expresando \(\lambda\) en términos de la vida media de la sustancia, obtenemos
\5049>
Por lo tanto, la actividad se reduce a la mitad después de una vida media. Podemos determinar la constante de decaimiento \(\lambda\) midiendo la actividad en función del tiempo. Tomando el logaritmo natural de los lados izquierdo y derecho de la ecuación \ref{eq11}, obtenemos
\
Esta ecuación sigue la forma lineal \(y = mx + b\). Si graficamos \ln A frente a t, esperamos una línea recta con pendiente \(-\lambda\) e intersección \(\ln \, A_0\) (Figura \(\PageIndex{3b}\). La actividad A se expresa en unidades de becquerelios (Bq), donde uno \(1 \, Bq = 1 \, decaimiento \, por \, segundo). Esta cantidad también puede expresarse en desintegraciones por minuto o desintegraciones por año. Una de las unidades más comunes para la actividad es el curie (Ci), que se define como la actividad de 1 g de ^{226}Ra\). La relación entre el Bq y el Ci es
\N-
Ejemplo \N-(^{2}\N-): ¿Cuál es la actividad \(^{14}C\ en los tejidos vivos?
Aproximadamente \(20\%\) del cuerpo humano en masa es carbono. Calcule la actividad debida al \(^{14}C\) en 1,00 kg de carbono que se encuentra en un organismo vivo. Exprese la actividad en unidades de Bq y Ci.
Estrategia
La actividad de \(^{14}C\) se determina mediante la ecuación \(A_0 = \lambda N_0\), donde λ es la constante de desintegración y \(N_0\) es el número de núcleos radiactivos. El número de núcleos \(^{14}C\) en una muestra de 1,00 kg se determina en dos pasos. En primer lugar, determinamos el número de núcleos \(^{12}C\) utilizando el concepto de mol. En segundo lugar, multiplicamos este valor por \ (1,3 \ por 10^{-12}\) (la abundancia conocida de \(^{14}C\) en una muestra de carbono de un organismo vivo) para determinar el número de núcleos de \(^{14}C\) en un organismo vivo. La constante de desintegración se determina a partir de la vida media conocida de \(^{14}C\) (disponible en ).
Solución
Un mol de carbono tiene una masa de 12,0 g, ya que es casi puro \(^{12}C\). Por lo tanto, el número de núcleos de carbono en un kilogramo es
\Ndebido a que el número de núcleos de \N(^{14}C\N) en 1 kg de carbono es
\Ndebido a que el número de núcleos de \NC\Nde carbono es
Ahora podemos encontrar la actividad \N(A\N) utilizando la ecuación \Nref{eq11}. Introduciendo los valores conocidos, obtenemos
\N5049>
o \N (7,89 \N veces 10^9\) desintegraciones por año. Para convertir esto a la unidad Bq, simplemente convertimos los años en segundos. Así pues,
\
o 250 desintegraciones por segundo. Para expresar A en curies, utilizamos la definición de un curie,
\
Así,
\
Significativo
Aproximadamente \(20\%\) del cuerpo humano en peso es carbono. En el cuerpo humano se producen cientos de desintegraciones de ^{14}C\N cada segundo. El carbono 14 y otras sustancias radiactivas naturales del cuerpo componen la exposición de fondo de una persona a la radiación nuclear. Como veremos más adelante en este capítulo, este nivel de actividad está muy por debajo de las dosis máximas recomendadas.