Las células contienen mucha agua. Una de las funciones del agua es disolver diferentes materiales. Por ejemplo, hay muchos compuestos iónicos diferentes (sales) en las células. Los iones se utilizan para mantener los potenciales celulares y son importantes en la señalización celular y la contracción muscular.
¿Cómo se puede saber si un compuesto es iónico o covalente?
No hay una respuesta sencilla a esta pregunta. Muchos enlaces se encuentran en un punto intermedio. En un enlace covalente polar, un par de electrones se comparte entre dos átomos para cumplir sus octetos, pero los electrones se encuentran más cerca de un extremo del enlace que del otro. Hay más carga negativa hacia un extremo del enlace, y eso deja más carga positiva en el otro extremo.
Mirar los valores de electronegatividad de los diferentes átomos nos ayuda a decidir cómo se comparte uniformemente un par de electrones en un enlace. La electronegatividad aumenta hacia la esquina superior derecha de la tabla periódica debido a una combinación de carga nuclear y factores de apantallamiento. Los átomos de la esquina superior derecha de la tabla periódica tienen una mayor atracción por sus electrones de enlace compartidos, mientras que los de la esquina inferior izquierda tienen una atracción más débil por los electrones de los enlaces covalentes.
En un enlace carbono-oxígeno, se atraerían más electrones hacia el oxígeno porque está a la derecha del carbono en su fila en la tabla periódica. Los compuestos como el éter dimetílico, CH3OCH3, son un poco polares. El formaldehído, CH2O, es aún más polar. Los electrones de los enlaces pi se mantienen más sueltos que los de los enlaces sigma, por razones de mecánica cuántica. Esto permite que el oxígeno atraiga los electrones hacia él más fácilmente en un enlace múltiple que en un enlace sigma.

No todas las polaridades son fáciles de determinar echando un vistazo a la tabla periódica. La dirección del dipolo en un enlace boro-hidrógeno sería difícil de predecir sin buscar los valores de electronegatividad, ya que el boro está más a la derecha pero el hidrógeno está más arriba. Resulta que el hidrógeno es ligeramente negativo.
Un enlace es iónico si la diferencia de electronegatividad entre los átomos es lo suficientemente grande como para que un átomo pueda alejar completamente un electrón del otro. Esta situación es común en los compuestos que combinan elementos del borde izquierdo de la tabla periódica (sodio, potasio, calcio, etc.) con elementos del extremo superior derecho de la tabla periódica (más comúnmente oxígeno, flúor, cloro). El cloruro de sodio es un compuesto iónico.
Muchos enlaces pueden ser covalentes en una situación y iónicos en otra. Por ejemplo, el cloruro de hidrógeno, HCl, es un gas en el que el hidrógeno y el cloro están unidos covalentemente, pero si se burbujea HCl en agua, se ioniza completamente para dar los H+ y Cl- de una solución de ácido clorhídrico. Incluso en el HCl gaseoso, la carga no se distribuye uniformemente. El cloro es parcialmente negativo y el hidrógeno es parcialmente positivo.
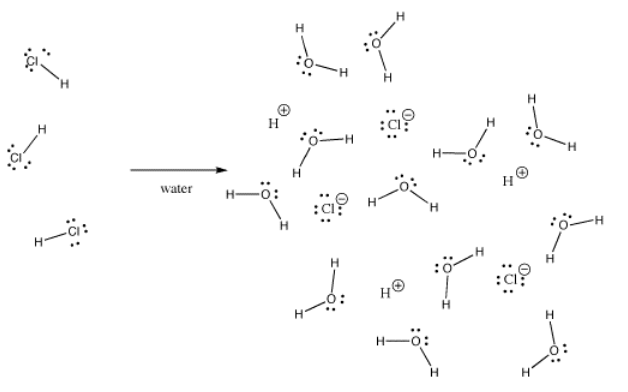
El hidróxido de potasio, KOH, contiene un enlace covalente (O-H) y otro iónico (K-O). El hidrógeno es complicado porque se encuentra en la parte superior de la tabla periódica, así como en el lado izquierdo. Es lo suficientemente electropositivo como para formar enlaces iónicos en algunos casos. Es lo suficientemente electronegativo para formar enlaces covalentes en otros casos.
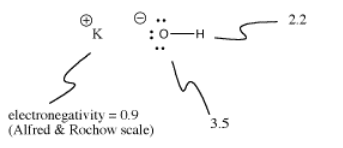
En el KOH, el enlace K-O es iónico porque la diferencia de electronegatividad entre el potasio y el oxígeno es grande. La diferencia de electronegatividad entre el oxígeno y el hidrógeno no es pequeña. Un enlace O-H puede a veces ionizarse, pero no en todos los casos.
A veces la ionización depende de lo que ocurra en una molécula. Dado que el enlace K-O en el hidróxido de potasio es iónico, no es muy probable que el enlace O-H se ionice. El oxígeno ya tiene una carga negativa. La separación de cargas cuesta energía, por lo que es más difícil poner una segunda carga negativa en el oxígeno ionizando también el enlace O-H. Con frecuencia las primeras ionizaciones en las moléculas son mucho más fáciles que las segundas.
Ejercicio \N(\NIndex{1})
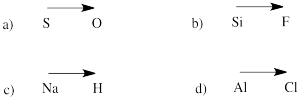
Predecir la dirección de la polaridad en un enlace entre los átomos de los siguientes pares:
a) azufre-oxígeno b) silicio-flúor
c) hidrógeno-sodio d) cloro-aluminio
Respuesta
Porque es muy común que un elemento del extremo izquierdo de la tabla periódica esté presente como catión, y que los elementos del extremo derecho lleven carga negativa, a menudo podemos asumir que un compuesto que contenga un ejemplo de cada uno tendrá al menos un enlace iónico.
Ejercicio \N(\Nde la página{2})
Dibuja las estructuras de los siguientes compuestos. Cada uno contiene al menos un anión y un catión.
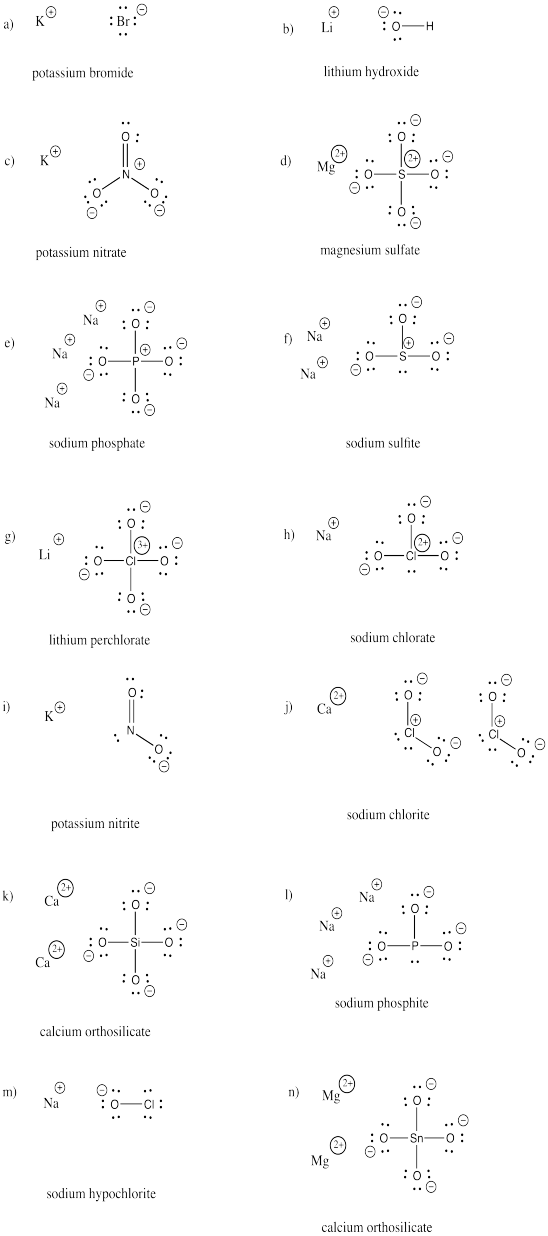
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Respuesta
Ejercicio \(\PageIndex{3})
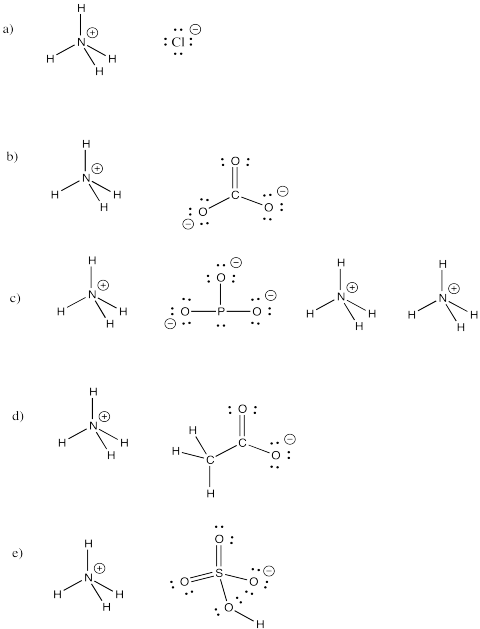
El ion amonio, NH4+, es un ion molecular común. Dibuja las estructuras de los siguientes compuestos que incluyen este ion.
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Respuesta
Ejercicio \(\PageIndex{4})
Muchos aniones tienen nombres que dicen algo sobre su estructura.
| prefijo- o -sufijo |
significado común |
nombre de ejemplo | fórmula de ejemplo |
| -ide | átomo está presente como anión | cloruro | Cl – |
| -ate | está presente como oxianión; por lo general una forma común | clorato | ClO3- |
| -ita | está presente como un oxianión, pero con menos oxígenos (o menor «estado de oxidación») que otra forma común | clorito | ClO2- |
| por- | átomo está presente como un oxianión, pero con aún más oxígenos que la forma «-ato» | perclorato | ClO4- |
| hipo- | está presente como oxianión, pero con aún menos oxígenos que la forma «-ita» | hipoclorito | ClO- |
Usando la tabla como guía, proponga nombres para los siguientes aniones:
a) Br- b) O2- c) F- d) CO32- (oxianión común) e) NO3- (oxianión común) f) NO2-
g) S2- h) SO42- (oxianión común) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (oxianión común) o) PO33- p) I- q) IO3- (oxianión común) r) IO4-
Respuesta a)
bromuro
Respuesta b)
óxido
Respuesta c)
fluoruro
Respuesta d)
carbonato
Respuesta e)
nitrato
Respuesta f)
nitrito
Respuesta g)
sulfuro
Respuesta h)
sulfato
Respuesta i)
sulfito
Respuesta j)
persulfato
Respuesta k)
carburo
Respuesta l)
nitruro
Respuesta m)
arseniuro
Respuesta n)
fosfato
Respuesta o)
fosfito
Respuesta p)
yoduro
Respuesta q)
periodato
Respuesta r)
periodato
Atribución
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)