Espectros de emisión atómica
Los electrones de un átomo tienden a disponerse de forma que la energía del átomo sea lo más baja posible. El estado básico de un átomo es el estado de menor energía del átomo. Cuando esos átomos reciben energía, los electrones absorben la energía y se desplazan a un nivel energético superior. Estos niveles de energía de los electrones en los átomos están cuantizados, lo que significa de nuevo que el electrón debe pasar de un nivel de energía a otro en pasos discretos, en lugar de hacerlo continuamente. Un estado excitado de un átomo es un estado en el que su energía potencial es mayor que la del estado básico. Un átomo en estado de excitación no es estable. Cuando vuelve al estado básico, libera la energía que había ganado previamente en forma de radiación electromagnética.
Entonces, ¿cómo ganan energía los átomos en primer lugar? Una forma es hacer pasar una corriente eléctrica a través de una muestra cerrada de un gas a baja presión. Dado que los niveles de energía de los electrones son únicos para cada elemento, cada tubo de descarga de gas brillará con un color distintivo en función de la identidad del gas (véase más adelante).

Los carteles de «neón» son ejemplos conocidos de tubos de descarga de gas. Sin embargo, sólo los letreros que brillan con el color rojo-naranja que se ve en la figura están realmente llenos de neón. Los letreros de otros colores contienen diferentes gases o mezclas de gases.
Los científicos estudiaron el distintivo color rosa de la descarga de gas creada por el gas hidrógeno. Cuando un haz estrecho de esta luz se observó a través de un prisma, la luz se separó en cuatro líneas de longitudes de onda muy específicas (y frecuencias, ya que \(\lambda\) y \nu\) están inversamente relacionadas). Un espectro de emisión atómica es el patrón de líneas que se forma cuando la luz pasa por un prisma para separarla en las diferentes frecuencias de luz que contiene. La siguiente figura muestra el espectro de emisión atómica del hidrógeno.
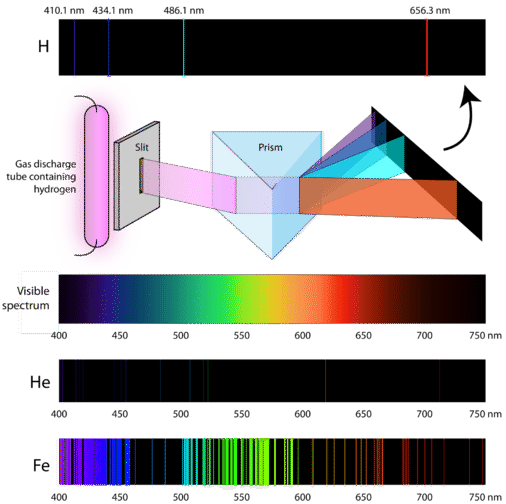
La teoría clásica no pudo explicar la existencia de los espectros de emisión atómica, también conocidos como espectros de emisión de línea. De acuerdo con la física clásica, un átomo en estado básico sería capaz de absorber cualquier cantidad de energía y no sólo cantidades discretas. Del mismo modo, cuando los átomos se relajan de nuevo a un estado de energía más bajo, se puede liberar cualquier cantidad de energía. Esto daría lugar a lo que se conoce como un espectro continuo, en el que están representadas todas las longitudes de onda y frecuencias. La luz blanca vista a través de un prisma y el arco iris son ejemplos de espectros continuos. Los espectros de emisión atómica fueron una prueba más de la naturaleza cuantizada de la luz y condujeron a un nuevo modelo del átomo basado en la teoría cuántica.