La lipofilia es posiblemente la propiedad fisicoquímica más importante de un fármaco potencial, desempeña un papel en la solubilidad, la absorción, la penetración en la membrana, la unión a proteínas plasmáticas, la distribución, la penetración en el SNC y la partición en otros tejidos u órganos como el hígado y tiene un impacto en las rutas de eliminación. Es importante para el reconocimiento del ligando, no sólo para la proteína diana, sino también para las interacciones con el CYP450, la unión al HERG y la inducción enzimática mediada por el PXR.
LogP es un componente de la Regla de los 5 de Lipinski, una regla empírica para predecir la solubilidad y la permeabilidad que se ha convertido en un sustituto de la similitud del fármaco.
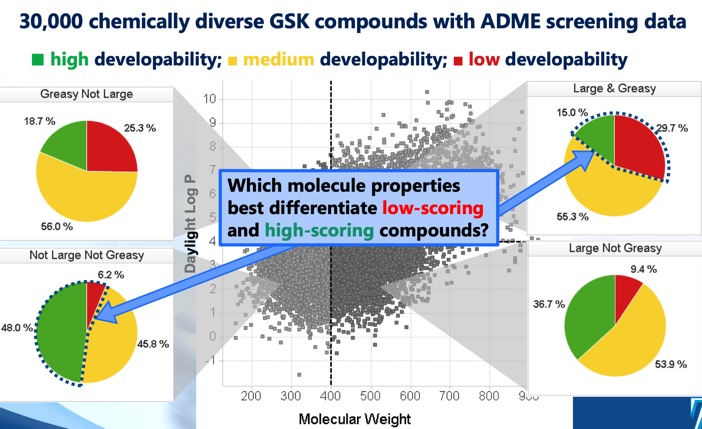
La puntuación de desarrollabilidad DOI identifica cuatro regiones distintas de cLog P/peso molecular que definen el espacio químico óptimo y subóptimo, y una puntuación de desarrollabilidad derivada de modelos de regresión utilizando datos de solubilidad, permeabilidad, unión a proteínas y cribado de inhibición 3A4. Mientras que el sector MWt <400, cLogP <4 sugería la mayor probabilidad de éxito, se observó que incluso el sector MWt >400, cLogP >4 incluía algunas moléculas desarrollables, aunque con una probabilidad de éxito mucho menor.
La medida de lipofilia más utilizada es el LogP, que es el coeficiente de partición de una molécula entre una fase acuosa y otra lipofílica, normalmente octanol y agua.
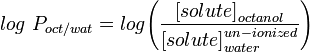
La medición del LogP puede llevarse a cabo de varias maneras, la más común es el método del frasco de agitación, que consiste en disolver parte del soluto en cuestión en un volumen de octanol y agua, agitando durante un período de tiempo, y luego midiendo la concentración del soluto en cada disolvente. Esto puede llevar mucho tiempo, sobre todo si no se dispone de un método espectroscópico rápido para medir la concentración de la molécula en las fases. Un método más rápido de determinación del log P utiliza la cromatografía líquida de alto rendimiento. El log P de un soluto puede determinarse correlacionando su tiempo de retención con compuestos similares con valor log P conocido doi.
Cálculo de la lipofilia
Por lo general, no resulta práctico determinar experimentalmente el log P de cada compuesto fabricado (y puede ser interesante calcular el log P antes de la síntesis), por lo que se utilizan resultados calculados; existen varias herramientas de software disponibles tanto de escritorio como en línea (no utilizar para compuestos confidenciales).
Muchas de estas aplicaciones funcionan utilizando un gran conjunto de datos de entrenamiento de valores conocidos para determinar las contribuciones de los fragmentos para las subestructuras y los grupos funcionales, sin embargo, el logP no es una propiedad aditiva simple y se necesitan términos de corrección para permitir los efectos de proximidad, la unión H, los efectos electrónicos, etc., como se muestra en los ejemplos siguientes.
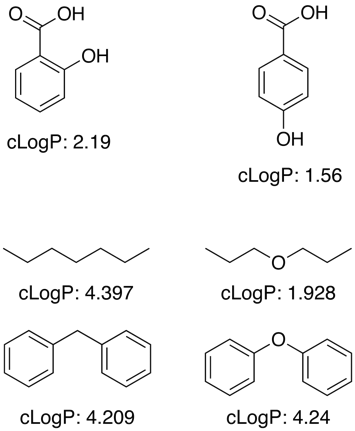
Para los grupos funcionales desconocidos los programas a menudo se aproximan utilizando las contribuciones de los átomos individuales.
Las diferentes metodologías para calcular el logP pueden dividirse en tres enfoques diferentes.
Atómico (por ejemplo. «AlogP», ) &Atómico mejorado / híbrido («XlogP», «SlogP»)
Fragmento («ClogP», KlogP, ACD/logP)
Métodos basados en propiedades («MlogP», «VlogP», «MClogP», «TlogP»)
El logP atómico considera que cada átomo tiene una contribución al logP, y que las contribuciones al valor final son puramente aditivas. Sin embargo, está claro que un nitrógeno en una amida es diferente a un nitrógeno en una amina o una piridina, Enhanced Atomic tiene en cuenta el tipo de átomo.
Los métodos de fragmentos utilizan un gran conjunto de datos de entrenamiento de valores conocidos para determinar las contribuciones de los fragmentos para las subestructuras y los grupos funcionales, junto con términos de corrección para tener en cuenta los efectos de proximidad. Estos métodos a menudo recurren a modelos atómicos para los nuevos grupos funcionales.
Los métodos basados en propiedades tienden a ser computacionalmente exigentes y no son realmente adecuados para probar grandes conjuntos de datos.
Debido a que los conjuntos de entrenamiento y los algoritmos varían entre las aplicaciones, es muy importante no combinar los resultados calculados utilizando diferentes herramientas.
Algunas de las herramientas permiten al usuario ampliar el conjunto de entrenamiento utilizando valores medidos en casa, lo que puede ser crítico cuando se exploran nuevos grupos funcionales o andamios.
LogD
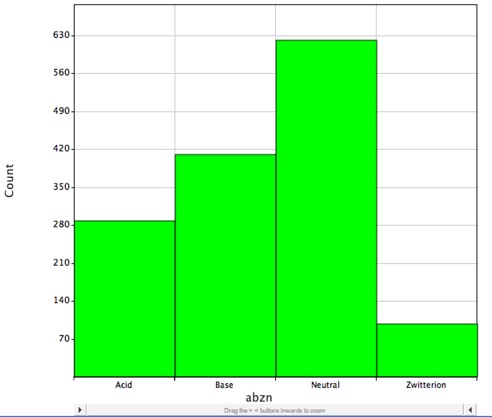
Sin embargo, la mayoría de los fármacos conocidos contienen grupos ionizables, como se muestra en el histograma de abajo, que muestra la distribución de los fármacos de moléculas pequeñas con DrugBank y es probable que estén cargados a pH fisiológico y LogP sólo describe correctamente el coeficiente de partición de las moléculas neutras (sin carga).
LogD la constante de distribución es un mejor descriptor de la lipofilia de una molécula. Puede determinarse de forma similar a la LogP, pero en lugar de utilizar agua, la fase acuosa se ajusta a un pH específico utilizando un tampón. Por tanto, el log D depende del pH, por lo que hay que especificar el pH al que se ha medido el log D. De particular interés es el log D a pH = 7,4 (el pH fisiológico del suero sanguíneo).
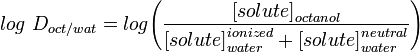
Aplicaciones como Marvin permiten al usuario calcular el log D pero también mostrar el perfil de distribución del pH, como se muestra a continuación para la Warfarina.
Para compuestos con un pKa cercano al pH fisiológico puede ser crítico considerar cuál podría ser realmente la forma ionizada predominante.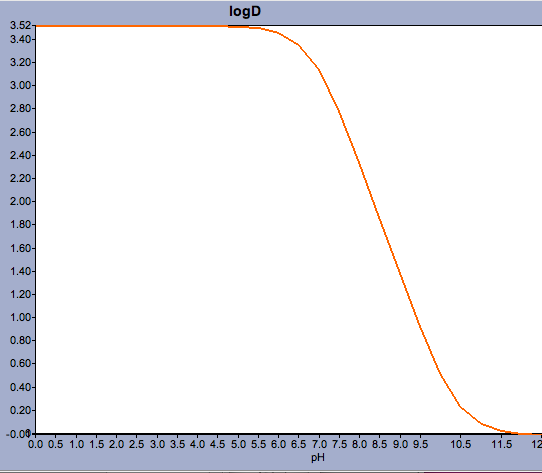
Esto también puede ser valioso cuando se piensa en la absorción desde las diferentes regiones del canal alimentario, donde el pH varía de 1-3 en el estómago a 7-8 en el íleon.
Se han explorado las contribuciones de varios grupos funcionales a la LogD «Contribuciones LogD de los sustituyentes comúnmente utilizados en la química medicinal» DOI, este estudio utilizó el análisis de pares moleculares emparejados de los valores LogD experimentales de varios miles de compuestos recogidos utilizando el método de frasco agitado a pH = 7,4. Informaron de la diferencia media deltaLogD para determinados pares moleculares y los resultados se muestran a continuación para el caso en que el grupo funcional está en cualquier posición del anillo de fenilo. También he incluido el LogD calculado usando el software Chemaxon.
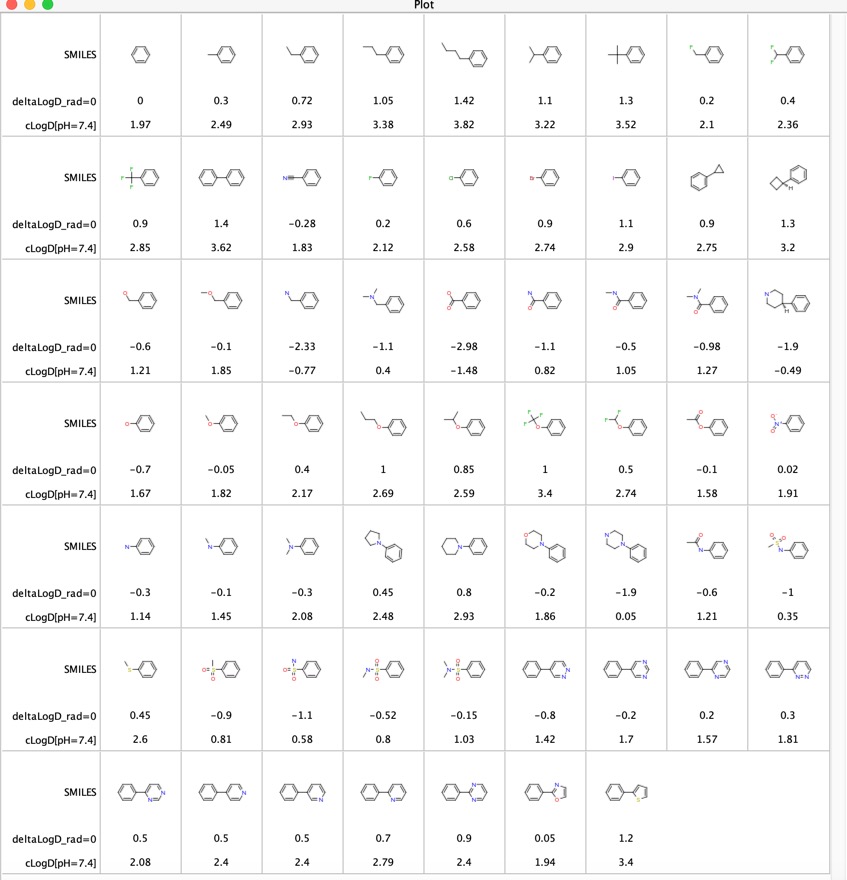
Esta es una tabla útil para comparar grupos funcionales, en particular las últimas 11 entradas comparan la influencia de varios heterociclos tienen en LogD. Estos heterociclos se utilizan a menudo como sustitutos bioisostéricos de un anillo de fenilo.
Pensé que podría ser interesante comparar las diferencias de LogD determinadas utilizando los pares moleculares emparejados (deltaLogD_rad=0) con los valores determinados utilizando el LogD calculado por Chemaxon (deltacLogD). Como se puede ver a continuación hay una correspondencia bastante buena.
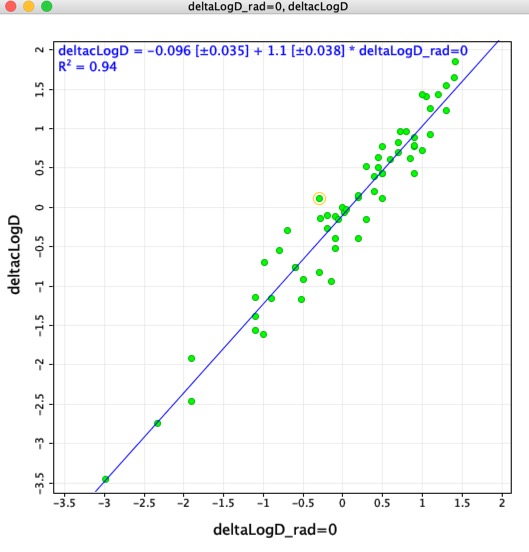
Recuerde Debido a que los conjuntos de entrenamiento y los algoritmos varían entre las aplicaciones es muy importante no combinar los resultados calculados utilizando diferentes herramientas.
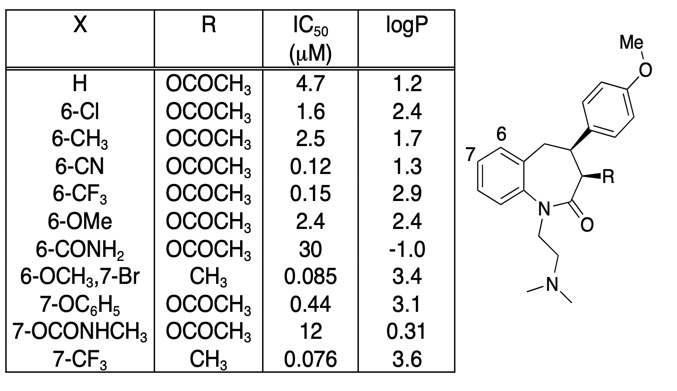
Es importante ser circunspecto que cualquier mejora en la afinidad de unión no es totalmente impulsado por un aumento de LogD, a menudo es útil simplemente trazar afinidad de unión frente a LogD. Las modificaciones de compuestos más interesantes no son necesariamente las que dan el mayor aumento de afinidad, sino que pueden ser las que dan un aumento de afinidad sin un aumento correspondiente de lipofilia. Mirando la tabla de abajo hay un número de compuestos de muy alta afinidad.
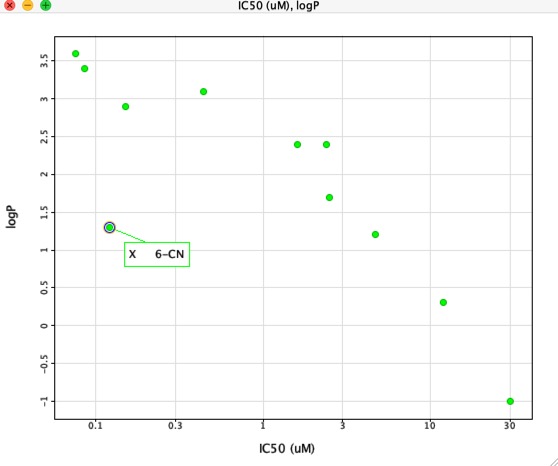
Sin embargo, si trazamos el IC50 frente al LogP como se muestra abajo, hay una correlación muy clara entre el LogP y el IC50, sin embargo un compuesto es claramente diferente. El sustituyente 6-CN da un aumento en la afinidad sin un aumento correspondiente en el LogP.
La lipofilia es también un componente importante, muchas de las responsabilidades fuera del objetivo, incluyendo la unión a proteínas plasmáticas (especialmente a la albúmina), HERG, interacciones con CYP, transportadores, tienen fuertes correlaciones con la lipofilia, y ha habido una serie de estudios que relacionan el LogP alto con la probabilidad de que los compuestos fracasen en el desarrollo como resultado de las pobres características ADMET (absorción, distribución, metabolismo, excreción y toxicidad). Por el contrario, a menudo está claro que se requiere un cierto tamaño y lipofilia para lograr niveles razonables de afinidad. Equilibrar estos requisitos es un reto clave en el descubrimiento de fármacos y la sugerencia es que los químicos se dirijan al punto dulce MWt 250-500 y LogP 2-4. Una consecuencia de este enfoque es la necesidad de dar prioridad a los compuestos de bajo peso molecular y menos lipofílicos en el cribado. El objetivo inicial de la química medicinal debería ser seleccionar puntos de partida de buena calidad y, a continuación, controlar eficazmente los cambios en las propiedades fisicoquímicas durante el proceso de optimización.
Merece la pena leer
Encontrar el punto dulce: el papel de la naturaleza y la crianza en la química medicinal DOI
Eficiencia lipofílica: la métrica de eficiencia más importante en la química medicinal DOI
Última actualización: 12 de enero de 2019