Objetivos de aprendizaje
- Describir las características de un gas.
Las tres fases (o estados) comunes de la materia son los gases, los líquidos y los sólidos. Los gases tienen la menor densidad de los tres, son altamente compresibles y llenan completamente cualquier recipiente en el que se coloquen. Los gases se comportan así porque sus fuerzas intermoleculares son relativamente débiles, por lo que sus moléculas se mueven constantemente con independencia de las demás moléculas presentes. Los sólidos, por el contrario, son relativamente densos, rígidos e incompresibles porque sus fuerzas intermoleculares son tan fuertes que las moléculas están esencialmente bloqueadas. Los líquidos son relativamente densos e incompresibles, como los sólidos, pero fluyen fácilmente para adaptarse a la forma de sus recipientes, como los gases. Por tanto, podemos concluir que la suma de las fuerzas intermoleculares en los líquidos está entre las de los gases y las de los sólidos. La figura 10.1.1 compara los tres estados de la materia e ilustra las diferencias a nivel molecular.
Figura 10.1.1 Una sustancia diatómica (O2) en los estados sólido, líquido y gaseoso
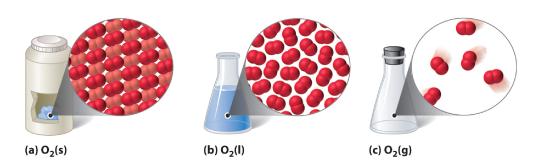
(a) El O2 sólido tiene un volumen y una forma fijos, y las moléculas están muy juntas. (b) El O2 líquido se ajusta a la forma de su recipiente pero tiene un volumen fijo; contiene moléculas relativamente densas. (c) El O2 gaseoso llena completamente su recipiente -independientemente del tamaño o la forma del mismo- y está formado por moléculas muy separadas.
El estado de una determinada sustancia depende en gran medida de las condiciones. Por ejemplo, el H2O se encuentra habitualmente en los tres estados: hielo sólido, agua líquida y vapor de agua (su forma gaseosa). En la mayoría de las condiciones, encontramos el agua como el líquido esencial para la vida; la bebemos, cocinamos con ella y nos bañamos en ella. Cuando la temperatura es lo suficientemente fría como para transformar el líquido en hielo, podemos esquiar o patinar sobre él, empaquetarlo en una bola de nieve o en un cono de nieve, e incluso construir viviendas con él. Vapor de aguaLa distinción entre un gas y un vapor es sutil: el término vapor se refiere a la forma gaseosa de una sustancia que es un líquido o un sólido en condiciones normales (25°C, 1,0 atm). Así, el nitrógeno (N2) y el oxígeno (O2) se denominan gases, pero el agua gaseosa de la atmósfera se llama vapor de agua. es un componente del aire que respiramos, y se produce siempre que calentamos agua para cocinar alimentos o hacer café o té. El vapor de agua a temperaturas superiores a 100°C se llama vapor. El vapor se utiliza para mover grandes máquinas, incluidas las turbinas que generan electricidad. Las propiedades de los tres estados del agua se resumen en la Tabla 10.1.1
La estructura geométrica y las propiedades físicas y químicas de los átomos, iones y moléculas no suelen depender de su estado físico; las moléculas individuales de agua en el hielo, el agua líquida y el vapor, por ejemplo, son todas idénticas. Por el contrario, las propiedades macroscópicas de una sustancia dependen en gran medida de su estado físico, que está determinado por las fuerzas intermoleculares y por condiciones como la temperatura y la presión.
La figura 10.1.2 muestra la ubicación en la tabla periódica de aquellos elementos que se encuentran comúnmente en estado gaseoso, líquido y sólido. Excepto el hidrógeno, los elementos que se presentan naturalmente como gases están en el lado derecho de la tabla periódica. De ellos, todos los gases nobles (grupo 18) son gases monatómicos, mientras que los demás elementos gaseosos son moléculas diatómicas (H2, N2, O2, F2 y Cl2). El oxígeno también puede formar un segundo alótropo, la molécula triatómica altamente reactiva ozono (O3), que también es un gas. Por el contrario, el bromo (como Br2) y el mercurio (Hg) son líquidos en condiciones normales (25°C y 1,0 atm, lo que se conoce como «temperatura y presión ambiente»). El galio (Ga), que se funde a sólo 29,76°C, puede convertirse en líquido simplemente sosteniendo un recipiente con él en la mano o manteniéndolo en una habitación sin aire acondicionado en un día caluroso de verano. El resto de los elementos son todos sólidos en condiciones normales.
Figura 10.1.2 Elementos que se presentan naturalmente como gases, líquidos y sólidos a 25°C y 1 atm
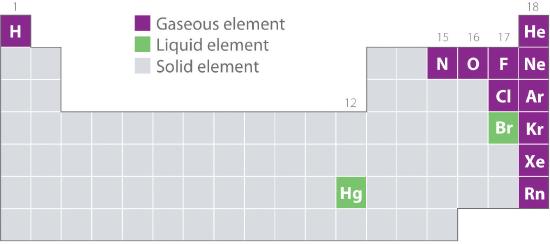
Los gases nobles y el mercurio se presentan como especies monatómicas, mientras que todos los demás gases y el bromo son moléculas diatómicas.
Muchos de los elementos y compuestos que hemos encontrado hasta ahora se encuentran típicamente como gases; algunos de los más comunes se enumeran en la Tabla 10.1.2 . Las sustancias gaseosas incluyen muchos hidruros binarios, como los haluros de hidrógeno (HX); los hidruros de los calcógenos; los hidruros de los elementos del grupo 15 N, P y As; los hidruros de los elementos del grupo 14 C, Si y Ge; y el diborano (B2H6). Además, muchos de los óxidos covalentes simples de los no metales son gases, como el CO, el CO2, el NO, el NO2, el SO2, el SO3 y el ClO2. Muchos compuestos orgánicos de baja masa molecular también son gases, incluidos todos los hidrocarburos con cuatro o menos átomos de carbono y moléculas simples como el éter dimetílico, el cloruro de metilo (CH3Cl), el formaldehído (CH2O) y el acetaldehído (CH3CHO). Por último, los refrigerantes, como los clorofluorocarbonos (CFC) y los hidroclorofluorocarbonos (HCFC), son gases que pueden licuarse fácilmente por compresión y, a su vez, los líquidos pueden convertirse en gases disminuyendo la presión sobre los líquidos. El cambio de fase de líquido a gas en los tubos del interior del frigorífico enfría, mientras que la compresión en las bobinas de la parte inferior o trasera del frigorífico calienta la habitación. El amoníaco y el SO2 son otros gases compresibles que se han utilizado como refrigerantes, pero que no pueden emplearse en las casas por su naturaleza venenosa. El amoníaco se sigue utilizando como refrigerante en grandes establecimientos comerciales debido a su eficacia y bajo coste.
Todas las sustancias gaseosas mencionadas anteriormente (aparte de los gases nobles monatómicos) contienen enlaces covalentes o polares y son moléculas no polares o polares. Por el contrario, las fuertes atracciones electrostáticas de los compuestos iónicos, como el NaBr (punto de ebullición = 1390°C) o el LiF (punto de ebullición = 1673°C), les impiden existir como gases a temperatura y presión ambiente. Además, los miembros más ligeros de cualquier familia de compuestos son probablemente gases, y los puntos de ebullición de los compuestos polares son generalmente mayores que los de los compuestos no polares de masa molecular similar. Por lo tanto, en una serie determinada de compuestos, los miembros más ligeros y menos polares son los que tienen más probabilidades de ser gases. Sin embargo, con relativamente pocas excepciones, los compuestos con más de unos cinco átomos del período 2 o inferiores son demasiado pesados para existir como gases en condiciones normales.
Note the Pattern
Las sustancias gaseosas suelen contener enlaces covalentes o polares covalentes, existen como moléculas no polares o ligeramente polares, tienen masas moleculares relativamente bajas y contienen cinco o menos átomos de los períodos 1 o 2.
Si bien los gases tienen una amplia gama de usos, se cree que los persas emplearon una sustancia gaseosa particularmente sombría en la ciudad romana de Dura, en el este de Siria, en el siglo III de nuestra era. Los persas cavaron un túnel bajo la muralla para entrar y conquistar la ciudad. Las pruebas arqueológicas sugieren que cuando los romanos respondieron con contra-túneles para detener el asedio, los persas encendieron cristales de betún y azufre para producir un gas denso y venenoso. Es probable que fuelles o chimeneas distribuyeran los gases tóxicos. Los restos de unos 20 soldados romanos fueron descubiertos en la base de la muralla, en la entrada de un túnel de menos de 2 m de altura y 11 m de longitud. Dado que es muy improbable que los persas pudieran haber masacrado a tantos romanos en la entrada de un espacio tan reducido, los arqueólogos especulan que los antiguos persas utilizaron la guerra química para conquistar con éxito la ciudad.
Ejemplo 10.1.1
¿Qué compuestos predecirías que son gases a temperatura y presión ambiente?
- ciclohexeno
- carbonato de litio
- ciclobutano
- óxido de vanadio(III)
- ácido benzoico (C6H5CO2H)
Dado: compuestos
Se pide: estado físico
Estrategia:
A Decidir si cada compuesto es iónico o covalente. Un compuesto iónico es muy probablemente un sólido a temperatura y presión ambiente, mientras que un compuesto covalente puede ser un sólido, un líquido o un gas.
B Entre los compuestos covalentes, los que son relativamente no polares y tienen masas moleculares bajas son muy probablemente gases a temperatura y presión ambiente.
Solución:
A El carbonato de litio es Li2CO3, que contiene iones Li+ y CO32-, y el óxido de vanadio(III) es V2O3, que contiene iones V3+ y O2-. Ambos son compuestos principalmente iónicos que se espera que sean sólidos. Los tres compuestos restantes son todos covalentes.
B El ácido benzoico tiene más de cuatro átomos de carbono y es polar, por lo que no es probable que sea un gas. Tanto el ciclohexeno como el ciclobutano son moléculas esencialmente no polares, pero el ciclobutano (C4H8) tiene una masa molecular significativamente menor que el ciclohexeno (C6H10), que también tiene más de cuatro átomos de carbono. Por tanto, predecimos que el ciclobutano es muy probablemente un gas a temperatura y presión ambiente, mientras que el ciclohexeno es un líquido. De hecho, con un punto de ebullición de sólo 12°C, frente a los 83°C del ciclohexeno, el ciclobutano es efectivamente un gas a temperatura y presión ambiente.
Ejercicio
¿Qué compuestos predecirías que son gases a temperatura y presión ambiente?
- n-butanol
- fluoruro de amonio (NH4F)
- ClF
-
óxido de etileno
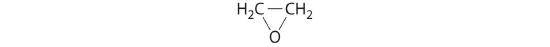
- HClO4
Respuesta: c; d
Resumen
La materia en bruto puede existir en tres estados: gas, líquido y sólido. Los gases tienen la menor densidad de los tres, son altamente compresibles y llenan completamente sus recipientes. Los elementos que existen como gases a temperatura y presión ambiente se agrupan en el lado derecho de la tabla periódica; se presentan como gases monatómicos (los gases nobles) o como moléculas diatómicas (algunos halógenos, N2, O2). Muchos compuestos inorgánicos y orgánicos con cuatro o menos átomos distintos del hidrógeno también son gases a temperatura y presión ambiente. Todas las sustancias gaseosas se caracterizan por tener interacciones débiles entre las moléculas o los átomos que las componen.
Key Takeaway
- Las moléculas de las sustancias gaseosas suelen contener enlaces covalentes o polares covalentes, son moléculas no polares o ligeramente polares y tienen masas moleculares relativamente bajas.
Problemas conceptuales
-
Explique las diferencias entre las propiedades microscópicas y macroscópicas de la materia. El punto de ebullición de un compuesto, ¿es una propiedad microscópica o macroscópica? masa molecular? Por qué?
-
Determina si el punto de fusión, el momento dipolar y la conductividad eléctrica son propiedades macroscópicas o microscópicas de la materia y explica tu razonamiento.
-
¿Cómo influyen las propiedades microscópicas de la materia en las macroscópicas? Puedes relacionar la masa molecular con el punto de ebullición? ¿Por qué sí o por qué no? ¿Puede relacionarse la polaridad con el punto de ebullición?
-
Para una sustancia que tiene fases gaseosa, líquida y sólida, ordene estas fases en orden de aumento de
- densidad.
- fuerza de las interacciones intermoleculares.
- compresibilidad.
- movimiento molecular.
- orden en la disposición de las moléculas o átomos.
-
Explique qué hay de malo en esta afirmación: «El estado de la materia determina en gran medida las propiedades moleculares de una sustancia.»
-
Describa los factores más importantes que determinan el estado de un determinado compuesto. Qué condiciones externas influyen en que una sustancia exista en alguno de los tres estados de la materia?
-
¿Qué elementos de la tabla periódica existen como gases a temperatura y presión ambiente? De ellos, ¿cuáles son moléculas diatómicas y cuáles monatómicas? ¿Qué elementos son líquidos a temperatura y presión ambiente? ¿Qué parte de la tabla periódica contiene elementos cuyos hidruros binarios son muy probablemente gases a temperatura ambiente?
-
¿Es correcta la siguiente observación? «Casi todos los hidruros binarios no metálicos son gases a temperatura ambiente, pero los hidruros metálicos son todos sólidos». Explica tu razonamiento.
-
¿Es correcta la siguiente observación? «Todos los hidruros de los calcógenos son gases a temperatura y presión ambiente, excepto el hidruro binario de oxígeno, que es un líquido». Explica tu razonamiento. ¿Esperarías que el 1-cloropropano fuera un gas? ¿El yodopropano? ¿Por qué?
-
Explique por qué los compuestos iónicos no son gases en condiciones normales.
Respuestas
-
-
-
.
-
-
Las propiedades moleculares de una sustancia controlan su estado de la materia bajo un conjunto determinado de condiciones, y no al revés. La presencia de fuerzas intermoleculares fuertes favorece un estado de materia condensado (líquido o sólido), mientras que una interacción intermolecular muy débil favorece el estado gaseoso. Además, la forma de las moléculas dicta si una fase condensada es un líquido o un sólido.
-
-
Los elementos que existen como gases se encuentran principalmente en la esquina superior derecha y en el lado derecho de la tabla periódica. Los siguientes elementos existen como gases: H, He, N, O, F, Ne, Cl, Ar, Kr, Xe y Rn. Así, la mitad de los halógenos, todos los gases nobles y los calcógenos y picnógenos más ligeros son gases. De ellos, todos, excepto los gases nobles, existen como moléculas diatómicas. Sólo dos elementos existen como líquidos a una temperatura ambiente normal de 20°C-25°C: el mercurio y el bromo. La parte superior derecha de la tabla periódica incluye también la mayoría de los elementos cuyos hidruros binarios son gases. Además, los hidruros binarios de los elementos de los grupos 14-16 son gases.
-
-
-
.