US Pharm. 2009;34(2):25-27.
Kardiovaskulární onemocnění (KVO), hlavní příčina úmrtí na celém světě, zahrnuje mechanismy, které dosud nebyly plně pochopeny. Přestože jsou plazmatické lipidy biologicky nezbytné pro syntézu buněčných membrán a produkci hormonů a jsou zdrojem volných mastných kyselin, dyslipidemie je již dlouho spojována se zvýšeným výskytem KVO, cévní mozkové příhody a periferního arteriálního onemocnění.1
Tradiční stratifikace rizika
Současný přístup k léčbě dyslipidemie je specifikován v National Cholesterol Education Program Adult Treatment Panel (ATP) III.2 V ATP III jsou rizikové faktory a následná stratifikace rizika odvozeny výpočtem tzv. framinghamského rizikového skóre (FRS), které se již desítky let používá k predikci rizika KVO. ATP III poskytuje doporučení pro stratifikaci rizika podle více rizikových faktorů, diabetu a metabolického syndromu. Mezi rizikové faktory ischemické choroby srdeční (ICHS) patří hypertenze (krevní tlak ≥ 140/90 nebo užívání antihypertenziv), rodinná anamnéza (příbuzný prvního stupně s ICHS ), věk (muži ≥ 45 let, ženy ≥ 55 let), hladina lipoproteinů o vysoké hustotě (HDL) vyšší než 40 mg/dl a kouření. Hladina HDL vyšší než 50 mg/dl je označována za kardioprotektivní, a proto je považována za „negativní“ rizikový faktor. Kromě výčtu specifických rizikových faktorů CHD jsou v dokumentu ATP III uvedeny i rizikové ekvivalenty CHD (stavy, které přinášejí podobné riziko vzniku CHD). Mezi rizikové ekvivalenty CHD patří onemocnění karotických tepen, aneuryzma břišní aorty, periferní arteriální onemocnění, diabetes mellitus nebo desetileté riziko infarktu myokardu (IM) nejméně 20 % (tj. FRS ≥ 20 %).1,2
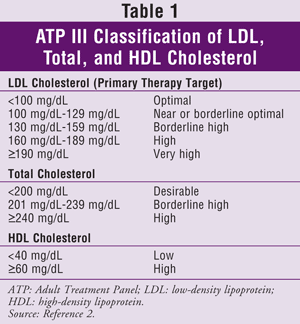
ATP III uvádí jako primární cíl léčby cholesterolu lipoproteiny o nízké hustotě (LDL). Dosažení cílových hladin triglyceridů (TG) a HDL je obecně považováno za sekundární cíl. Cílové hodnoty cholesterolu pro obecnou populaci jsou uvedeny v TABULCE 1.2
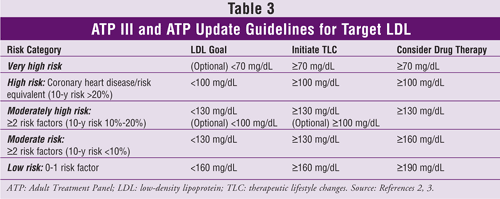
V roce 2004 byla zveřejněna aktualizace ATP III.3 Tato verze obsahuje doporučení pro snížení LDL o 30-40 % oproti výchozí hodnotě u pacientů, kteří jsou považováni za pacienty se středním nebo vysokým rizikem CHD, a pokyny, podle kterých je pacient považován za pacienta s velmi vysokým rizikem. Mezi pacienty s velmi vysokým rizikem mohou patřit pacienti s prokázaným KVO a jedním nebo více z následujících faktorů: více hlavních rizikových faktorů (např. diabetes); závažné a špatně kontrolované rizikové faktory (např, kouření, nekontrolovaná hypertenze); více složek metabolického syndromu (TABULKA 2); nebo akutní koronární syndrom.

Aktualizace ATP III také navrhuje, aby se u některých pacientů zvážila medikace snižující hladinu lipidů a cílová hodnota LDL nižší než 100 mg/dl.3 Tito pacienti by měli mít 10leté riziko CHD 10-20 % a hladinu LDL mezi 100 mg/dl a 130 mg/dl. Měli by být také v pokročilém věku a mít závažné rizikové faktory; hladinu TG 200 mg/dl nebo vyšší, hladinu non-HDL 160 mg/dl nebo vyšší a hladinu HDL 40 mg/dl nebo nižší; metabolický syndrom nebo nové rizikové faktory, jako je vysoce citlivý C-reaktivní protein (hs-CRP) (<3 mg/dl) nebo koronární kalcium vyšší než 75. percentil pro věk a pohlaví dané osoby.
Cílové hladiny LDL, doporučení pro terapeutické změny životního stylu a informace o zahájení léčby léky snižujícími hladinu cholesterolu (na základě počtu rizikových faktorů KVO nebo jejich ekvivalentů) z ATP III a její aktualizace jsou uvedeny v TABULCE 3.2,3
Netradiční rizikové markery
Tradiční predikce rizika KVO se do značné míry opírá o FRS. Tento přístup má však svá omezení, neboť bylo zjištěno, že FRS nadhodnocuje riziko v populaci s nízkým rizikem a podhodnocuje riziko v populaci s vysokým rizikem.4 Ve skutečnosti se náhlá smrt a nefatální infarkt bez předchozích příznaků vyskytují až u 25 % pacientů s KVO.5 Jak již bylo uvedeno, aktualizace ATP III doporučuje zvážit agresivnější lipidovou léčbu u pacientů s novými rizikovými faktory.3 V posledním desetiletí se výzkum zaměřuje na roli netradičních rizikových faktorů v patofyziologii KVO. Fibrinogen, hs-CRP, koronární vápník a analýza subfrakcí lipoproteinů byly předmětem mnoha výzkumů.
Ačkoli s KVO souvisí několik markerů zánětu, praktickou hodnotu mají pouze ty, které lze snadno měřit.6 Jedním z takových zánětlivých markerů je hs-CRP.7 Zvýšená hodnota hs-CRP je spojena se zvýšeným rizikem KVO, cévní mozkové příhody a periferního cévního onemocnění u pacientů se známou aterosklerózou i bez ní. Hladiny hs-CRP byly rozděleny do terciálů. Tyto tercily (<1,0 mg/l, 1 mg/l-3 mg/l a >3 mg/l) odpovídají v uvedeném pořadí FRS nízkého, středního a vysokého rizika.8
Nejnovější velkou klinickou studií zkoumající užitečnost CRP při predikci kardiovaskulárního rizika je studie JUPITER.9 Tato studie zahrnovala konkrétně zdravé pacienty s normálním cholesterolem (LDL <130 mg/dl) a zvýšenou hladinou CRP (>2 mg/dl). Tito pacienti byli léčeni rosuvastatinem v dávce 20 mg nebo placebem s cílem vyhodnotit složený koncový ukazatel následného infarktu myokardu nebo nefatální mozkové příhody a složené riziko infarktu myokardu, mozkové příhody a úmrtí z kardiovaskulárních příčin. Studie byla ukončena po 1,9 letech sledování, protože bylo zjištěno, že léčba rosuvastatinem snižuje složený koncový ukazatel o 44 % ve srovnání s placebem. Tato studie byla přelomová, protože prokázala, že pacienti bez jiných kardiovaskulárních rizikových faktorů než zvýšeného CRP získali významný přínos z léčby rosuvastatinem; není však známa nákladová efektivita screeningu zdravých osob na zvýšené CRP a rozšíření předepisování statinů v těchto případech.
Kromě statinů bylo prokázáno, že hladiny CRP snižují i další látky snižující hladinu lipidů (např. niacin, fibráty a ezetimib), stejně jako thiazolidindiony a raloxifen. V současné době se doporučuje zvažovat hladiny hs-CRP při rozhodování o léčbě u pacientů s FRS předpovídaným rizikem KVO 10-20 % v příštích 10 letech a vyhýbat se rutinnímu měření hs-CRP v běžné dospělé populaci.7,8,10
Fibrinogen byl rovněž studován jako netradiční prediktor rizika KVO. Ve studii CARDIA (Coronary Artery Risk Development in Young Adults) byla zvýšená hladina fibrinogenu u osob ve věku 25 až 37 let spojena se zvýšeným rizikem subklinických KVO v následujícím desetiletí života pacienta.10 Fibrinogen hraje důležitou roli při agregaci krevních destiček a tvorbě fibrinu, což jsou klíčové složky aterosklerózy a vzniku trombů.1,11 U pacientů ve studii CARDIA, kteří měli zvýšenou hladinu fibrinogenu, byla v následujícím desetiletí zjištěna zvýšená tloušťka intimy karotid a kalcifikace koronárních tepen (CAC). V současné době se však rutinní měření hladiny fibrinogenu nedoporučuje.10
CAC vzniká v aterosklerotických koronárních tepnách a v normální cévní stěně se prakticky nevyskytuje. Vyšší skóre CAC je spojeno se zvýšenou specificitou, ale sníženou senzitivitou pro predikci kardiovaskulárního rizika. Je však důležité poznamenat, že ačkoli zvýšené skóre CAC koreluje se zvýšeným rizikem KVO, kardiovaskulární příhody se mohou vyskytnout i u pacienta s nulovým skóre CAC. O prognostické hodnotě měření CAC se v posledním desetiletí hodně diskutovalo. Od roku 2000 přibývá důkazů, že CAC může být nezávislým prediktorem kardiovaskulárního výsledku nad rámec tradičních rizikových faktorů. V roce 2007 publikoval výbor American College of Cardiology Foundation/American Heart Association Writing Committee konsenzuální dokument týkající se použití CAC při globálním hodnocení kardiovaskulárního rizika.12 Výbor se shodl na tom, že nedoporučuje provádět neselektovaný screening CAC, protože u pacientů s nízkým rizikem KVO (FRS <1 %/rok) má omezený klinický význam. Stejně jako u hs-CR a fibrinogenu se rutinní měření CAC nedoporučuje; skóre CAC však může být užitečným nástrojem pro úpravu predikce rizika a potenciální změnu terapie u vhodně vybraných asymptomatických pacientů se středním rizikem.
Lipoprotein(a) neboli Lp(a) je v doporučeních ATP III označen za nový rizikový faktor KVO.2 Lipidy jsou v těle transportovány jako komplexy lipidů a bílkovin známé jako lipoproteiny. Lipoproteiny se liší velikostí a hustotou a podle toho se označují jako LDL, HDL a lipoproteiny s velmi nízkou hustotou (VLDL). Bílkovinné složky těchto komplexů se označují jako apolipoproteiny. Lp(a), modifikovaná forma LDL, se skládá z molekuly apoproteinu(a) neboli apo(a) spojené s molekulou apolipoproteinu B neboli apo(b) tradiční částice LDL. Složením i hustotou se podobá LDL. Předpokládá se, že vzhledem k tomu, že složka apo(a) Lp(a) je strukturně podobná plazminogenu, může s plazminogenem v těle soutěžit, a tím inhibovat fibrinolýzu. Kromě toho se předpokládá, že Lp(a) podporuje akumulaci cholesterolu, rozvoj pěnových buněk a propagaci aterosklerotických plátů.1 Bylo prokázáno, že niacin i estrogen účinně snižují hladinu Lp(a); žádný statin to však účinně nedokáže.13,14 Zvýšené hladiny Lp(a) byly u některých, ale ne u všech studovaných populací spojeny se zvýšeným rizikem KVO.15 V současné době neexistují žádné důkazy o tom, že sledování nebo snižování hladin Lp(a) je klinicky užitečné, a rutinní měření se nedoporučuje.16
Apolipoprotein(b) je hlavní proteinovou složkou nejen LDL, ale také LDL se střední hustotou a VLDL. Pro predikci kardiovaskulárního rizika bylo nedávno navrženo, že měření hladiny apo(b) a non-HDL cholesterolu je lepší než měření LDL cholesterolu.17 V post-hoc analýze studií Treating to New Targets a IDEAL bylo zjištěno, že non-HDL cholesterol (součin odečtení HDL cholesterolu od naměřeného celkového cholesterolu) a apo(b) mají těsnější vztah ke kardiovaskulárním následkům než LDL cholesterol.18,19 Spekuluje se o tom, že budoucí doporučení mohou jako primární cíl léčby upřednostňovat non-HDL cholesterol nebo apo(b) před LDL cholesterolem; v současné době však LDL zůstává primárním cílem léčby cholesterolu.
Hyperhomocysteinemie byla nezávisle spojena se zvýšeným rizikem KVO, i když není tak silně spojena jako FRS a přesný příčinný mechanismus není znám.20 Defekty ve folátové a B12 dráze mohou vést ke zvýšené hladině homocysteinu, stejně jako strava s nedostatkem folátů nebo vitaminů B6 a B12 a léky, které narušují metabolismus nebo vstřebávání těchto vitaminů.1 Zvýšenou hladinu homocysteinu může způsobit také selhání ledvin a jater. Předpokládá se, že hyperhomocysteinémie je poměrně vzácná. Starší populace může být vystavena zvýšenému riziku tohoto stavu v důsledku nedostatku folátů ve stravě. Měření hladiny homocysteinu by se mělo provádět, když je pacient nalačno, přičemž zvýšená hladina by měla být podnětem k posouzení etiologie.
Dalším potenciálním nástrojem pro další stratifikaci kardiovaskulárního rizika je analýza subfrakcí lipoproteinů. Je známo, že měření LDL zahrnuje spektrum LDL částic od těch, které jsou malé a husté, až po ty, které jsou lehčí a plovoucí. Je známo, že malé a husté částice LDL přinášejí vyšší kardiovaskulární riziko.21 S nárůstem LDL přibývá malých a hustých subfrakcí LDL. Stejně tak měření celkového LDL sestává ze spektra částic různé velikosti a hustoty. Menší a hustší molekuly HDL mají menší kardioprotektivní účinek. S poklesem hladiny HDL dochází k výraznému nárůstu malých částic HDL. Na základě těchto zjištění bylo navrženo, že zvýšená hladina LDL, zvýšená hladina malých subfrakcí LDL, nízká hladina HDL a nízká hladina velkých subfrakcí HDL jsou prediktivními faktory KVO. Směrnice ATP III uznávají, že malé LDL částice byly identifikovány jako součást aterogeneze a že měření HDL subfrakcí může přispět k posouzení rizika KVO. Podle těchto pokynů však není dobře definována schopnost subfrakcí LDL predikovat KVO nezávisle na ostatních rizikových faktorech. ATP III dále poukazuje na to, že klinická užitečnost měření HDL subfrakcí nebyla stanovena. Z tohoto důvodu a vzhledem k tomu, že dosud nebyly stanoveny smysluplné a reprodukovatelné hraniční hodnoty pro velikost, hustotu a počet částic, se měření subfrakcí lipoproteinů nepoužívá při rutinní léčbě hyperlipidemie ani při stratifikaci rizika. Může však být užitečné jako doplněk tradiční stratifikace rizika pro určení agresivity léčby u pacienta se středním rizikem.
Závěr
Přestože léčebná doporučení založená na ATP III, která se do značné míry opírají o FRS, zůstávají jádrem léčebných doporučení u KVO, objevují se netradiční ukazatele KVO jako doplňky, které poskytují přesnější stratifikaci rizika a pomáhají při identifikaci pacientů s časným subklinickým onemocněním, kteří mohou potřebovat časnější a agresivnější léčbu.
Přesná úloha netradičních markerů rizika KVO při určování budoucího kardiovaskulárního rizika člověka, pokyny pro cílové hladiny a konkrétní doporučení, u kterých populací by se tyto markery měly rutinně měřit, dosud nebyly vymezeny. Žádný z netradičních markerů KVO není v současné době doporučen pro rutinní screening; u pacientů, u nichž není jasné rozhodnutí o zahájení léčby (zejména medikace), však může být měření těchto rizikových faktorů užitečné. V takových situacích může být měření netradičních rizikových faktorů vedle tradičních nástrojů pro predikci rizika KVO významným přínosem.
1. Talbert RL. Hyperlipidemie. In: Srovnávací studie k problematice hyperlipidemie: DiPiro JT, Talbert RL, Yee GC, et al, eds. Pharmacotherapy: A Pathophysiologic Approach. 7th ed. New York, NY: McGraw Hill Medical; 2008:385-407.
2. National Heart Lung and Blood Institute. Third report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). www.nhlbi.nih.gov/guidelines/cholesterol/. Accessed November 1, 2008.
3. Grundy SM, Cleeman JI, Merz CN, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation. 2004;110:227-239.
4. Brindle P, Beswick A, Fahey T, Ebrahim S. The accuracy and impact of risk assessment in the primary prevention of cardiovascular disease: a systematic review. Heart. 2006;92:1752-1759.
5. Myerburg RJ, Kessler KM, Castellanos A. Náhlá srdeční smrt: epidemiologie, přechodné riziko a hodnocení intervence. Ann Intern Med. 1993;119:1187-1197.
6. de Ferranti SD, Rifai N. C-reaktivní protein: netradiční sérový marker kardiovaskulárního rizika. Cardiovasc Pathol. 2007;16:14-21.
7. Koenig W, Sund M, Frölich M, et al. C-reaktivní protein, citlivý marker zánětu, předpovídá budoucí riziko ischemické choroby srdeční u původně zdravých mužů středního věku: výsledky studie MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburg Cohort Study, 1984 až 1992. Circulation. 1999;99:237-242.
8. Pearson TA, Mensah GA, Alexander RW, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: a statement for health-care professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003;107:499-511.
9. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin k prevenci cévních příhod u mužů a žen se zvýšeným C-reaktivním proteinem. N Engl J Med. 2008;359:2195-2207.
10. Výbor pro kardiovaskulární a metabolická onemocnění. Hodnocení rizika kardiovaskulárních onemocnění pomocí netradičních rizikových faktorů: nejnovější poznatky. CMDManagement Insights Informat Cardiovasc Metabol Dis. 2008;13(2):1-3,6.
11. Mora S, Rifai N, Buring JE, Ridker PM. Additivní hodnota hladin fibrinogenu a vysoce citlivého C-reaktivního proteinu měřených imunoanalýzou pro predikci incidence kardiovaskulárních příhod. Circulation. 2006;114:381-387.
12. Greenland B, Bonow RO, Brundage BH, et al. ACCF/AHA 2007 Clinical Expert Consensus Document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain. A report of the American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography). J Am Coll Cardiol. 2007;49:378-402.
13. Angelin B. Terapie pro snížení hladiny lipoproteinu (a). Curr Opin Lipidol. 1997;8:337-341.
14. Brown BG, Zhao XQ, Chait A, et al. Simvastatin a niacin, antioxidační vitaminy nebo jejich kombinace v prevenci koronárních onemocnění. N Engl J Med. 2001;345:1583-1592.
15. Moliterno D, Jokinen EV, Miserez AR, et al. Žádný vztah mezi plazmatickými koncentracemi lipoproteinu(a) a přítomností či nepřítomností koronární aterosklerózy u Afroameričanů. Arterioscler Thromb Vasc Biol. 1995;15:850-855.
16. Bennet A, Di Angelantonio E, Erqou S, et al. Lipoprotein(a) levels and risk of future coronary heart disease: large-scale prospective data. Arch Intern Med. 2008;168:598-608.
17. Kastelein JJ, van der Steeg WA, Holme I, et al. Lipidy, apolipoproteiny a jejich poměry ve vztahu ke kardiovaskulárním příhodám při léčbě statiny. Circulation. 2008;117:3002-3009.
18. LaRosa JC, Grundy SM, Waters DD, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med. 2005;352:1425-1435.
19. Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA. 2005;294:2437-2445.
20. Wald DS, Law M, Morris JK. Homocystein a kardiovaskulární onemocnění: důkaz kauzality z metaanalýzy. BMJ. 2002;325:1202-1206.
21. Rizzo M, Berneis K. Velikost lipoproteinů o nízké hustotě a hodnocení kardiovaskulárního rizika. QJM.2006;99:1-14.