US Pharm. 2009;34(2):25-27.
Las enfermedades cardiovasculares (ECV), la principal causa de muerte en todo el mundo, implican mecanismos que aún no se conocen del todo. Aunque los lípidos plasmáticos son biológicamente necesarios para la síntesis de las membranas celulares y la producción de hormonas y son una fuente de ácidos grasos libres, la dislipidemia se ha relacionado desde hace tiempo con el aumento de la incidencia de ECV, ictus y enfermedad arterial periférica.1
Estratificación tradicional del riesgo
El enfoque actual del tratamiento de la dislipidemia se especifica en el Panel de Tratamiento para Adultos (ATP III) del Programa Nacional de Educación sobre el Colesterol.2 En el ATP III, los factores de riesgo y la posterior estratificación del riesgo se derivan del cálculo de lo que se conoce como puntuación de riesgo de Framingham (FRS), que se ha utilizado durante décadas para predecir el riesgo de ECV. El ATP III ofrece recomendaciones para la estratificación del riesgo en función de múltiples factores de riesgo, la diabetes y el síndrome metabólico. Los factores de riesgo de enfermedad coronaria (EC) incluyen la hipertensión (presión arterial ≥140/90 o uso de antihipertensivos); los antecedentes familiares (familiar de primer grado con EC); la edad (hombre, ≥45 años; mujer, ≥55 años); el nivel de lipoproteínas de alta densidad (HDL) superior a 40 mg/dL; y el tabaquismo. Un nivel de HDL superior a 50 mg/dL se identifica como cardioprotector y, por tanto, se considera un factor de riesgo «negativo». Además de enumerar los factores de riesgo específicos de la cardiopatía isquémica, el ATP III identifica los equivalentes de riesgo de la cardiopatía isquémica (condiciones que confieren un riesgo similar de padecerla). Los equivalentes de riesgo de cardiopatía isquémica incluyen la enfermedad de la arteria carótida, el aneurisma de la aorta abdominal, la enfermedad arterial periférica, la diabetes mellitus o un riesgo de infarto de miocardio (IM) a 10 años de al menos el 20% (es decir, FRS ≥20%).1,2
La ATP III especifica las lipoproteínas de baja densidad (LDL) como objetivo principal para el tratamiento del colesterol. Alcanzar los niveles objetivo de triglicéridos (TG) y HDL se considera generalmente un objetivo secundario. Los objetivos de colesterol para la población general se indican en la TABLA 1.2
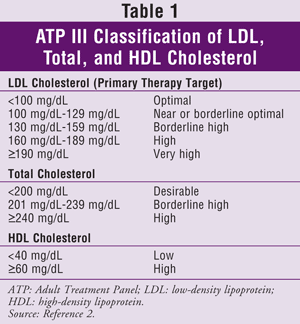
En 2004 se publicó una actualización del ATP III.3 Esta versión incluye una recomendación de reducción del 30% al 40% de las LDL basales en los pacientes considerados de riesgo moderado o alto de cardiopatía isquémica, así como directrices según las cuales se considera que un paciente tiene un riesgo muy alto. Los pacientes de muy alto riesgo pueden ser aquellos con una ECV establecida más uno o más de los siguientes: múltiples factores de riesgo importantes (por ejemplo, diabetes); factores de riesgo graves y mal controlados (por ejemplo, tabaquismo, hipertensión no controlada); múltiples componentes del síndrome metabólico (TABLA 2); o síndrome coronario agudo.

La actualización del ATP III también sugiere que se considere la medicación hipolipemiante y un objetivo de LDL inferior a 100 mg/dL para determinados pacientes.3 Estos pacientes deben tener un riesgo de cardiopatía isquémica a 10 años del 10% al 20% y un nivel de LDL entre 100 mg/dL y 130 mg/dL. También deben tener una edad avanzada y presentar factores de riesgo graves; un nivel de TG igual o superior a 200 mg/dL, un nivel de no-HDL igual o superior a 160 mg/dL y un nivel de HDL igual o inferior a 40 mg/dL; síndrome metabólico; o factores de riesgo emergentes como la proteína C reactiva de alta sensibilidad (hs-CRP) (<3 mg/dL) o un calcio coronario superior al percentil 75 para la edad y el sexo de la persona.
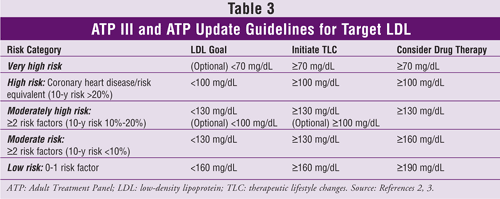
Los niveles de LDL objetivo, las recomendaciones de cambios terapéuticos en el estilo de vida y la información sobre el inicio de la medicación para reducir el colesterol (basada en el número de factores de riesgo de ECV o equivalentes) del ATP III y su actualización se indican en la TABLA 3.2,3
Marcadores de riesgo no tradicionales
La predicción tradicional del riesgo de ECV se basa en gran medida en la FRS. Sin embargo, este enfoque tiene limitaciones, ya que se ha observado que la FRS sobrestima el riesgo en poblaciones de bajo riesgo y subestima el riesgo en poblaciones de alto riesgo.4 De hecho, la muerte súbita y el IM no mortal sin síntomas previos se producen hasta en el 25% de los pacientes con cardiopatía coronaria.5 Como se ha indicado anteriormente, la actualización del ATP III recomienda considerar un tratamiento lipídico más agresivo en pacientes con factores de riesgo emergentes.3 Durante la última década, la investigación se ha centrado en el papel que desempeñan los factores de riesgo no tradicionales en la fisiopatología de la ECV. El fibrinógeno, la PCR-as, el calcio coronario y el análisis de las subfracciones de las lipoproteínas han sido objeto de muchas investigaciones.
Aunque se han asociado varios marcadores de inflamación con la ECV, sólo los que pueden medirse fácilmente tienen valor práctico.6 Uno de estos marcadores inflamatorios es la PCR-as.7 La PCR-as elevada se ha asociado con un mayor riesgo de ECV, ictus y enfermedad vascular periférica en pacientes con y sin aterosclerosis conocida. Los niveles de PCR-as se han dividido en terciles. Estos tertiles (<1,0 mg/L, 1 mg/L-3 mg/L, y >3 mg/L) se corresponden, respectivamente, con FRS de riesgo bajo, moderado y alto.8
El principal ensayo clínico más reciente que examina la utilidad de la PCR en la predicción del riesgo cardiovascular es el ensayo JUPITER.9 Este ensayo incluyó específicamente a pacientes sanos con colesterol normal (LDL <130 mg/dL) y un nivel elevado de PCR (>2 mg/dL). Estos pacientes fueron tratados con rosuvastatina 20 mg o con placebo para evaluar el criterio de valoración compuesto de IM posterior o ictus no mortal y el riesgo compuesto de IM, ictus y muerte por causas cardiovasculares. El estudio se interrumpió tras 1,9 años de seguimiento porque se comprobó que el tratamiento con rosuvastatina reducía el criterio de valoración compuesto en un 44% en comparación con el placebo. Este ha sido un estudio histórico porque demuestra que los pacientes sin factores de riesgo cardiovascular, aparte de la PCR elevada, obtuvieron un beneficio significativo del tratamiento con rosuvastatina; sin embargo, se desconoce la relación coste-eficacia del cribado de individuos sanos para detectar la PCR elevada y ampliar la prescripción de estatinas en estos casos.
Además de las estatinas, otros agentes hipolipemiantes (como la niacina, los fibratos y la ezetimiba), así como las tiazolidinedionas y el raloxifeno, han demostrado reducir los niveles de PCR. Actualmente se recomienda tener en cuenta los niveles de PCR-as en el proceso de toma de decisiones de tratamiento para los pacientes con un riesgo de ECV previsto en la FRS del 10% al 20% en los próximos 10 años, y evitar la medición rutinaria de la PCR-as en la población adulta general.7,8,10
El fibrinógeno también se ha estudiado como un predictor no tradicional del riesgo de ECV. En el estudio Coronary Artery Risk Development in Young Adults (CARDIA), un nivel elevado de fibrinógeno en sujetos de 25 a 37 años se asoció con un mayor riesgo de ECV subclínica en la siguiente década de vida del paciente.10 El fibrinógeno desempeña un papel importante en la agregación plaquetaria y la formación de fibrina, ambos componentes clave de la aterosclerosis y el desarrollo de trombos.1,11 Los pacientes del estudio CARDIA que tenían niveles elevados de fibrinógeno presentaban un mayor grosor de la íntima carotídea y calcificación de la arteria coronaria (CAC) en la década siguiente. Sin embargo, en este momento no se recomienda la medición rutinaria de los niveles de fibrinógeno.10
El CAC se desarrolla en las arterias coronarias ateroscleróticas y está prácticamente ausente en una pared vascular normal. Las puntuaciones de CAC más altas se asocian con una mayor especificidad, pero una menor sensibilidad, para la predicción del riesgo cardiovascular. Sin embargo, es importante tener en cuenta que, aunque las puntuaciones elevadas de CAC se correlacionan con un mayor riesgo de ECV, pueden producirse eventos cardiovasculares en un paciente con una puntuación de CAC de cero. El valor pronóstico de la medición del CAC ha sido muy debatido en la última década. Desde el año 2000, hay cada vez más pruebas de que el CAC puede predecir de forma independiente los resultados cardiovasculares, además de los factores de riesgo tradicionales. En 2007, el Comité de Redacción de la American College of Cardiology Foundation/American Heart Association publicó un documento de consenso sobre el uso del CAC en la evaluación global del riesgo cardiovascular.12 El consenso del comité fue desaconsejar el cribado de CAC no seleccionado, ya que tiene un valor clínico limitado para los pacientes con bajo riesgo de cardiopatía isquémica (FRS <1%/año). Al igual que con la hs-CR y el fibrinógeno, no se recomienda la medición rutinaria del CAC; sin embargo, las puntuaciones del CAC pueden ser una herramienta útil para modificar la predicción del riesgo y potencialmente alterar la terapia en pacientes asintomáticos de riesgo intermedio adecuadamente seleccionados.
La lipoproteína(a), o Lp(a), se identifica en las directrices del ATP III como un factor de riesgo emergente de ECV.2 Los lípidos se transportan por todo el cuerpo como complejos de lípidos y proteínas conocidos como lipoproteínas. Las lipoproteínas varían en tamaño y densidad y se denominan LDL, HDL y lipoproteínas de muy baja densidad (VLDL). Los componentes proteicos de estos complejos se denominan apolipoproteínas. La Lp(a), una forma modificada de LDL, consiste en una molécula de apoproteína(a), o apo(a), unida a la fracción de apolipoproteína B, o apo(b), de la partícula LDL tradicional. Es similar a las LDL tanto en su composición como en su densidad. Se cree que, dado que el componente apo(a) de la Lp(a) es estructuralmente similar al plasminógeno, puede competir con el plasminógeno en el organismo e inhibir así la fibrinólisis. Además, se especula que la Lp(a) favorece la acumulación de colesterol, el desarrollo de células espumosas y la propagación de las placas ateroscleróticas.1 Se ha demostrado que tanto la niacina como los estrógenos reducen eficazmente la Lp(a); sin embargo, ninguna estatina lo hace de forma efectiva.13,14 Los niveles elevados de Lp(a) se han asociado a un mayor riesgo de ECV en algunas poblaciones estudiadas, pero no en todas.15 En la actualidad, no hay pruebas de que el control o la reducción de los niveles de Lp(a) sea clínicamente útil, y no se recomienda su medición rutinaria.16
La apolipoproteína(b) es el principal componente proteico no sólo de las LDL, sino también de las LDL de densidad intermedia y las VLDL. Para la predicción del riesgo cardiovascular, se ha propuesto recientemente que la medición de los niveles de apo(b) y de colesterol no HDL es superior a la medición del colesterol LDL.17 En un análisis post-hoc de los estudios Treating to New Targets e IDEAL, se descubrió que el colesterol no HDL (el producto de restar el colesterol HDL de la medición del colesterol total) y la apo(b) estaban más estrechamente relacionados con los resultados cardiovasculares que el colesterol LDL.18,19 Se especula con la posibilidad de que las futuras directrices favorezcan el colesterol no HDL o la apo(b) en lugar del colesterol LDL como objetivo principal del tratamiento; sin embargo, en la actualidad, el LDL sigue siendo el objetivo principal del tratamiento del colesterol.
La hiperhomocisteinemia se ha relacionado de forma independiente con un mayor riesgo de ECV, aunque no está tan fuertemente asociada como la FRS, y se desconoce el mecanismo causal exacto.20 Los defectos en las vías del folato y la B12 pueden dar lugar a niveles elevados de homocisteína, al igual que las dietas deficientes en folato o vitaminas B6 y B12 y los medicamentos que interfieren en el metabolismo o la absorción de estas vitaminas.1 La insuficiencia renal y hepática también pueden elevar la homocisteína. Se cree que la hiperhomocisteinemia es bastante infrecuente. La población de edad avanzada puede tener un mayor riesgo de padecer esta afección, debido a la deficiencia de folato en la dieta. La medición de los niveles de homocisteína debe realizarse cuando el paciente está en estado de ayuno, y los niveles elevados motivan una evaluación de la etiología.
Por último, el análisis de la subfracción de lipoproteínas es otra herramienta potencial para una mayor estratificación del riesgo cardiovascular. Se sabe que la medición de LDL comprende un espectro de partículas de LDL que van desde las que son pequeñas y densas hasta las que son más ligeras y flotantes. Se ha observado que las partículas de LDL pequeñas y densas confieren un mayor riesgo cardiovascular.21 A medida que aumenta el LDL, aumentan las subfracciones de LDL pequeñas y densas. Del mismo modo, las mediciones de las HDL totales consisten en un espectro de partículas que varían en tamaño y densidad. Las moléculas de HDL más pequeñas y densas confieren un menor efecto cardioprotector. A medida que los niveles de HDL disminuyen, se produce un marcado aumento de las partículas pequeñas de HDL. Sobre la base de estos resultados, se ha sugerido que las LDL elevadas, las subfracciones pequeñas de LDL elevadas, las HDL bajas y las subfracciones grandes de HDL bajas son predictoras de ECV. Las directrices del ATP III reconocen que las partículas pequeñas de LDL se han identificado como un componente de la aterogénesis y que las mediciones de las subfracciones de HDL pueden contribuir a la evaluación del riesgo de ECV. Sin embargo, según las directrices, la capacidad de las subfracciones de LDL para predecir la ECV independientemente de otros factores de riesgo no está bien definida. Además, el ATP III señala que no se ha establecido la utilidad clínica de la medición de la subfracción de HDL. Debido a esto y al hecho de que aún no se han establecido puntos de corte significativos y reproducibles para el tamaño, la densidad y el número de las partículas, la medición de la subfracción de las lipoproteínas no se utiliza en el tratamiento rutinario de la hiperlipidemia ni en la estratificación del riesgo. Sin embargo, puede ser útil como complemento de la estratificación de riesgo tradicional para determinar la agresividad del tratamiento en un paciente de riesgo intermedio.
Conclusión
Aunque las directrices de tratamiento basadas en el ATP III, que se basan en gran medida en la FRS, siguen siendo el núcleo de las recomendaciones de tratamiento en la ECV, están surgiendo indicadores no tradicionales de la ECV como complementos para proporcionar una estratificación del riesgo más refinada y ayudar a la identificación de los pacientes con enfermedad subclínica temprana que pueden necesitar un tratamiento más temprano y agresivo.
Aún no se ha definido el papel preciso de los marcadores de riesgo de ECV no tradicionales en la determinación del riesgo cardiovascular futuro de una persona, ni las directrices para los niveles objetivo, ni las recomendaciones específicas sobre qué poblaciones deberían someterse a la medición rutinaria de estos marcadores. Ninguno de los marcadores no tradicionales de ECV se recomienda actualmente para el cribado rutinario; sin embargo, en los pacientes en los que la decisión de iniciar un tratamiento (especialmente la medicación) no está clara, la medición de estos factores de riesgo puede ser útil. En tales situaciones, la medición de los factores de riesgo no tradicionales, además de las herramientas tradicionales de predicción del riesgo de ECV, puede conferir un beneficio significativo.
1. Talbert RL. Hiperlipidemia. En: DiPiro JT, Talbert RL, Yee GC, et al, eds. Pharmacotherapy: A Pathophysiologic Approach. 7th ed. New York, NY: McGraw Hill Medical; 2008:385-407.
2. National Heart Lung and Blood Institute. Third report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). www.nhlbi.nih.gov/guidelines/cholesterol/. Consultado el 1 de noviembre de 2008.
3. Grundy SM, Cleeman JI, Merz CN, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation. 2004;110:227-239.
4. Brindle P, Beswick A, Fahey T, Ebrahim S. The accuracy and impact of risk assessment in the primary prevention of cardiovascular disease: a systematic review. Heart. 2006;92:1752-1759.
5. Myerburg RJ, Kessler KM, Castellanos A. Sudden cardiac death: epidemiology, transient risk, and intervention assessment. Ann Intern Med. 1993;119:1187-1197.
6. de Ferranti SD, Rifai N. C-reactive protein: un marcador sérico no tradicional de riesgo cardiovascular. Cardiovasc Pathol. 2007;16:14-21.
7. Koenig W, Sund M, Frölich M, et al. La proteína C reactiva, un marcador sensible de inflamación, predice el riesgo futuro de enfermedad coronaria en hombres de mediana edad inicialmente sanos: resultados del estudio de cohorte MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) de Augsburgo, 1984 a 1992. Circulation. 1999;99:237-242.
8. Pearson TA, Mensah GA, Alexander RW, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: a statement for health-care professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003;107:499-511.
9. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008;359:2195-2207.
10. Comité de enfermedades cardiovasculares y metabólicas. Evaluación del riesgo de enfermedad cardiovascular con factores de riesgo no tradicionales: la última evidencia. CMDManagement Insights Informat Cardiovasc Metabol Dis. 2008;13(2):1-3,6.
11. Mora S, Rifai N, Buring JE, Ridker PM. Valor aditivo de los niveles de fibrinógeno y proteína C reactiva de alta sensibilidad medidos por inmunoensayo para predecir eventos cardiovasculares incidentes. Circulation. 2006;114:381-387.
12. Greenland B, Bonow RO, Brundage BH, et al. ACCF/AHA 2007 Clinical Expert Consensus Document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain. A report of the American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography). J Am Coll Cardiol. 2007;49:378-402.
13. Angelin B. Therapy for lowering lipoprotein (a) levels. Curr Opin Lipidol. 1997;8:337-341.
14. Brown BG, Zhao XQ, Chait A, et al. Simvastatina y niacina, vitaminas antioxidantes, o la combinación para la prevención de la enfermedad coronaria. N Engl J Med. 2001;345:1583-1592.
15. Moliterno D, Jokinen EV, Miserez AR, et al. No association between plasma lipoprotein(a) concentrations and the presence or absence of coronary atherosclerosis in African-Americans. Arterioscler Thromb Vasc Biol. 1995;15:850-855.
16. Bennet A, Di Angelantonio E, Erqou S, et al. Niveles de lipoproteína(a) y riesgo de enfermedad coronaria futura: datos prospectivos a gran escala. Arch Intern Med. 2008;168:598-608.
17. Kastelein JJ, van der Steeg WA, Holme I, et al. Lípidos, apolipoproteínas y sus ratios en relación con los eventos cardiovasculares con el tratamiento con estatinas. Circulation. 2008;117:3002-3009.
18. LaRosa JC, Grundy SM, Waters DD, et al. Reducción intensiva de lípidos con atorvastatina en pacientes con enfermedad coronaria estable. N Engl J Med. 2005;352:1425-1435.
19. Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA. 2005;294:2437-2445.
20. Wald DS, Law M, Morris JK. Homocysteine and cardiovascular disease: evidence on causality from a meta-analysis. BMJ. 2002;325:1202-1206.
21. Rizzo M, Berneis K. Tamaño de las lipoproteínas de baja densidad y evaluación del riesgo cardiovascular. QJM.2006;99:1-14.