US Pharm. 2009;34(2):25-27.
Kardiovaskulær sygdom (CVD), der er den førende dødsårsag på verdensplan, involverer mekanismer, som endnu ikke er fuldt ud forstået. Plasmalipider er biologisk nødvendige for syntese af cellemembraner og hormonproduktion og er en kilde til frie fedtsyrer, men dyslipidæmi har længe været forbundet med øget forekomst af CVD, slagtilfælde og perifer arteriel sygdom.1
Traditionel risikostratificering
Den nuværende behandlingstilgang for dyslipidæmi er specificeret i National Cholesterol Education Program Adult Treatment Panel (ATP) III.2 I ATP III udledes risikofaktorer og efterfølgende risikostratificering ved at beregne en såkaldt Framingham-risikoscore (FRS), som i årtier har været anvendt til at forudsige CVD-risiko. ATP III indeholder anbefalinger om risikostratificering i forhold til flere risikofaktorer, diabetes og metabolisk syndrom. Risikofaktorer for koronar hjertesygdom (CHD) omfatter forhøjet blodtryk (blodtryk ≥140/90 eller brug af antihypertensiva); familiehistorie (førstegradsslægtning med CHD ); alder (mænd ≥45 år; kvinder ≥55 år); lipoproteinniveau med høj densitet (HDL) på over 40 mg/dL; og rygning. Et HDL-niveau på over 50 mg/dL er identificeret som værende kardiobeskyttende og betragtes derfor som en “negativ” risikofaktor. Ud over at opregne specifikke CHD-risikofaktorer identificerer ATP III CHD-risikoækvivalenter (forhold, der giver en lignende risiko for en CHD-hændelse). KOL-risikoækvivalenter omfatter carotisarteriesygdom, abdominalt aortaaneurisme, perifer arteriel sygdom, diabetes mellitus eller en 10-årsrisiko for myokardieinfarkt (MI) på mindst 20 % (dvs. FRS ≥20 %).1,2
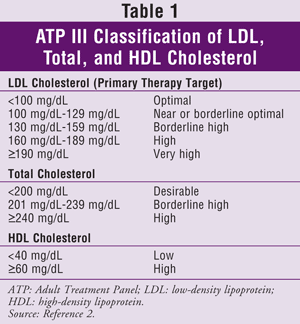
ATP III angiver low-density lipoprotein (LDL) som det primære mål for kolesterolbehandling. Opnåelse af målniveauerne for triglycerid (TG) og HDL anses generelt for at være et sekundært mål. Kolesterolmål for den generelle befolkning er angivet i TABEL 1.2
En opdatering af ATP III blev offentliggjort i 2004.3 Denne version indeholder en anbefaling om en 30-40 % reduktion i forhold til baseline-LDL hos patienter, der anses for at have moderat eller høj risiko for KOL, og retningslinjer, hvorefter en patient anses for at have meget høj risiko. Patienter med meget høj risiko kan omfatte patienter med konstateret CVD plus en eller flere af følgende: flere store risikofaktorer (f.eks. diabetes); alvorlige og dårligt kontrollerede risikofaktorer (f.eks, rygning, ukontrolleret hypertension); flere komponenter af metabolisk syndrom (TABEL 2); eller akut koronarsyndrom.

Af ATP III-opdateringen foreslås det også, at lipidsænkende medicin og et LDL-mål på mindre end 100 mg/dL overvejes for visse patienter.3 Disse patienter bør have en 10-årig KOL-risiko på 10-20 % og et LDL-niveau mellem 100 mg/dL og 130 mg/dL. De skal også være i en fremskreden alder og have alvorlige risikofaktorer; TG-niveau 200 mg/dL eller derover, non-HDL-niveau 160 mg/dL eller derover og HDL-niveau 40 mg/dL eller mindre; metabolisk syndrom; eller nye risikofaktorer såsom højfølsomt C-reaktivt protein (hs-CRP) (<3 mg/dL) eller koronar calcium større end den 75. percentil for en persons alder og køn.
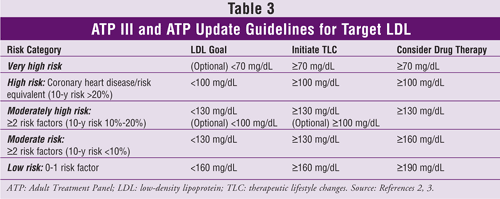
Mål-LDL-niveauer, anbefalinger om terapeutiske livsstilsændringer og oplysninger om iværksættelse af kolesterolsænkende medicin (baseret på antallet af KOL-risikofaktorer eller ækvivalenter) fra ATP III og opdateringen heraf findes i TABEL 3.2,3
Utraditionelle risikomarkører
Traditionel forudsigelse af CVD-risiko er i høj grad baseret på FRS. Der er imidlertid begrænsninger ved denne tilgang, da FRS er blevet bemærket til at overvurdere risikoen i lavrisikopopopulationer og undervurdere risikoen i højrisikopopulationer.4 Faktisk forekommer pludselig død og ikke-dødelig MI uden forudgående symptomer hos op til 25 % af patienter med CHD.5 Som tidligere nævnt anbefales det i ATP III-opdateringen at overveje mere aggressiv lipidbehandling hos patienter med nye risikofaktorer.3 I det seneste årti har forskningen fokuseret på den rolle, som ikke-traditionelle risikofaktorer spiller i patofysiologien ved CVD. Fibrinogen, hs-CRP, koronar calcium og analyse af lipoproteinsubfraktioner har været genstand for megen forskning.
Og selv om flere inflammationsmarkører er blevet forbundet med CVD, er kun de markører, der let kan måles, af praktisk værdi.6 En sådan inflammationsmarkør er hs-CRP.7 Forhøjet hs-CRP er blevet forbundet med en øget risiko for CVD, slagtilfælde og perifer vaskulær sygdom hos patienter med og uden kendt åreforkalkning. Niveauerne af hs-CRP er blevet inddelt i tertiler. Disse tertiler (<1,0 mg/L, 1 mg/L-3 mg/L og >3 mg/L) svarer henholdsvis til FRS med lav, moderat og høj risiko.8
Det seneste større kliniske forsøg, der undersøger nytten af CRP til at forudsige kardiovaskulær risiko, er JUPITER-forsøget.9 Dette forsøg omfattede specifikt raske patienter med normalt kolesterol (LDL <130 mg/dL) og et forhøjet CRP-niveau (>2 mg/dL). Disse patienter blev behandlet med rosuvastatin 20 mg eller placebo for at evaluere det sammensatte endepunkt af efterfølgende MI eller ikke-dødeligt slagtilfælde og den sammensatte risiko for MI, slagtilfælde og død af kardiovaskulære årsager. Undersøgelsen blev stoppet efter 1,9 års opfølgning, fordi behandlingen med rosuvastatin viste sig at reducere det sammensatte endepunkt med 44 % sammenlignet med placebo. Dette har været en skelsættende undersøgelse, fordi den viser, at patienter uden andre kardiovaskulære risikofaktorer end forhøjet CRP opnåede en betydelig fordel af rosuvastatinbehandling; omkostningseffektiviteten ved at screene raske personer for forhøjet CRP og udvide ordinationen af statiner i sådanne tilfælde er imidlertid ukendt.
Bortset fra statiner er andre lipidsænkende midler (såsom niacin, fibrater og ezetimib) samt thiazolidinedioner og raloxifen blevet vist at reducere CRP-niveauet. Det anbefales i øjeblikket at overveje hs-CRP-niveauer i behandlingsbeslutningsprocessen for patienter med en FRS-prædikteret CVD-risiko på 10-20 % inden for de næste 10 år og at undgå rutinemæssig måling af hs-CRP i den almindelige voksne befolkning.7,8,10
Fibrinogen er også blevet undersøgt som en ikke-traditionel prædiktor for CVD-risiko. I CARDIA-undersøgelsen (Coronary Artery Risk Development in Young Adults) var et forhøjet fibrinogenniveau hos personer i alderen 25 til 37 år forbundet med en øget risiko for subklinisk CVD i patientens efterfølgende tiår.10 Fibrinogen spiller en vigtig rolle i trombocytaggregation og fibrindannelse, som begge er nøglekomponenter i åreforkalkning og trombusudvikling.1,11 Patienter i CARDIA-undersøgelsen, der havde forhøjede fibrinogenniveauer, viste sig at have øget carotis intimal tykkelse og koronararterieforkalkning (CAC) i det efterfølgende årti. På nuværende tidspunkt anbefales det dog ikke at foretage rutinemæssig måling af fibrinogenniveauet.10
CAC udvikles i aterosklerotiske kranspulsårer og er stort set fraværende i en normal karvæg. Højere CAC-scoringer er forbundet med øget specificitet, men nedsat følsomhed, med hensyn til forudsigelse af kardiovaskulær risiko. Det er imidlertid vigtigt at bemærke, at selv om forhøjede CAC-scoringer korrelerer med en øget risiko for CVD, kan der stadig forekomme kardiovaskulære hændelser hos en patient med en CAC-score på nul. Den prognostiske værdi af CAC-måling har været meget omdiskuteret i det seneste årti. Siden 2000 er der kommet flere og flere beviser for, at CAC kan være uafhængigt forudsigende for kardiovaskulært udfald ud over de traditionelle risikofaktorer. I 2007 offentliggjorde American College of Cardiology Foundation/American Heart Association Writing Committee et konsensusdokument vedrørende brugen af CAC i den globale kardiovaskulære risikovurdering.12 Komitéens konsensus var at fraråde uselekteret CAC-screening, da den har begrænset klinisk værdi for patienter med lav risiko for CHD (FRS <1%/år). Som med hs-CR og fibrinogen anbefales rutinemæssig måling af CAC ikke; CAC-scoringer kan dog være et nyttigt redskab til at ændre risikoprædiktion og potentielt ændre behandlingen for passende udvalgte asymptomatiske patienter med intermediær risiko.
Lipoprotein(a), eller Lp(a), identificeres i ATP III-retningslinjerne som en ny CVD-risikofaktor.2 Lipider transporteres i hele kroppen som lipid- og proteinkomplekser, kendt som lipoproteiner. Lipoproteiner varierer i størrelse og tæthed og betegnes i overensstemmelse hermed som LDL, HDL og lipoprotein med meget lav tæthed (VLDL). Proteinkomponenterne i disse komplekser betegnes som apolipoproteiner. Lp(a), en modificeret form af LDL, består af et apoprotein(a)-molekyle eller apo(a)-molekyle, der er knyttet til apolipoprotein B-delen eller apo(b)-delen af den traditionelle LDL-partikel. Den ligner LDL både med hensyn til sammensætning og densitet. Man mener, at da apo(a)-komponenten af Lp(a) strukturelt ligner plasminogen, kan den konkurrere med plasminogen i kroppen og dermed hæmme fibrinolysen. Desuden formodes Lp(a) at fremme ophobning af kolesterol, udvikling af skumceller og udbredelse af aterosklerotiske plaques.1 Både niacin og østrogen har vist sig at sænke Lp(a) effektivt, men ingen statiner gør det effektivt.13,14 Forhøjede niveauer af Lp(a) har været forbundet med en øget CVD-risiko i nogle, men ikke alle undersøgte populationer.15 På nuværende tidspunkt er der ingen dokumentation for, at overvågning eller sænkning af Lp(a)-niveauer er klinisk nyttigt, og rutinemæssig måling anbefales ikke.16
Apolipoprotein(b) er den vigtigste proteinkomponent i ikke kun LDL, men også LDL med intermediær tæthed og VLDL. Med henblik på forudsigelse af kardiovaskulær risiko er det for nylig blevet foreslået, at måling af apo(b)- og non-HDL-kolesterolniveauerne er bedre end måling af LDL-kolesterol.17 I en post-hoc-analyse af Treating to New Targets- og IDEAL-undersøgelserne blev det konstateret, at non-HDL-kolesterol (produktet af subtraktion af HDL-kolesterol fra den samlede kolesterolmåling) og apo(b) var tættere forbundet med kardiovaskulære resultater end LDL-kolesterol.18,19 Der spekuleres i, at fremtidige retningslinjer kan favorisere non-HDL-kolesterol eller apo(b) i stedet for LDL-kolesterol som det primære behandlingsmål; i øjeblikket er LDL dog fortsat det primære mål for kolesterolbehandling.
Hyperhomocysteinæmi er blevet uafhængigt forbundet med en øget risiko for CVD, selv om den ikke er så stærkt forbundet som FRS, og den nøjagtige årsagsmekanisme er ukendt.20 Defekter i folat- og B12-veje kan resultere i forhøjede homocysteinniveauer, ligesom diæter med mangel på folat eller vitamin B6 og B12 og medicin, der forstyrrer metabolismen eller absorptionen af disse vitaminer.1 Nyre- og leversvigt kan også forhøje homocysteinniveauet. Hyperhomocysteinæmi menes at være ret ualmindeligt. Den ældre befolkning kan være i øget risiko for denne tilstand på grund af folatmangel i kosten. Måling af homocysteinniveauet bør foretages, når patienten er i fastende tilstand, idet forhøjede niveauer skal foranledige en evaluering af ætiologien.
Endeligt er lipoproteinsubfraktionsanalyse et andet potentielt redskab til yderligere kardiovaskulær risikostratificering. Det er kendt, at LDL-måling omfatter et spektrum af LDL-partikler, der spænder fra dem, der er små og tætte, til dem, der er lettere og mere svævende. Små, tætte LDL-partikler er kendt for at give en højere kardiovaskulær risiko.21 Efterhånden som LDL stiger, øges de små, tætte LDL-subfraktioner. På samme måde består de samlede HDL-målinger af et spektrum af partikler, der varierer i størrelse og tæthed. Mindre, tættere HDL-molekyler giver mindre kardiobeskyttende effekt. Når HDL-niveauet falder, sker der en markant stigning i små HDL-partikler. På baggrund af disse resultater er det blevet foreslået, at forhøjet LDL, forhøjede små LDL-subfraktioner, lav HDL-værdi og lave, store HDL-subfraktioner er forudsigelige for CVD. I ATP III-retningslinjerne anerkendes det, at små LDL-partikler er blevet identificeret som en del af aterogenesen, og at målinger af HDL-subfraktionerne kan bidrage til vurdering af CVD-risikoen. Ifølge retningslinjerne er LDL-subfraktionernes evne til at forudsige CVD uafhængigt af andre risikofaktorer imidlertid ikke veldefineret. Endvidere påpeger ATP III, at den kliniske nytte af måling af HDL-subfraktioner ikke er blevet fastslået. På grund af dette og det forhold, at der endnu ikke er fastlagt meningsfulde og reproducerbare grænseværdier for partikelstørrelse, -densitet og -antal, anvendes måling af lipoproteinsubfraktioner ikke i den rutinemæssige behandling af hyperlipidæmi eller i risikostratificering. Den kan dog være nyttig som et supplement til traditionel risikostratificering for at bestemme behandlingsaggressivitet hos en patient med intermediær risiko.
Slutning
Og selv om ATP III-baserede behandlingsretningslinjer, som i høj grad er baseret på FRS, fortsat er kernen i behandlingsanbefalingerne for CVD, er der ved at opstå ikke-traditionelle indikatorer for CVD som supplementer til at give en mere raffineret risikostratificering og hjælpe med at identificere patienter med tidlig subklinisk sygdom, som kan have behov for tidligere og mere aggressiv behandling.
Den præcise rolle, som ikke-traditionelle CVD-risikomarkører spiller ved bestemmelse af en persons fremtidige kardiovaskulære risiko, retningslinjer for målniveauer og specifikke anbefalinger med hensyn til, hvilke befolkningsgrupper der bør have disse markører rutinemæssigt målt, er endnu ikke afgrænset. Ingen af de ikke-traditionelle CVD-markører anbefales i øjeblikket til rutinemæssig screening; hos patienter, for hvem beslutningen om at iværksætte behandling (især medicinering) er uklar, kan måling af disse risikofaktorer imidlertid være nyttig. I sådanne situationer kan måling af ikke-traditionelle risikofaktorer ud over de traditionelle CVD-risikoforudsigelsesværktøjer give en betydelig fordel.
1. Talbert RL. Hyperlipidæmi. In: DiPiro JT, Talbert RL, Talbert RL, Yee GC, et al, eds. Farmakoterapi: A Pathophysiologic Approach. 7th ed. New York, NY: McGraw Hill Medical; 2008:385-407.
2. National Heart Lung and Blood Institute. Tredje rapport fra ekspertpanelet om påvisning, evaluering og behandling af højt kolesterolindhold i blodet hos voksne (Adult Treatment Panel III). www.nhlbi.nih.gov/guidelines/cholesterol/. Tilgået den 1. november 2008.
3. Grundy SM, Cleeman JI, Merz CN, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines (implikationer af nylige kliniske forsøg for retningslinjerne fra National Cholesterol Education Program Adult Treatment Panel III). Circulation. 2004;110;110:227-239.
4. Brindle P, Beswick A, Fahey T, Ebrahim S. The accuracy and impact of risk assessment in the primary prevention of cardiovascular disease: a systematic review. Heart. 2006;92:1752-1759.
5. Myerburg RJ, Kessler KM, Castellanos A. Sudden cardiac death: epidemiology, transient risk, and intervention assessment (pludselig hjertedød: epidemiologi, forbigående risiko og interventionsvurdering). Ann Intern Med. 1993;119:1187-1197.
6. de Ferranti SD, Rifai N. C-reaktivt protein: en ikke-traditionel serummarkør for kardiovaskulær risiko. Cardiovasc Pathol. 2007;16:14-21.
7. Koenig W, Sund M, Frölich M, et al. C-reaktivt protein, en følsom markør for inflammation, forudsiger fremtidig risiko for koronar hjertesygdom hos oprindeligt raske mænd i den midaldrende alder: resultater fra MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburg Cohort Study, 1984 til 1992. Circulation. 1999;99:237-242.
8. Pearson TA, Mensah GA, Alexander RW, et al. Markører for inflammation og hjerte-kar-sygdomme: anvendelse i klinisk og folkesundhedsmæssig praksis: en erklæring til sundhedspersonale fra Centers for Disease Control and Prevention og American Heart Association. Circulation. 2003;107:499-511.
9. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin til forebyggelse af vaskulære hændelser hos mænd og kvinder med forhøjet C-reaktivt protein. N Engl J Med. 2008;359:2195-2207.
10. Udvalget for Kardiovaskulære og Metaboliske Sygdomme. Vurdering af risikoen for hjerte-kar-sygdomme ved hjælp af ikke-traditionelle risikofaktorer: den seneste dokumentation. CMDManagement Insights Informat Cardiovasc Metabol Dis. 2008;13(2):1-3,6.
11. Mora S, Rifai N, Buring JE, Ridker PM. Additiv værdi af immunoassay-målte fibrinogen- og højfølsomme C-reaktive proteinniveauer til forudsigelse af kardiovaskulære hændelser. Circulation. 2006;114:381-387.
12. Greenland B, Bonow RO, Brundage BH, et al. ACCF/AHA 2007 Clinical Expert Consensus Document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain. En rapport fra American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography). J Am Coll Cardiol. 2007;49:378-402.
13. Angelin B. Terapi til sænkning af lipoprotein (a)-niveauet. Curr Opin Lipidol. 1997;8:337-341.
14. Brown BG, Zhao XQ, Chait A, et al. Simvastatin og niacin, antioxidantvitaminer eller kombinationen til forebyggelse af koronarsygdomme. N Engl J Med. 2001;345:1583-1592.
15. Moliterno D, Jokinen EV, Miserez AR, et al. Ingen sammenhæng mellem plasma lipoprotein(a)-koncentrationer og tilstedeværelse eller fravær af koronar åreforkalkning hos afroamerikanere. Arterioscler Thromb Vasc Biol. 1995;15:850-855.
16. Bennet A, Di Angelantonio E, Erqou S, et al. Lipoprotein(a)-niveauer og risiko for fremtidig koronar hjertesygdom: prospektive data i stor skala. Arch Intern Med. 2008;168:598-608.
17. Kastelein JJ, van der Steeg WA, Holme I, et al. Lipider, apolipoproteiner og deres forhold i relation til kardiovaskulære hændelser ved statinbehandling. Circulation. 2008;117:3002-3009.
18. LaRosa JC, Grundy SM, Waters DD, et al. Intensiv lipidsænkning med atorvastatin hos patienter med stabil koronarsygdom. N Engl J Med. 2005;352:1425-1435.
19. Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA. 2005;294:2437-2445.
20. Wald DS, Law M, Morris JK. Homocystein og kardiovaskulær sygdom: beviser for kausalitet fra en metaanalyse. BMJ. 2002;325:1202-1206.
21. Rizzo M, Berneis K. Low-density lipoprotein størrelse og vurdering af kardiovaskulær risiko. QJM.2006;99:1-14.