Instabilidad estructural de las enzimas
El hecho de que los sitios activos estén tan bien adaptados para proporcionar condiciones ambientales específicas también significa que están sujetos a las influencias del entorno local. Es cierto que el aumento de la temperatura ambiental generalmente aumenta las tasas de reacción, catalizada por enzimas o de otro tipo. Sin embargo, el aumento o la disminución de la temperatura fuera de un rango óptimo puede afectar a los enlaces químicos dentro del sitio activo de tal manera que sean menos adecuados para unir sustratos. Las altas temperaturas acaban provocando la desnaturalización de las enzimas, al igual que otras moléculas biológicas, un proceso que cambia las propiedades naturales de una sustancia. Asimismo, el pH del entorno local también puede afectar a la función de las enzimas. Los residuos de aminoácidos del sitio activo tienen sus propias propiedades ácidas o básicas que son óptimas para la catálisis. Estos residuos son sensibles a los cambios de pH que pueden perjudicar la forma en que se unen las moléculas de sustrato. Las enzimas son adecuadas para funcionar mejor dentro de un determinado rango de pH y, al igual que ocurre con la temperatura, los valores extremos de pH (ácidos o básicos) del entorno pueden provocar la desnaturalización de las enzimas.
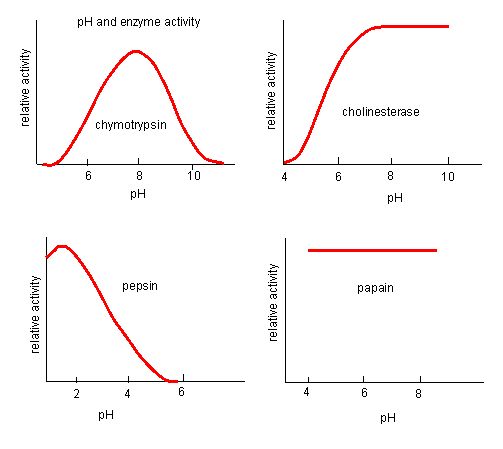
Figura 4. Las enzimas tienen un pH óptimo. El pH al que la enzima es más activa será el pH en el que los grupos R del sitio activo están protonados/desprotonados de forma que el sustrato puede entrar en el sitio activo y puede comenzar el paso inicial de la reacción. Algunas enzimas necesitan un pH muy bajo (ácido) para ser completamente activas. En el cuerpo humano, lo más probable es que estas enzimas se localicen en la parte inferior del estómago, o que se localicen en los lisosomas (un orgánulo celular que se utiliza para digerir grandes compuestos dentro de la célula).
Fuente: http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
El proceso en el que las enzimas se desnaturalizan suele comenzar con el desenrollamiento de la estructura terciaria a través de la desestabilización de los enlaces que mantienen unida la estructura terciaria. Los enlaces de hidrógeno, los enlaces iónicos y los enlaces covalentes (puentes disulfuro y enlaces peptídicos) pueden ser interrumpidos por grandes cambios de temperatura y pH. Utilizando la tabla de actividad enzimática y temperatura que aparece a continuación, haz una historia energética de la enzima roja. Explique lo que podría ocurrir de 37 °C a 95 °C.
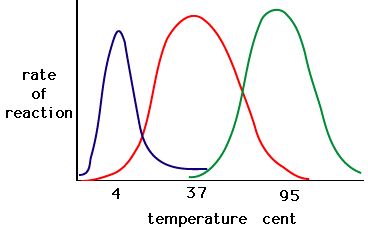
Figura 5. Las enzimas tienen una temperatura óptima. La temperatura a la que la enzima es más activa será normalmente la temperatura en la que la estructura de la enzima es estable o no se ve comprometida. Algunas enzimas requieren una temperatura específica para permanecer activas y no desnaturalizarse. Fuente: http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Ajuste inducido y función de la enzima
Durante muchos años, los científicos pensaron que la unión de la enzima al sustrato tenía lugar de una forma simple de «cierre y llave». Este modelo afirmaba que la enzima y el sustrato encajaban perfectamente en un paso instantáneo. Sin embargo, las investigaciones actuales apoyan una visión más refinada denominada ajuste inducido. El modelo de ajuste inducido amplía el modelo de bloqueo y llave al describir una interacción más dinámica entre la enzima y el sustrato. Cuando la enzima y el sustrato se juntan, su interacción provoca un ligero cambio en la estructura de la enzima que confirma una disposición de unión más productiva entre la enzima y el estado de transición del sustrato. Esta unión energéticamente favorable maximiza la capacidad de la enzima para catalizar su reacción.
Cuando una enzima se une a su sustrato, se forma un complejo enzima-sustrato. Este complejo reduce la energía de activación de la reacción y promueve su rápida progresión de muchas maneras. En un nivel básico, las enzimas promueven las reacciones químicas que implican a más de un sustrato al reunir los sustratos en una orientación óptima. La región adecuada (átomos y enlaces) de una molécula se yuxtapone a la región adecuada de la otra molécula con la que debe reaccionar. Otra forma en la que las enzimas promueven la reacción de sus sustratos es creando un entorno energéticamente favorable dentro del sitio activo para que se produzca la reacción. Algunas reacciones químicas pueden desarrollarse mejor en un entorno ligeramente ácido o no polar. Las propiedades químicas que surgen de la disposición particular de los residuos de aminoácidos dentro de un sitio activo crean el entorno energéticamente favorable para que los sustratos específicos de una enzima reaccionen.
La energía de activación requerida para muchas reacciones incluye la energía involucrada en la ligera contorsión de los enlaces químicos para que puedan reaccionar más fácilmente. La acción enzimática puede ayudar a este proceso. El complejo enzima-sustrato puede reducir la energía de activación contorneando las moléculas del sustrato de forma que se facilite la ruptura del enlace. Por último, las enzimas también pueden reducir las energías de activación participando en la propia reacción química. Los residuos de aminoácidos pueden proporcionar ciertos iones o grupos químicos que realmente forman enlaces covalentes con las moléculas de sustrato como un paso necesario del proceso de reacción. En estos casos, es importante recordar que la enzima siempre volverá a su estado original al finalizar la reacción. Una de las propiedades distintivas de las enzimas es que, en última instancia, no cambian las reacciones que catalizan. Una vez que una enzima termina de catalizar una reacción, libera su(s) producto(s).
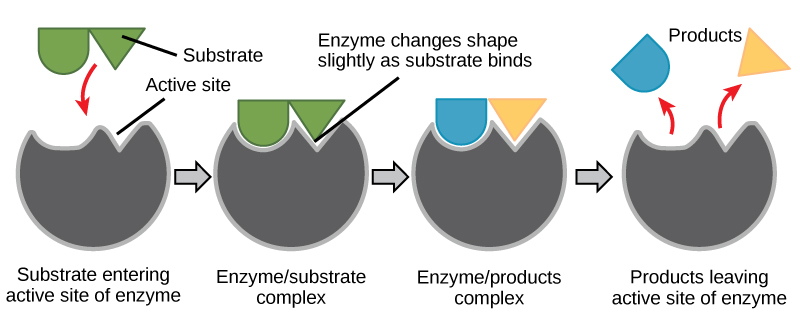
Figura 6. Según el modelo de ajuste inducido, tanto la enzima como el sustrato sufren cambios conformacionales dinámicos al unirse. La enzima contorsiona el sustrato en su estado de transición, aumentando así la velocidad de la reacción.
Creación de una historia energética para la reacción anterior
Usando la figura 6, responda a las preguntas planteadas en la historia energética.
1. ¿Cuáles son los reactivos? ¿Cuáles son los productos?
2. ¿Qué trabajo realizó la enzima?
3. ¿En qué estado se encuentra la energía inicialmente? ¿En qué estado se transforma la energía en el estado final? Esta puede ser difícil todavía, pero trata de identificar dónde está la energía en el estado inicial y en el estado final.