Habiendo establecido la existencia del núcleo, ahora puedes considerar la evidencia experimental de su tamaño, empezando por el experimento de Rutherford.
Resumen de la lección
- Discusión y ejemplo trabajado: Tamaño del núcleo (15 minutos)
- Discusión: Tamaño del átomo y del núcleo (10 minutos)
- Preguntas de los alumnos: Fuerzas y aproximación (30 minutos)
- Discusión: El número atómico y la carga de un núcleo (5 minutos)
- Discusión: Límite superior del tamaño nuclear (30 minutos)
- Discusión: Un acertijo para una futura lección (5 minutos)
Discusión y ejemplo trabajado: Tamaño del núcleo
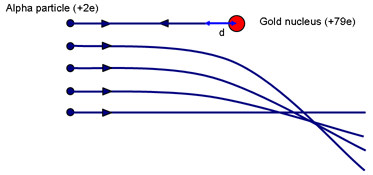
Puedes hacerte una idea del posible tamaño del núcleo pensando en el experimento de Rutherford. Pregunta: ¿Qué parámetro de impacto hará que una partícula se acerque más al núcleo? (Una colisión frontal con p = 0.)
El principio de la conservación de la energía se utiliza para calcular la distancia de máxima aproximación como medida del tamaño de un núcleo. La comprensión del cálculo que sigue depende de si los alumnos han cubierto el potencial eléctrico y los campos. Alternativamente, sirve como un buen repaso.
Episodio 522-1: Dispersión de partículas alfa – distancia de máxima aproximación (Word, 29 KB)
Episodio 522-2: Distancia de máxima aproximación (Word, 107 KB)
Cuando el α es llevado momentáneamente al reposo (habiendo subido todo lo que puede por la colina electrostática) se habrá realizado trabajo contra la fuerza de repulsión del núcleo. La energía cinética del α se almacena en el campo alrededor del núcleo. Cuando la velocidad es cero, toda la energía está ahora almacenada en el campo.
Si el α se detiene momentáneamente cuando está a una distancia d del (centro del) núcleo de carga Ze, la energía en el campo es:
Eα = 14πε0 2e Zed
Esto es igual a la energía cinética inicial de la partícula α. Rutherford utilizó una fuente de α que le dio Madame Curie. La energía α era de ~ 7,7 MeV.
Para el oro, Z = 79. Al resolverlo se obtiene d ~ 3 × 10-14 m. Compárese con el diámetro de los átomos de oro ~ 3 × 10-10 m. Por tanto, un núcleo es al menos 10 000 veces más pequeño que un átomo. Es importante destacar que este cálculo da un límite superior del tamaño del núcleo de oro; no podemos decir que la partícula alfa toque el núcleo; una α más energética podría acercarse aún más.
Un átomo está mayoritariamente vacío (por lo que la mayor parte de las α lo atraviesan directamente – cualquier electrón apenas impediría la α relativamente masiva de alta velocidad).
Discusión: Tamaño del átomo y del núcleo
Pida a sus alumnos que propongan un modelo a escala del átomo nuclear. Por ejemplo: si un núcleo tuviera 1 mm de diámetro, un átomo sería 10 000 veces mayor o 10 m de diámetro. Elija una posición adecuada para un núcleo de 1 mm (un pequeño rodamiento o una bola de Blu-tac). Desplázate 5 m (cinco grandes pasos) hasta el borde del átomo donde están los electrones. Nota: los diagramas de los libros de texto de un átomo con un núcleo no están dibujados a escala.
Refuerza una imagen precisa haciendo que un alumno se ponga de pie como un núcleo, calcule su circunferencia (¿40 cm?) y pregunte dónde tendría que ponerse otro alumno para estar en el borde del átomo. 104 × 40 cm = 4000 m}, por lo que el radio de este átomo es de 2 km. Compruebe con un mapa local para encontrar un lugar con nombre que los alumnos reconozcan que está a 2 km de distancia.
Refuerzo adicional: en un sólido en el que los átomos están muy empaquetados, la distancia entre los núcleos adyacentes ~ el tamaño de un átomo, es decir, ¡equivale a que dos alumnos se coloquen a 4 km de distancia!
Así que es bastante sorprendente que alguno golpee un núcleo. Ambos tienen un tamaño similar. Área transversal presentada por un núcleo ~radio2, por lo que ~1 × 10-28 m2}.
Pregunte: ¿Cómo esperaría que el número de reflejados como dependiera del grosor de la lámina metálica que contiene los núcleos objetivo? (Imagine los átomos de oro en capas, la posibilidad de una desviación aumenta con el grosor, pero la absorción al entrar o salir de la lámina cada vez más gruesa acabará impidiendo que siga aumentando el número reflejado y detectado.
Es de gran ayuda que sus alumnos puedan recordar los siguientes órdenes de magnitud:
Radio del núcleo atómico ~ 10 -14m
Radio del átomo ~ 10 -10m
Preguntas de los alumnos: Fuerzas y aproximación más cercana
Episodio 522-3: Dispersión de Rutherford: Direcciones de las fuerzas (Word, 82 KB)
Episodio 522-4: Dispersión de Rutherford: Energía y aproximación más cercana (Word, 83 KB)
Discusión: El número atómico y la carga de un núcleo
Rutherford utilizó sus datos para encontrar la carga del núcleo del blanco de oro. Otros experimentos para encontrar la carga de las láminas de Cu, Ag y Pt dieron:
| Número atómico | Un experimento de dispersión | |
| Cu | 29 | 29.3 × e |
| Ag | 47 | 46.3 × e |
| PT | 78 | 77,4 × e |
Así pues, la carga eléctrica de un núcleo viene dada por el número atómico × e, es decir, Z e. Con una excepción (hidrógeno, H-1), Z es siempre menor que el número de masa atómica. Entonces, ¿qué explica la diferencia? El átomo debe ser eléctricamente neutro. Rutherford propuso el neutrón.
Discusión: Límite superior del tamaño nuclear
Recuerda que el análisis de Rutherford da un límite superior del tamaño en el núcleo (d ~ 1 α energía de la partícula). El tamaño que mide depende de la energía de la partícula α que utiliza. Así que necesitamos otro enfoque para encontrar el tamaño de un núcleo de oro. ¿Se te ocurre una partícula mejor para sondear el tamaño de un núcleo? (El neutrón – al no tener carga se acercará más.)
Otra técnica es la dispersión inelástica profunda de electrones. Vuelve a consultar si ya has cubierto la naturaleza ondulatoria de las partículas (ondas de Broglie λ = hp), o este tema puede insertarse aquí si se desea. El aparato de difracción de electrones tiene una similitud básica con la dispersión de partículas. Los electrones se disparan sobre una película fina – en este caso de grafito.
Rutherford tuvo la suerte de que la longitud de onda de de Broglie de las partículas α (desconocida para él) era bastante pequeña, y la repulsión coulombiana se detiene al acercarse demasiado – ¡de lo contrario los efectos de difracción habrían confundido los datos! (Prueba el cálculo si ya has cubierto λ = hp.)
Episodio 506-2: Interpretación de los patrones de difracción de electrones (Word, 30 KB)
Episodio 522-5: Dispersión inelástica profunda (Word, 56 KB)
Episodio 522-6: Los electrones miden el tamaño de los núcleos (Word, 42 KB)
Discusión: Un enigma para una futura lección
Hay un problema fundamental con el modelo de Rutherford. Pregunte a su clase: ¿Cómo puede un átomo con un núcleo central ser estable – por qué no se colapsa? Según la electrodinámica clásica, los electrones deberían emitir radiación al orbitar y entrar en espiral.
(Es bueno dejar una clase con un enigma para una futura lección.)