US Pharm. 2009;34(2):25-27.
Sydän- ja verisuonisairauksiin (CVD), maailman johtavaan kuolinsyyhyn, liittyy mekanismeja, joita ei ole vielä täysin ymmärretty. Vaikka plasman lipidit ovat biologisesti välttämättömiä solukalvosynteesille ja hormonituotannolle ja ovat vapaiden rasvahappojen lähde, dyslipidemiat on jo pitkään yhdistetty lisääntyneeseen CVD:n, aivohalvauksen ja perifeerisen valtimotaudin esiintyvyyteen.1
Traditionaalinen riskistratifiointi
Nykyinen dyslipidemian hoitokäytäntö on määritelty kansallisessa kolesterolikoulutusohjelmassa (National Cholesterol Education Program Adult Treatment Panel, ATP) III.2 ATP III:ssa riskitekijät ja sitä seuraava riskistratifiointi johdetaan laskemalla niin sanottu Framinghamin riskipistemäärä (Framingham-riskipistemäärä, Framingham-riskipistemäärä, FRS-riskipistemäärä), jota on käytetty vuosikymmenien ajan sydän- ja verisuonitautiriskin ennustamiseen. ATP III:ssa annetaan suosituksia riskin määrittämiseksi useiden riskitekijöiden, diabeteksen ja metabolisen oireyhtymän mukaan. Sepelvaltimotaudin (CHD) riskitekijöitä ovat verenpainetauti (verenpaine ≥140/90 tai verenpainelääkkeiden käyttö), sukuhistoria (ensimmäisen asteen sukulainen, jolla on CHD ), ikä (mies ≥45 vuotta, nainen ≥55 vuotta), HDL-pitoisuus yli 40 mg/dl ja tupakointi. Yli 50 mg/dl:n HDL-taso on todettu sydäntä suojaavaksi ja sitä pidetään siksi ”negatiivisena” riskitekijänä. Sen lisäksi, että ATP III:ssa luetellaan erityiset CHD-riskitekijät, siinä yksilöidään CHD-riskiekvivalentit (olosuhteet, jotka aiheuttavat samanlaisen CHD-tapahtuman riskin). KHK-riskiekvivalentteihin kuuluvat kaulavaltimotauti, vatsa-aortan aneurysma, perifeerinen valtimotauti, diabetes mellitus tai 10 vuoden sydäninfarktin riski, joka on vähintään 20 % (eli FRS ≥ 20 %).1,2
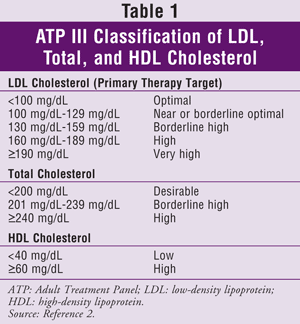
ATP III:ssa määritellään kolesterolin hoidon ensisijaiseksi tavoitteeksi matalan tiheyden lipoproteiini (LDL). Triglyseridien (TG) ja HDL:n tavoitetasojen saavuttamista pidetään yleensä toissijaisena tavoitteena. Yleisväestön kolesterolitavoitteet on esitetty TAULUKOSSA 1.2
ATP III:n päivitetty versio julkaistiin vuonna 2004.3 Tähän versioon sisältyy suositus LDL-pitoisuuden alentamisesta 30-40 prosentilla lähtötasosta potilailla, joilla katsotaan olevan keskisuuri tai suuri KHK:n riski, sekä suuntaviivat, joiden mukaan potilailla katsotaan olevan erittäin suuri riski. Erittäin suuren riskin potilaita voivat olla potilaat, joilla on todettu sydän- ja verisuonitauti ja lisäksi yksi tai useampi seuraavista: useita merkittäviä riskitekijöitä (esim. diabetes), vakavia ja huonosti hallittuja riskitekijöitä (esim. sydän- ja verisuonitauti), tupakointi, hallitsematon verenpainetauti); metabolisen oireyhtymän useat osatekijät (TAULUKKO 2); tai akuutti sepelvaltimo-oireyhtymä.

ATP III -päivityksessä ehdotetaan myös, että tietyille potilaille harkittaisiin lipidejä alentavaa lääkitystä ja LDL:n tavoitetasoa, joka on alle 100 mg/dl.3 Näiden potilaiden KHK:n riskin 10 vuoden aikana tulisi olla 10-20 % ja LDL:n pitoisuuden tulisi olla väliltä 100-130 mg/dl. Heidän tulisi myös olla korkeassa iässä, ja heillä tulisi olla vakavia riskitekijöitä; TG-pitoisuus 200 mg/dl tai enemmän, ei-HDL-pitoisuus 160 mg/dl tai enemmän ja HDL-pitoisuus 40 mg/dl tai vähemmän; metabolinen oireyhtymä; tai uusia riskitekijöitä, kuten korkean herkkyyden C-reaktiivinen proteiini (hs-CRP) (<3 mg/dl) tai sepelvaltimoiden kalsium, joka on suurempi kuin 75:nneksi prosenttipisteen keskiarvo ikään ja sukupuoleen nähden.
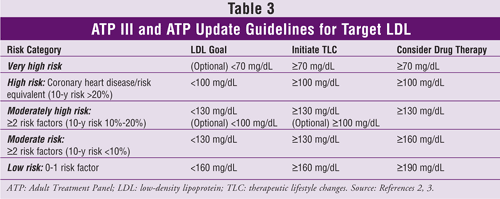
ATP III:n ja sen päivityksen mukaiset LDL:n tavoitetasot, suositukset terapeuttisista elintapojen muutoksista ja tiedot kolesterolia alentavien lääkkeiden aloittamisesta (KHK-riskitekijöiden lukumäärän tai vastaavien perusteella) on esitetty TAULUKOSSA 3.2,3
Ei-traditionaaliset riskimerkkiaineet
Kehitys- ja verisuonisairauksien riskin perinteinen ennustaminen perustuu pitkälti FRS:ään. Tähän lähestymistapaan liittyy kuitenkin rajoituksia, sillä FRS:n on todettu yliarvioivan riskiä matalan riskin väestöryhmissä ja aliarvioivan riskiä korkean riskin väestöryhmissä.4 Itse asiassa äkkikuolemaa ja ei-kuolemaan johtanutta sydäninfarktia ilman aiempia oireita esiintyy jopa 25 prosentilla potilaista, joilla on sydän- ja verisuonitauti (KHK).5 Kuten aiemmin on todettu, ATP III -päivityksessä suositellaan harkitsemaan aggressiivisempaa lipidihoitoa potilailla, joilla on kehittymässä olevia vaaratekijöitä.3 Viimeisen vuosikymmenen aikana tutkimuksessa on keskitytty siihen, mikä rooli ei-perinteisillä vaaratekijöillä on sydän- ja verisuonitautin tautipotilaissairauksien patofysiologian kannalta. Fibrinogeeni, hs-CRP, sepelvaltimoiden kalsium ja lipoproteiinien alifraktioanalyysi ovat olleet monien tutkimusten kohteena.
Vaikka useita tulehduksen merkkiaineita on yhdistetty sydän- ja verisuonitautiin, vain helposti mitattavilla merkkiaineilla on käytännön arvoa.6 Yksi tällainen tulehduksen merkkiaine on hs-CRP.7 Kohonnut hs-CRP on yhdistetty lisääntyneeseen sydän- ja verisuonitautien, aivohalvauksen ja perifeeristen verisuonitautien riskiin potilailla, joilla on ja joilla ei ole tunnettua ateroskleroosia. Hs-CRP:n tasot on jaettu tiileihin. Nämä tritiilit (<1,0 mg/l, 1 mg/l-3 mg/l ja >3 mg/l) vastaavat vastaavasti matalan, kohtalaisen ja korkean riskin FRS-arvoja.8
Viimeisin suuri kliininen tutkimus, jossa tutkittiin CRP:n käyttökelpoisuutta kardiovaskulaarisen riskin ennustamisessa, on JUPITER-tutkimus.9 Tähän tutkimukseen osallistui nimenomaan terveitä potilaita, joilla oli normaali kolesterolipitoisuus (LDL-arvot <130 mg/dl) ja kohonnut CRP-arvotaso (>2 mg/dl). Näitä potilaita hoidettiin rosuvastatiinilla 20 mg tai lumelääkkeellä myöhemmän sydäninfarktin tai ei-kuolemaan johtaneen aivohalvauksen yhdistetyn päätetapahtuman sekä sydäninfarktin, aivohalvauksen ja sydän- ja verisuonisyistä johtuvan kuoleman yhdistetyn riskin arvioimiseksi. Tutkimus lopetettiin 1,9 vuoden seurannan jälkeen, koska rosuvastatiinihoidon todettiin vähentävän yhdistettyä päätetapahtumaa 44 prosenttia lumelääkkeeseen verrattuna. Tämä on ollut käänteentekevä tutkimus, koska se osoittaa, että potilaat, joilla ei ollut muita sydän- ja verisuonitautien riskitekijöitä kuin kohonnut CRP, saivat merkittävää hyötyä rosuvastatiinihoidosta; ei kuitenkaan tiedetä, miten kustannustehokasta olisi seuloa terveitä henkilöitä kohonneen CRP:n varalta ja laajentaa statiinien määräämistä tällaisiin tapauksiin.
Statiinien lisäksi muiden lipidejä alentavien aineiden (kuten niasiini, fibraatit ja ezetimibi) sekä tiatsolidiinidionien ja raloksifeenin on osoitettu alentavan CRP-tasoja. Tällä hetkellä suositellaan, että hs-CRP-tasot otetaan huomioon hoitopäätöksiä tehtäessä potilailla, joiden FRS-ennusteella ennustettu CVD-riski on 10-20 prosenttia seuraavien 10 vuoden aikana, ja että hs-CRP:n rutiinimittausta vältetään aikuisväestössä.7,8,10
Fibrinogeenia on tutkittu myös ei-perinteisenä CVD-riskin ennustajana. Coronary Artery Risk Development in Young Adults (CARDIA) -tutkimuksessa 25-37-vuotiaiden koehenkilöiden kohonnut fibrinogeenipitoisuus oli yhteydessä lisääntyneeseen subkliinisen CVD:n riskiin potilaan seuraavalla vuosikymmenellä.10 Fibrinogeenilla on tärkeä rooli verihiutaleiden aggregaatiossa ja fibriinin muodostumisessa, jotka molemmat ovat ateroskleroosin ja trombien kehittymisen keskeisiä osatekijöitä.1,11 CARDIA-tutkimuksen potilailla, joilla oli kohonnut fibrinogeenitaso, todettiin lisääntynyttä kaulavaltimoiden intimaalipaksuutta ja sepelvaltimoiden kalkkeutumista (CAC) seuraavalla vuosikymmenellä. Tällä hetkellä rutiininomaista fibrinogeenipitoisuuden mittaamista ei kuitenkaan suositella.10
CAC kehittyy ateroskleroottisissa sepelvaltimoissa, ja sitä ei käytännössä esiinny normaalissa verisuonen seinämässä. Korkeampiin CAC-pisteisiin liittyy lisääntynyt spesifisyys mutta vähentynyt herkkyys kardiovaskulaarisen riskin ennustamisessa. On kuitenkin tärkeää huomata, että vaikka kohonnut CAC-pistemäärä korreloi lisääntyneen sydän- ja verisuonitautiriskin kanssa, sydän- ja verisuonitautitapahtumia voi silti esiintyä potilaalla, jonka CAC-pistemäärä on nolla. CAC-arvojen mittaamisen ennustearvosta on keskusteltu paljon viime vuosikymmenen aikana. Vuodesta 2000 lähtien on saatu yhä enemmän näyttöä siitä, että CAC-arvo voi itsenäisesti ennustaa sydän- ja verisuonitauteja perinteisten riskitekijöiden lisäksi. Vuonna 2007 American College of Cardiology Foundation/American Heart Association Writing Committee julkaisi konsensusasiakirjan, joka koski CAC:n käyttöä kardiovaskulaarisen riskin arvioinnissa.12 Komitea oli yksimielinen siitä, että valikoimatonta CAC-seulontaa ei kannata tehdä, koska sen kliininen arvo on vähäinen niiden potilaiden kohdalla, joilla on matala KHK:n riski (FRS <1 %/vuosi). Kuten hs-CR:n ja fibrinogeenin kohdalla, CAC:n rutiinimittausta ei suositella; CAC-pisteet voivat kuitenkin olla hyödyllinen väline, jolla voidaan muokata riskin ennustamista ja mahdollisesti muuttaa hoitoa asianmukaisesti valituilla oireettomilla, keskiriskipotilailla.
Lipoproteiini(a) eli Lp(a) on ATP III -suuntaviivoissa tunnistettu nousevaksi sydän- ja verisuonitautien vaaratekijäksi.2 Lipidit kulkeutuvat koko elimistössä lipidien ja proteiinien muodostamina kompleksien muodossa. Lipoproteiinit vaihtelevat kooltaan ja tiheydeltään, ja ne nimetään vastaavasti LDL:ksi, HDL:ksi ja erittäin pienitiheyksiseksi lipoproteiiniksi (VLDL). Näiden kompleksien proteiinikomponentteja kutsutaan apolipoproteiineiksi. Lp(a), LDL:n muunnettu muoto, koostuu apoproteiini(a)- eli apo(a)-molekyylistä, joka on yhdistetty perinteisen LDL-hiukkasen apolipoproteiini B- eli apo(b)-osaan. Se muistuttaa LDL:ää sekä koostumukseltaan että tiheydeltään. Koska Lp(a):n apo(a)-komponentti on rakenteellisesti samankaltainen kuin plasminogeeni, sen uskotaan kilpailevan elimistössä plasminogeenin kanssa ja estävän siten fibrinolyysiä. Lisäksi Lp(a):n oletetaan edistävän kolesterolin kertymistä, vaahtosolujen kehittymistä ja ateroskleroottisten plakkien leviämistä.1 Sekä niasiinin että estrogeenin on osoitettu alentavan tehokkaasti Lp(a)-pitoisuutta, mutta yksikään statiini ei alenna sitä tehokkaasti.13,14 Kohonneet Lp(a)-pitoisuudet on yhdistetty suurentuneeseen sydän- ja verisuonitautiriskiin joissakin mutta ei kaikissa tutkituissa väestöryhmissä.15 Tällä hetkellä ei ole näyttöä siitä, että Lp(a)-pitoisuuksien seurannasta tai alentamisesta olisi kliinistä hyötyä, eikä rutiinimittausta suositella.16
Apolipoproteiini(b) on paitsi LDL:n myös keskitiheän LDL:n ja VLDL:n tärkein proteiinikomponentti. Kardiovaskulaarisen riskin ennustamisessa apo(b)- ja muiden kuin HDL-kolesterolipitoisuuksien mittaamista on hiljattain ehdotettu paremmaksi kuin LDL-kolesterolin mittaamista.17 Treating to New Targets- ja IDEAL-tutkimusten jälkianalyysissä havaittiin, että muiden kuin HDL-kolesterolipitoisuuksien (tulo, joka saadaan vähentämällä HDL-kolesterolipitoisuus kokonaiskolesterolipitoisuudesta) ja apo(b)-pitoisuuksien yhteys kardiovaskulaariseen lopputulokseen oli läheisempi kuin LDL-kolesterolipitoisuuden.18,19,19 On arveltu, että tulevissa ohjeissa saatetaan suosia ei-HDL-kolesterolia tai apo(b):tä LDL-kolesterolin sijaan ensisijaisena hoitokohteena; tällä hetkellä LDL on kuitenkin edelleen kolesterolin hallinnan ensisijainen tavoite.
Hyperhomokysteinemia on itsenäisesti yhdistetty suurentuneeseen sydän- ja verisuonitautien riskiin, vaikkakaan se ei liity siihen yhtä vahvasti kuin FRS-arvot, eikä tarkkaa syymekanismia tunneta.20 Folaatti- ja B12-reittien viat voivat johtaa kohonneisiin homokysteiinipitoisuuksiin, samoin kuin folaattia tai B6- ja B12-vitamiineja puutteellisesti sisältävä ruokavalio ja lääkkeet, jotka häiritsevät näiden vitamiinien aineenvaihduntaa tai imeytymistä.1 Myös munuaisten ja maksan vajaatoiminta voi nostaa homokysteiinipitoisuutta. Hyperhomokysteinemian uskotaan olevan melko harvinaista. Iäkkäillä ihmisillä voi olla kohonnut riski sairastua tähän tilaan ruokavalion aiheuttaman folaatin puutteen vuoksi. Homokysteiinipitoisuudet olisi mitattava, kun potilas on paastotilassa, ja kohonneet pitoisuudet aiheuttavat etiologian arvioinnin.
Loppujen lopuksi lipoproteiinien alifraktioanalyysi on toinen potentiaalinen väline kardiovaskulaarisen riskin stratifiointiin. Tiedetään, että LDL-mittaus käsittää LDL-hiukkasten spektrin, joka vaihtelee pienistä ja tiheistä hiukkasista kevyempiin ja kelluvampiin hiukkasiin. Pienten, tiheiden LDL-hiukkasten on todettu aiheuttavan suuremman sydän- ja verisuonitautiriskin.21 LDL:n lisääntyessä pienet, tiheät LDL-alifraktiot lisääntyvät. Vastaavasti kokonais-HDL-mittaukset koostuvat kooltaan ja tiheydeltään vaihtelevista hiukkasista. Pienemmillä, tiheämmillä HDL-molekyyleillä on vähemmän sydäntä suojaavaa vaikutusta. Kun HDL-pitoisuudet laskevat, pienten HDL-hiukkasten määrä kasvaa selvästi. Näiden löydösten perusteella on ehdotettu, että kohonnut LDL, kohonneet pienet LDL:n alifraktiot, alhainen HDL ja pienet, suuret HDL:n alifraktiot ennustavat sydän- ja verisuonitautia. ATP III -suuntaviivoissa tunnustetaan, että pienet LDL-hiukkaset on tunnistettu aterogeneesin yhdeksi osatekijäksi ja että HDL:n alafraktioiden mittaukset voivat edistää sydän- ja verisuonitautiriskin arviointia. Suuntaviivojen mukaan LDL-alfraktioiden kykyä ennustaa sydän- ja verisuonitautia muista riskitekijöistä riippumatta ei kuitenkaan ole hyvin määritelty. Lisäksi ATP III:ssa huomautetaan, että HDL:n alifraktiomittauksen kliinistä hyötyä ei ole osoitettu. Tämän vuoksi ja koska hiukkaskokoa, -tiheyttä ja -määrää koskevia mielekkäitä ja toistettavia raja-arvoja ei ole vielä vahvistettu, lipoproteiinien alifraktioiden mittausta ei käytetä hyperlipidemian hoidon rutiinihoidossa tai riskin stratifioinnissa. Se voi kuitenkin olla hyödyllinen perinteisen riskistratifikaation lisänä määritettäessä hoidon aggressiivisuutta keskiriskipotilailla.
Johtopäätös
Vaikka ATP III:een perustuvat hoitosuositukset, jotka tukeutuvat voimakkaasti FRS:ään, ovat edelleen sydän- ja verisuonitautien hoitosuositusten ytimessä, ei-perinteiset sydän- ja verisuonitautien indikaattorit ovat nousemassa esiin apuvälineinä, joiden avulla voidaan tehdä tarkempaa riskin ositusta ja tunnistaa potilaat, joilla on varhaisessa vaiheessa subkliininen tauti ja jotka saattavat tarvita varhaisempaa ja aggressiivisempaa hoitoa.
Ei-traditionaalisten CVD-riskimittareiden tarkkaa roolia henkilön tulevan sydän- ja verisuonitautiriskin määrittämisessä, tavoitetasoja koskevia suuntaviivoja ja erityissuosituksia siitä, missä väestöryhmissä näitä merkkiaineita tulisi mitata rutiininomaisesti, ei ole vielä määritelty. Mitään ei-perinteisistä sydän- ja verisuonitautien merkkiaineista ei tällä hetkellä suositella rutiiniseulontaan; näiden riskitekijöiden mittaaminen voi kuitenkin olla hyödyllistä potilaille, joiden kohdalla päätös hoidon (erityisesti lääkityksen) aloittamisesta on epäselvä. Tällaisissa tilanteissa ei-perinteisten riskitekijöiden mittaamisesta perinteisten CVD-riskin ennustamisvälineiden lisäksi voi olla merkittävää hyötyä.
1. Talbert RL. Hyperlipidemia. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Pharmacotherapy: A Pathophysiologic Approach. 7th ed. New York, NY: McGraw Hill Medical; 2008:385-407.
2. National Heart Lung and Blood Institute. Third report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). www.nhlbi.nih.gov/guidelines/cholesterol/. Accessed November 1, 2008.
3. Grundy SM, Cleeman JI, Merz CN, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation. 2004;110:227-239.
4. Brindle P, Beswick A, Fahey T, Ebrahim S. Riskinarvioinnin tarkkuus ja vaikutus sydän- ja verisuonitautien primaaripreventiossa: järjestelmällinen katsaus. Heart. 2006;92:1752-1759.
5. Myerburg RJ, Kessler KM, Castellanos A. Äkillinen sydänkuolema: epidemiologia, ohimenevä riski ja toimenpiteiden arviointi. Ann Intern Med. 1993;119:1187-1197.
6. de Ferranti SD, Rifai N. C-reaktiivinen proteiini: ei-perinteinen seerumin kardiovaskulaarisen riskin merkkiaine. Cardiovasc Pathol. 2007;16:14-21.
7. Koenig W, Sund M, Frölich M, ym. C-reaktiivinen proteiini, herkkä tulehduksen merkkiaine, ennustaa tulevaa sepelvaltimotaudin riskiä alun perin terveillä keski-ikäisillä miehillä: tuloksia MONICA-tutkimuksesta (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburgin kohorttitutkimuksesta, 1984-1992. Circulation. 1999;99:237-242.
8. Pearson TA, Mensah GA, Alexander RW, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: a statement for health-care professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003;107:499-511.
9. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatiini verisuonitapahtumien ehkäisemiseksi miehillä ja naisilla, joilla on kohonnut C-reaktiivinen proteiini. N Engl J Med. 2008;359:2195-2207.
10. Sydän- ja verisuonitauteja ja aineenvaihduntasairauksia käsittelevä komitea. Sydän- ja verisuonitautiriskin arviointi muilla kuin perinteisillä riskitekijöillä: uusin näyttö. CMDManagement Insights Informat Cardiovasc Metabol Dis. 2008;13(2):1-3,6.
11. Mora S, Rifai N, Buring JE, Ridker PM. Immunomäärityksellä mitattujen fibrinogeeni- ja korkean herkkyyden C-reaktiivisen proteiinin tasojen additiivinen arvo sydän- ja verisuonitapahtumien ennustamisessa. Circulation. 2006;114:381-387.
12. Greenland B, Bonow RO, Brundage BH, et al. ACCF/AHA 2007 Clinical Expert Consensus Document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain. A report of the American College of Cardiology Foundation Clinical Expert Consensus Task Force (American College of Cardiology Foundation Clinical Expert Consensus Task Force, ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography). J Am Coll Cardiol. 2007;49:378-402.
13. Angelin B. Hoito lipoproteiini(a)tasojen alentamiseksi. Curr Opin Lipidol. 1997;8:337-341.
14. Brown BG, Zhao XQ, Chait A, et al. Simvastatiini ja niasiini, antioksidanttivitamiinit tai yhdistelmä sepelvaltimotaudin ehkäisyssä. N Engl J Med. 2001;345:1583-1592.
15. Moliterno D, Jokinen EV, Miserez AR, ym. Ei yhteyttä plasman lipoproteiini(a)-pitoisuuksien ja sepelvaltimoiden ateroskleroosin esiintymisen tai puuttumisen välillä afroamerikkalaisilla. Arterioscler Thromb Vasc Biol. 1995;15:850-855.
16. Bennet A, Di Angelantonio E, Erqou S, et al. Lipoproteiini(a)pitoisuudet ja tulevan sepelvaltimotaudin riski: laajamittaiset prospektiiviset tiedot. Arch Intern Med. 2008;168:598-608.
17. Kastelein JJ, van der Steeg WA, Holme I, et al. Lipidit, apolipoproteiinit ja niiden suhteet suhteessa sydän- ja verisuonitapahtumiin statiinihoidon yhteydessä. Circulation. 2008;117:3002-3009.
18. LaRosa JC, Grundy SM, Waters DD, ym. intensiivinen lipidien alentaminen atorvastatiinilla potilailla, joilla on stabiili sepelvaltimotauti. N Engl J Med. 2005;352:1425-1435.
19. Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction: the IDEAL study: a randomized controlled trial. JAMA. 2005;294:2437-2445.
20. Wald DS, Law M, Morris JK. Homokysteiini ja sydän- ja verisuonisairaudet: näyttöä kausaliteetista meta-analyysistä. BMJ. 2002;325:1202-1206.
21. Rizzo M, Berneis K. Alhaisen tiheyden lipoproteiinien koko ja sydän- ja verisuoniriskin arviointi. QJM.2006;99:1-14.