Ayant établi l’existence du noyau, vous pouvez maintenant considérer les preuves expérimentales de sa taille, en commençant par l’expérience de Rutherford.
Résumé de la leçon
- Discussion et exemple travaillé : Taille du noyau (15 minutes)
- Discussion : Taille de l’atome et du noyau (10 minutes)
- Questions des élèves : Forces et approche la plus proche (30 minutes)
- Discussion : Le numéro atomique et la charge d’un noyau (5 minutes)
- Discussion : Limite supérieure de la taille du noyau (30 minutes)
- Discussion : Une énigme pour une prochaine leçon (5 minutes)
Discussion et exemple travaillé : Taille du noyau
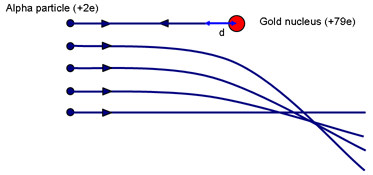
Vous pouvez avoir une idée de la taille possible du noyau en pensant à l’expérience de Rutherford. Demandez : Quel paramètre d’impact permettra à une particule de se rapprocher le plus du noyau ? (Une collision frontale avec p = 0.)
Le principe de la conservation de l’énergie est utilisé pour calculer la distance d’approche la plus proche comme mesure de la taille d’un noyau. La compréhension du calcul qui suit dépend du fait que les élèves aient ou non couvert le potentiel et les champs électriques. Sinon, il sert de bonne révision.
Episode 522-1 : Diffusion de particules alpha – distance d’approche la plus proche (Word, 29 KB)
Episode 522-2 : distance d’approche la plus proche (Word, 107 KB)
Lorsque le α est amené momentanément au repos (après avoir grimpé aussi loin que possible sur la colline électrostatique), un travail aura été effectué contre la force répulsive du noyau. L’énergie cinétique de l’α est stockée dans le champ autour du noyau. Lorsque la vitesse est nulle, toute l’énergie est maintenant stockée dans le champ.
Si l’α s’arrête momentanément lorsqu’il est à une distance d du (centre du) noyau de charge Ze, l’énergie dans le champ est:
Eα = 14πε0 2e Zed
Ceci est égal à l’énergie cinétique initiale de la particule α. Rutherford a utilisé une source α qui lui a été donnée par Madame Curie. L’énergie α était de ~ 7.7 MeV.
Pour l’or, Z = 79. La résolution donne d ~ 3 × 10-14 m. Comparez cela au diamètre des atomes d’or ~ 3 × 10-10 m. Un noyau est donc au moins 10 000 fois plus petit qu’un atome. Il est important de souligner que ce calcul donne une limite supérieure à la taille du noyau d’or ; nous ne pouvons pas dire que la particule alpha touche le noyau ; un α plus énergétique pourrait s’en approcher encore.
Un atome est principalement vide (ce qui explique pourquoi la plupart des as l’ont traversé directement – les électrons éventuels ne gêneraient guère l’α relativement massif et rapide).
Discussion : Taille de l’atome et du noyau
Demandez à vos élèves de proposer un modèle réduit de l’atome nucléaire. Par exemple : si un noyau avait 1 mm de diamètre, un atome serait 10 000 fois plus grand ou 10 m de diamètre. Choisissez un emplacement approprié pour un noyau de 1 mm (un petit roulement à billes ou une boule de Blu-tac). Parcourez 5 m (cinq grands pas) jusqu’au bord de l’atome, là où se trouvent les électrons. NB : les schémas des manuels représentant un atome avec un noyau ne sont pas dessinés à l’échelle.
Renforcer une image précise en demandant à un élève de se mettre debout comme un noyau, d’estimer sa circonférence (40 cm ?) et de demander où un autre élève devrait se tenir pour être au bord de l’atome. 104 × 40 cm = 4000 m}, le rayon de cet atome est donc de 2 km ! Vérifiez avec une carte locale pour trouver un endroit nommé que les élèves reconnaîtront et qui est à 2 km.
Renforcement supplémentaire : dans un solide où les atomes sont serrés, la distance entre les noyaux adjacents ~ la taille d’un atome, c’est-à-dire équivalente à deux élèves se tenant à 4 km de distance !
C’est donc assez étonnant qu’aucun n’ait frappé un noyau du tout. Les deux sont d’une taille similaire. Section transversale présentée par un noyau ~radius2, donc ~1 × 10-28 m2}.
Demandez : comment vous attendriez-vous à ce que le nombre de réfléchis comme dépende de l’épaisseur de la feuille de métal contenant les noyaux cibles ? (Imaginez les atomes d’or en couches, la chance d’une déviation augmente avec l’épaisseur, mais l’absorption à l’entrée ou à la sortie de la feuille de plus en plus épaisse finira par empêcher toute augmentation supplémentaire du nombre réfléchi et détecté.
Il est très utile que vos élèves puissent se rappeler les ordres de grandeur suivants :
Radius du noyau atomique ~ 10 -14m
Radius de l’atome ~ 10 -10m
Questions d’élèves : Forces et approche la plus proche
Episode 522-3 : La diffusion de Rutherford : Directions des forces (Word, 82 KB)
Episode 522-4 : Diffusion de Rutherford : Énergie et approche la plus proche (Word, 83 Ko)
Discussion : Le numéro atomique et la charge d’un noyau
Rutherford a utilisé ses données pour trouver la charge du noyau cible de l’or. D’autres expériences pour trouver la charge des feuilles de Cu, Ag et Pt ont donné :
| Nombre atomique | Une expérience de diffusion | |
| Cu | 29 | 29.3 × e |
| Ag | 47 | 46.3 × e |
| PT | 78 | 77,4 × e |
Donc la charge électrique d’un noyau est donnée par le numéro atomique × e, c’est-à-dire Z e. A une exception près (l’hydrogène, H-1), Z est toujours inférieur au numéro de masse atomique. Comment expliquer cette différence ? L’atome doit être électriquement neutre. Rutherford a proposé le neutron.
Discussion : Limite supérieure de la taille du noyau
Rappelons que l’analyse de Rutherford donne une limite supérieure à la taille sur le noyau (d ~ 1 α énergie de la particule). La taille que vous mesurez dépend de l’énergie de la particule α que vous utilisez. Nous avons donc besoin d’une autre approche pour trouver la taille d’un noyau d’or. Pouvez-vous imaginer une meilleure particule pour sonder la taille d’un noyau ? (Le neutron – étant non chargé, il se rapprochera davantage.)
Une autre technique est la diffusion inélastique profonde des électrons. Référez-vous si vous avez déjà couvert la nature ondulatoire des particules (ondes de de Broglie λ = hp), ou ce sujet peut être inséré ici si vous le souhaitez. L’appareil de diffraction des électrons présente une similitude fondamentale avec la diffusion des particules. Les électrons sont tirés sur un film mince – dans ce cas de graphite.
Rutherford a eu la chance que la longueur d’onde de de Broglie des particules α (inconnues de lui) était assez petite, et la répulsion de coulomb s’arrête en s’approchant trop près – sinon les effets de diffraction auraient confondu les données ! (Essayez le calcul si vous avez déjà couvert λ = hp.)
Episode 506-2 : Interprétation des diagrammes de diffraction des électrons (Word, 30 KB)
Episode 522-5 : Diffusion inélastique profonde (Word, 56 Ko)
Episode 522-6 : Les électrons mesurent la taille des noyaux (Word, 42 Ko)
Discussion : Une énigme pour une prochaine leçon
Il y a un problème fondamental avec le modèle de Rutherford. Demandez à votre classe : Comment un atome avec un noyau central peut être stable – pourquoi ne s’effondre-t-il pas ? Selon l’électrodynamique classique, les électrons devraient émettre des radiations lorsqu’ils sont en orbite, et spiraler vers l’intérieur.
(Il est bon de quitter une classe avec une énigme pour une prochaine leçon.)
Télécharger cet épisode
.