La loi de la décroissance radioactive
Lorsqu’un noyau individuel se transforme en un autre avec l’émission d’un rayonnement, on dit que le noyau se désintègre. La décroissance radioactive se produit pour tous les noyaux avec \(Z > 82\), et aussi pour certains isotopes instables avec \(Z < 83\). Le taux de désintégration est proportionnel au nombre de noyaux d’origine (non désintégrés) N dans une substance. Le nombre de noyaux perdus par désintégration, \(-dN\) dans l’intervalle de temps dt, s’écrit
\
où \(\lambda\) est appelée la constante de désintégration. (Le signe moins indique que le nombre de noyaux d’origine diminue avec le temps). En d’autres termes, plus il y a de noyaux disponibles pour se désintégrer, plus il y en a qui se désintégrent (dans le temps dt). L’équation \ref{eq2} peut être réécrite comme suit
\
En intégrant les deux côtés de l’équation, et en définissant \(N_0\) comme étant le nombre de noyaux à \(t = 0\), nous obtenons
Cela nous donne
En prenant les côtés gauche et droit de l’équation \ref{eq4} comme une puissance de \(e\), nous avons la loi de désintégration radioactive.
La loi de décroissance radioactive
Le nombre total \(N\) de noyaux radioactifs restant après le temps \(t\) est
où \(\lambda\) est la constante de décroissance pour le noyau particulier.
Le nombre total de noyaux diminue très rapidement au début, puis plus lentement (Figure \(\PageIndex{2}\)).
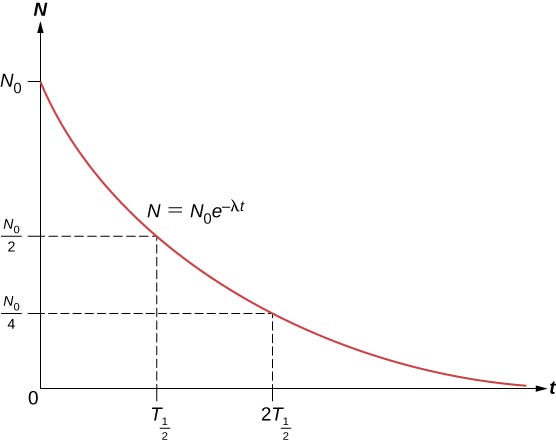
La demi-vie \((T_{1/2})\) d’une substance radioactive est définie comme le temps nécessaire à la désintégration de la moitié des noyaux d’origine (ou le temps auquel il reste la moitié des noyaux d’origine). Les demi-vies des isotopes instables sont indiquées dans le tableau des nucléides. Le nombre de noyaux radioactifs restant après un nombre entier (n) de demi-vies est donc
\
Si la constante de désintégration \((\lambda)\) est grande, la demi-vie est petite, et vice versa. Pour déterminer la relation entre ces quantités, il faut noter que lorsque \(t = T_{1/2}\), alors \(N = N_0/2\).
Donc, l’équation \ref{eq5} peut être réécrite comme
\
Diviser les deux côtés par \(N_0\) et prendre le logarithme naturel donne
\
ce qui se réduit à
\
Donc, si l’on connaît la demi-vie T1/2 d’une substance radioactive, on peut trouver sa constante de désintégration. La durée de vie \(\overline{T}\) d’une substance radioactive est définie comme la durée moyenne d’existence d’un noyau avant sa désintégration. La durée de vie d’une substance est juste l’inverse de la constante de désintégration, qui s’écrit
\
L’activité A est définie comme la magnitude du taux de désintégration, soit
\
Le changement infinitésimal dN dans l’intervalle de temps dt est négatif parce que le nombre de particules mères (non désintégrées) diminue, donc l’activité (A) est positive. En définissant l’activité initiale comme \(A_0 = \lambda N_0\), nous avons
\
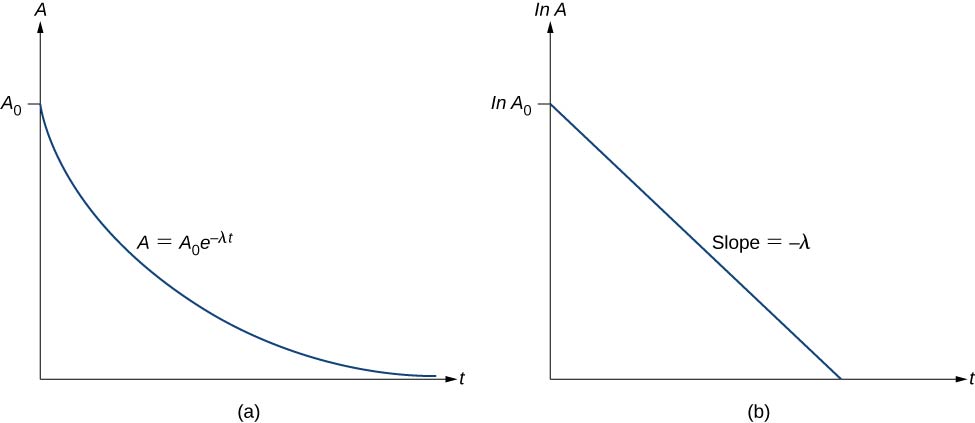
Donc, l’activité A d’une substance radioactive diminue exponentiellement avec le temps (Figure \(\PageIndex{3}\)).
Exemple \(\PageIndex{1}\) : Constante de désintégration et activité du strontium-90
La demi-vie du strontium-90, \(\ce{_{38}^{90}Sr}\), est de 28,8 y. Trouvez (a) sa constante de désintégration et (b) l’activité initiale de 1,00 g du matériau.
Stratégie
Nous pouvons trouver la constante de désintégration directement à partir de l’équation \ref{eq8}. Pour déterminer l’activité, nous devons d’abord trouver le nombre de noyaux présents.
Solution
a. On trouve que la constante de désintégration est
\
b. La masse atomique du \(_{38}^{90}Sr\) est de 89,91 g. En utilisant le nombre d’Avogadro \(N_A = 6,022 \times 10^{23}\) atomes/mol, on trouve le nombre initial de noyaux dans 1,00 g de matière:
\
De là, on trouve que l’activité \(A_0\) à \(t = 0\) pour 1.00 g de strontium-90 est
En exprimant \(\lambda\) en termes de demi-vie de la substance, nous obtenons
Donc, l’activité est réduite de moitié après une demi-vie. Nous pouvons déterminer la constante de décroissance \(\lambda\) en mesurant l’activité en fonction du temps. En prenant le logarithme naturel des côtés gauche et droit de l’équation \ref{eq11}, nous obtenons
\
Cette équation suit la forme linéaire \(y = mx + b\). Si nous traçons \ln A en fonction de t, nous nous attendons à une ligne droite avec une pente \(-\lambda\) et une ordonnée à l’origine \(\ln \, A_0\) (Figure \(\PageIndex{3b}\)). L’activité A est exprimée en becquerels (Bq), où un \(1 \, Bq = 1 \, désintégration \, par \, seconde\). Cette quantité peut également être exprimée en désintégrations par minute ou en désintégrations par an. L’une des unités d’activité les plus courantes est le curie (Ci), défini comme l’activité de 1 g de \(^{226}Ra\). La relation entre le Bq et le Ci est
\
Exemple : \(\PageIndex{2}\) : Quelle est l’activité du tissu vivant ?
Approximativement \(20\%\) de la masse du corps humain est constituée de carbone. Calculez l’activité due au \(^{14}C\) dans 1,00 kg de carbone présent dans un organisme vivant. Exprimez l’activité en unités Bq et Ci.
Stratégie
L’activité du \(^{14}C\) est déterminée à l’aide de l’équation \(A_0 = \lambda N_0\), où λ est la constante de désintégration et \(N_0\) le nombre de noyaux radioactifs. Le nombre de noyaux \(^{14}C\) dans un échantillon de 1,00 kg est déterminé en deux étapes. Premièrement, nous déterminons le nombre de noyaux \(^{12}C\) en utilisant le concept de la mole. Ensuite, nous multiplions cette valeur par \(1,3 \times 10^{-12}\) (l’abondance connue de \(^{14}C\) dans un échantillon de carbone provenant d’un organisme vivant) pour déterminer le nombre de noyaux \(^{14}C\) dans un organisme vivant. La constante de désintégration est déterminée à partir de la demi-vie connue du \(^{14}C\) (disponible auprès de ).
Solution
Une mole de carbone a une masse de 12,0 g, puisqu’il s’agit de \(^{12}C\) presque pur. Ainsi, le nombre de noyaux de carbone dans un kilogramme est
\
Le nombre de noyaux de \(^{14}C\) dans 1 kg de carbone est donc
\
Nous pouvons maintenant trouver l’activité \(A\) en utilisant l’équation \ref{eq11}. En entrant les valeurs connues, on obtient
\
ou \(7,89 \times 10^9\) désintégrations par an. Pour convertir cette valeur en unité Bq, il suffit de convertir les années en secondes. Ainsi,
\
ou 250 désintégrations par seconde. Pour exprimer A en curies, on utilise la définition d’un curie,
\
Donc,
Signification
Approximativement \(20\%\) du corps humain en poids est du carbone. Des centaines de désintégrations du \(^{14}C\) ont lieu dans le corps humain chaque seconde. Le carbone 14 et d’autres substances radioactives naturelles présentes dans le corps constituent l’exposition de fond d’une personne aux rayonnements nucléaires. Comme nous le verrons plus loin dans ce chapitre, ce niveau d’activité est bien inférieur aux doses maximales recommandées.