Les cellules contiennent beaucoup d’eau. L’un des rôles de l’eau est de dissoudre différentes matières. Par exemple, il y a beaucoup de composés ioniques différents (sels) dans les cellules. Les ions sont utilisés pour maintenir les potentiels cellulaires et sont importants dans la signalisation cellulaire et la contraction musculaire.
Comment pouvez-vous dire si un composé est ionique ou covalent ?
Il n’y a pas de réponse simple à cette question. De nombreuses liaisons se situent quelque part entre les deux. Dans une liaison covalente polaire, une paire d’électrons est partagée entre deux atomes afin de remplir leurs octaves, mais les électrons se trouvent plus près d’une extrémité de la liaison que de l’autre. Il y a plus de charge négative vers une extrémité de la liaison, et cela laisse plus de charge positive à l’autre extrémité.
L’examen des valeurs d’électronégativité de différents atomes nous aide à décider de la régularité du partage d’une paire d’électrons dans une liaison. L’électronégativité augmente vers le coin supérieur droit du tableau périodique en raison d’une combinaison de facteurs de charge nucléaire et de blindage. Les atomes dans le coin supérieur droit du tableau périodique ont une plus grande attraction sur leurs électrons de liaison partagés, tandis que ceux dans le coin inférieur gauche ont une attraction plus faible pour les électrons dans les liaisons covalentes.
Dans une liaison carbone-oxygène, plus d’électrons seraient attirés par l’oxygène parce qu’il est à droite du carbone dans sa rangée dans le tableau périodique. Des composés comme l’éther diméthylique, CH3OCH3, sont un peu polaires. Le formaldéhyde, CH2O, est encore plus polaire. Les électrons des liaisons pi sont maintenus plus lâchement que les électrons des liaisons sigma, pour des raisons de mécanique quantique. Cela permet à l’oxygène d’attirer les électrons vers lui plus facilement dans une liaison multiple que dans une liaison sigma.

Les polarités ne sont pas toutes faciles à déterminer en jetant un coup d’œil au tableau périodique. La direction du dipôle dans une liaison bore-hydrogène serait difficile à prévoir sans consulter les valeurs d’électronégativité, puisque le bore est plus à droite mais l’hydrogène est plus haut. Il s’avère que l’hydrogène est légèrement négatif.
Une liaison est ionique si la différence d’électronégativité entre les atomes est suffisamment grande pour qu’un atome puisse arracher complètement un électron à l’autre. Cette situation est fréquente dans les composés qui combinent des éléments du bord gauche du tableau périodique (sodium, potassium, calcium, etc.) avec des éléments de l’extrême supérieur droit du tableau périodique (le plus souvent l’oxygène, le fluor, le chlore). Le chlorure de sodium est un composé ionique.
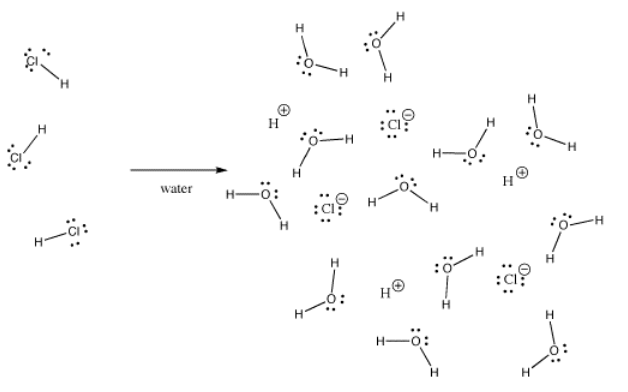
De nombreuses liaisons peuvent être covalentes dans une situation et ioniques dans une autre. Par exemple, le chlorure d’hydrogène, HCl, est un gaz dans lequel l’hydrogène et le chlore sont liés de manière covalente, mais si on fait barboter le HCl dans l’eau, il s’ionise complètement pour donner le H+ et le Cl- d’une solution d’acide chlorhydrique. Même dans le HCl gazeux, la charge n’est pas répartie uniformément. Le chlore est partiellement négatif et l’hydrogène est partiellement positif.
L’hydroxyde de potassium, KOH, contient une liaison qui est covalente (O-H) et une qui est ionique (K-O). L’hydrogène est délicat car il se trouve en haut du tableau périodique ainsi que sur le côté gauche. Il est juste assez électropositif pour former des liaisons ioniques dans certains cas. Il est juste assez électronégatif pour former des liaisons covalentes dans d’autres cas.
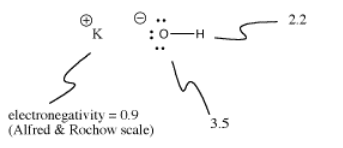
Dans le KOH, la liaison K-O est ionique car la différence d’électronégativité entre le potassium et l’oxygène est importante. La différence d’électronégativité entre l’oxygène et l’hydrogène n’est pas faible. Une liaison O-H peut parfois s’ioniser, mais pas dans tous les cas.
L’ionisation dépend parfois de ce qui se passe d’autre dans une molécule. Comme la liaison K-O dans l’hydroxyde de potassium est ionique, la liaison O-H n’est pas très susceptible de s’ioniser. L’oxygène porte déjà une charge négative. La séparation des charges coûte de l’énergie, il est donc plus difficile de placer une deuxième charge négative sur l’oxygène en ionisant également la liaison O-H. Fréquemment les premières ionisations dans les molécules sont beaucoup plus faciles que les secondes ionisations.
Exercice \(\PageIndex{1}\)
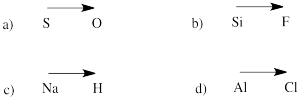
Prédire la direction de la polarité dans une liaison entre les atomes des paires suivantes :
a) soufre-oxygène b) silicium-fluor
c) hydrogène-sodium d) chlore-aluminium
Réponse
Parce qu’il est si courant qu’un élément de l’extrême gauche du tableau périodique soit présent comme cation, et que les éléments de l’extrême droite portent une charge négative, on peut souvent supposer qu’un composé contenant un exemple de chacun aura au moins une liaison ionique.
Exercice \(\PageIndex{2}\)
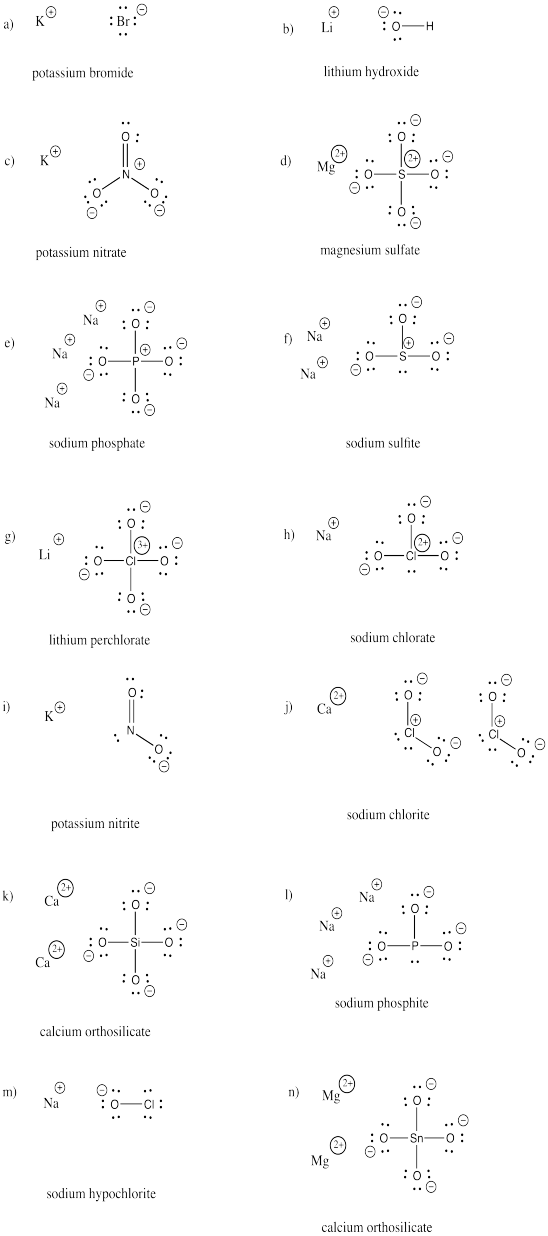
Dessinez les structures des composés suivants. Chacun d’eux contient au moins un anion et un cation.
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Réponse
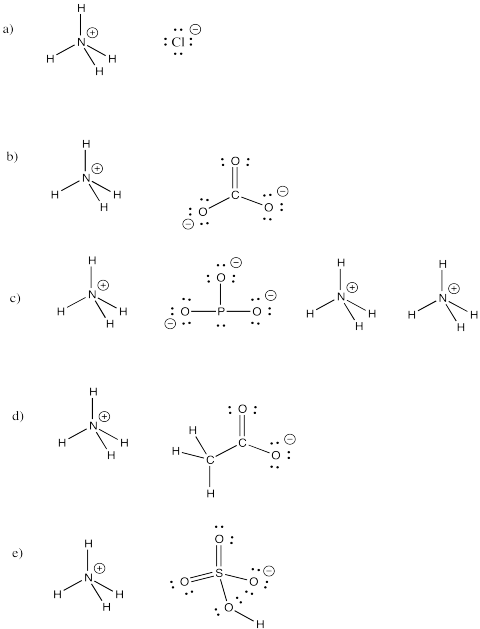
Exercice \(\PageIndex{3}\)
L’ion ammonium, NH4+, est un ion moléculaire commun. Dessinez les structures des composés suivants qui comprennent cet ion.
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Réponse
Exercice \(\PageIndex{4}\)
De nombreux anions ont des noms qui vous renseignent sur leur structure.
| préfixe- ou -suffixe |
sens commun |
exemple de nom | exemple de formule |
| -.ide | atome est présent comme anion | chlorure | Cl – |
| -ate | atome est présent comme oxyanion ; généralement une forme commune | chlorate | ClO3- |
| -ite | atome est présent comme un oxyanion, mais avec moins d’oxygènes (ou un « état d’oxydation » inférieur) qu’une autre forme courante | chlorite | ClO2- |
| par- | atome est présent sous forme d’oxyanion, mais avec encore plus d’oxygènes que la forme « -ate » | perchlorate | ClO4- |
| hypo- | atome est présent comme oxyanion, mais avec encore moins d’oxygènes que la forme « -ite » | hypochlorite | ClO- |
En utilisant le tableau comme guide, proposez des noms pour les anions suivants :
a) Br- b) O2- c) F- d) CO32- (oxyanion commun) e) NO3- (oxyanion commun) f) NO2-
g) S2- h) SO42- (oxanin commun) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (oxyanion commun) o) PO33- p) I- q) IO3- (oxyanion commun) r) IO4-
Réponse a)
bromure
Réponse b)
oxyde
Réponse c)
fluorure
Réponse d)
carbonate
Réponse e)
nitrate
Réponse f)
nitrite
Réponse g)
sulfure
. Réponse h)
sulfate
Réponse i)
sulfite
Réponse j)
persulfate
Réponse k)
carbure
Réponse l)
nitrure
Réponse m)
arséniure
Réponse n)
phosphate
Réponse o)
phosphite
Réponse p)
iodure
Réponse q)
iodate
Réponse r)
périodate
Attribution
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)