Spectres d’émission atomique
Les électrons d’un atome ont tendance à être disposés de telle sorte que l’énergie de l’atome soit la plus faible possible. L’état fondamental d’un atome est l’état d’énergie le plus bas de l’atome. Lorsque ces atomes reçoivent de l’énergie, les électrons absorbent l’énergie et passent à un niveau d’énergie supérieur. Ces niveaux d’énergie des électrons dans les atomes sont quantifiés, ce qui signifie à nouveau que l’électron doit passer d’un niveau d’énergie à un autre par étapes discrètes, plutôt que de manière continue. Un état excité d’un atome est un état où son énergie potentielle est supérieure à celle de l’état fondamental. Un atome à l’état excité n’est pas stable. Lorsqu’il retourne à l’état fondamental, il libère l’énergie qu’il avait précédemment gagnée sous forme de rayonnement électromagnétique.
Alors, comment les atomes gagnent-ils de l’énergie en premier lieu ? Une façon de le faire est de faire passer un courant électrique à travers un échantillon fermé d’un gaz à basse pression. Comme les niveaux d’énergie des électrons sont uniques pour chaque élément, chaque tube à décharge gazeuse brillera d’une couleur distinctive selon l’identité du gaz (voir ci-dessous).

Les enseignes « néon » sont des exemples familiers de tubes à décharge de gaz. Cependant, seules les enseignes qui brillent de la couleur rouge-orange vue sur la figure sont réellement remplies de néon. Les enseignes d’autres couleurs contiennent des gaz différents ou des mélanges de gaz.
Les scientifiques ont étudié la couleur rose distinctive de la décharge gazeuse créée par le gaz hydrogène. Lorsqu’un faisceau étroit de cette lumière était observé à travers un prisme, la lumière était séparée en quatre lignes de longueurs d’onde (et de fréquences) très spécifiques puisque \(\lambda\) et \(\nu\) sont inversement liées). Un spectre d’émission atomique est le modèle de lignes formé lorsque la lumière traverse un prisme pour la séparer en différentes fréquences de lumière qu’elle contient. La figure ci-dessous montre le spectre d’émission atomique de l’hydrogène.
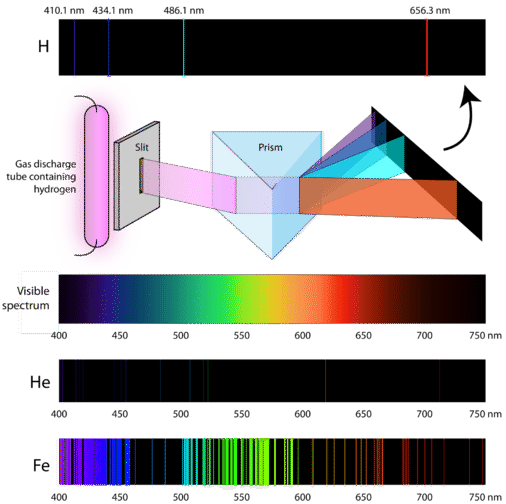
La théorie classique était incapable d’expliquer l’existence des spectres d’émission atomique, également appelés spectres d’émission de raies. Selon la physique classique, un atome à l’état fondamental serait capable d’absorber n’importe quelle quantité d’énergie plutôt que seulement des quantités discrètes. De même, lorsque les atomes se détendent pour revenir à un état de moindre énergie, toute quantité d’énergie peut être libérée. On obtient ainsi ce que l’on appelle un spectre continu, où toutes les longueurs d’onde et toutes les fréquences sont représentées. La lumière blanche vue à travers un prisme et un arc-en-ciel sont des exemples de spectres continus. Les spectres d’émission atomique ont été une preuve supplémentaire de la nature quantifiée de la lumière et ont conduit à un nouveau modèle de l’atome basé sur la théorie quantique.