Tendances périodiques
Dans un premier temps, nous allons nous concentrer sur les atomes individuels, et réfléchir aux tendances associées à la position d’un élément sur le tableau périodique. Nous utiliserons comme premiers modèles les composés organiques simples que sont l’éthane, la méthylamine et l’éthanol, mais les concepts s’appliquent également à des biomolécules plus complexes ayant les mêmes fonctionnalités, par exemple les chaînes latérales des acides aminés alanine (alcane), lysine (amine) et sérine (alcool).
Tendance périodique horizontale de l’acidité et de la basicité:
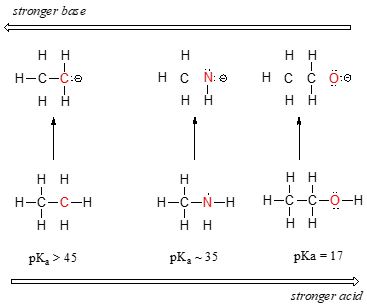
Nous pouvons voir une tendance claire de l’acidité lorsque nous nous déplaçons de gauche à droite le long de la deuxième ligne du tableau périodique, du carbone à l’azote et à l’oxygène. La clé pour comprendre cette tendance est de considérer la base conjuguée hypothétique dans chaque cas : plus la base conjuguée est stable (faible), plus l’acide est fort. Regardez où la charge négative se retrouve dans chaque base conjuguée. Dans la base conjuguée de l’éthane, la charge négative est portée par un atome de carbone, tandis que sur la base conjuguée de la méthylamine et de l’éthanol, la charge négative est située sur un azote et un oxygène, respectivement. Rappelez-vous de la section 2.4A que l’électronégativité augmente également lorsque nous nous déplaçons de gauche à droite le long d’une rangée du tableau périodique, ce qui signifie que l’oxygène est le plus électronégatif des trois atomes, et le carbone le moins.
Note
Plus un atome est électronégatif, plus il est capable de porter une charge négative. Les bases plus faibles ont des charges négatives sur des atomes plus électronégatifs ; les bases plus fortes ont des charges négatives sur des atomes moins électronégatifs.
Ainsi, l’anion méthoxyde est le plus stable (énergie la plus faible, le moins basique) des trois bases conjuguées, et l’anion carbanion éthyle est le moins stable (énergie la plus élevée, le plus basique). Inversement, l’éthanol est l’acide le plus fort, et l’éthane l’acide le plus faible.
Lorsqu’on se déplace verticalement dans une colonne donnée du tableau périodique, on observe à nouveau une tendance périodique claire en matière d’acidité. Ceci est mieux illustré avec les haloacides et les halogénures : la basicité, comme l’électronégativité, augmente au fur et à mesure que l’on monte dans la colonne.
Tendance périodique verticale de l’acidité et de la basicité:

À l’inverse, l’acidité des haloacides augmente au fur et à mesure que l’on descend dans la colonne.
Pour donner un sens à cette tendance, nous allons à nouveau considérer la stabilité des bases conjuguées. Le fluor étant l’élément halogène le plus électronégatif, on pourrait s’attendre à ce que le fluorure soit également l’ion halogène le moins basique. Mais en fait, c’est le moins stable, et le plus basique ! Il s’avère que lorsqu’on se déplace verticalement dans le tableau périodique, la taille de l’atome l’emporte sur son électronégativité en ce qui concerne la basicité. Le rayon atomique de l’iode est environ deux fois supérieur à celui du fluor, donc dans un ion iodure, la charge négative est répartie sur un volume nettement plus important :

Cela illustre un concept fondamental de la chimie organique :
Les charges électrostatiques, qu’elles soient positives ou négatives, sont plus stables lorsqu’elles sont « réparties » sur une plus grande surface.
Nous verrons cette idée exprimée encore et encore tout au long de notre étude de la réactivité organique, dans de nombreux contextes différents. Pour l’instant, nous appliquons le concept uniquement à l’influence du rayon atomique sur la force de base. Le fluorure étant la moins stable (la plus basique) des bases halogénées conjuguées, HF est le moins acide des acides halogénés, à peine plus fort qu’un acide carboxylique. HI, avec un \(pK_a\) d’environ -9, est presque aussi fort que l’acide sulfurique.
Plus important pour l’étude de la chimie organique biologique, cette tendance nous indique que les thiols sont plus acides que les alcools. La \(pK_a\) du groupe thiol sur la chaîne latérale de la cystéine, par exemple, est d’environ 8,3, alors que la \(pK_a\) du groupe alcool sur la chaîne latérale de la sérine est de l’ordre de 17.
Souvenez-vous du concept de » force motrice » qui a été introduit dans la section 6.2 ? Rappelez-vous que la force motrice d’une réaction est généralement basée sur deux facteurs : la stabilité relative de la charge et l’énergie totale relative des liaisons. Voyons comment cela s’applique à une simple réaction acide-base entre l’acide chlorhydrique et l’ion fluorure :
\
Nous savons que HCl (\(pK_a\) -7) est un acide plus fort que HF (\(pK_a\) 3.2), donc l’équilibre de la réaction se trouve du côté du produit : la réaction est exergonique, et une » force motrice » pousse le réactif vers le produit.
Qu’est-ce qui explique cette force motrice ? Considérons d’abord le facteur de charge : comme nous venons de l’apprendre, l’ion chlorure (du côté du produit) est plus stable que l’ion fluorure (du côté du réactif). Cela explique en partie la force motrice allant du réactif au produit dans cette réaction : nous passons d’un ion moins stable à un ion plus stable.
Qu’en est-il de l’énergie totale de liaison, l’autre facteur de la force motrice ? Si vous consultez un tableau des énergies de liaison, vous verrez que la liaison H-F du côté du produit est plus énergétique (plus forte) que la liaison H-Cl du côté du réactif : 570 kJ/mol contre 432 kJ/mol, respectivement). Cela contribue également à la force motrice : nous passons d’une liaison plus faible (moins stable) à une liaison plus forte (plus stable).