Objectifs d’apprentissage
- Décrire les caractéristiques d’un gaz.
Les trois phases (ou états) communs de la matière sont les gaz, les liquides et les solides. Les gaz ont la plus faible densité des trois, sont hautement compressibles et remplissent complètement tout récipient dans lequel ils sont placés. Les gaz se comportent ainsi parce que leurs forces intermoléculaires sont relativement faibles, de sorte que leurs molécules se déplacent constamment indépendamment des autres molécules présentes. Les solides, en revanche, sont relativement denses, rigides et incompressibles parce que leurs forces intermoléculaires sont si fortes que les molécules sont essentiellement verrouillées en place. Les liquides sont relativement denses et incompressibles, comme les solides, mais ils s’écoulent facilement pour s’adapter à la forme de leur récipient, comme les gaz. Nous pouvons donc conclure que la somme des forces intermoléculaires dans les liquides se situe entre celles des gaz et des solides. La figure 10.1.1 compare les trois états de la matière et illustre les différences au niveau moléculaire.
Figure 10.1.1 Une substance diatomique (O2) à l’état solide, liquide et gazeux
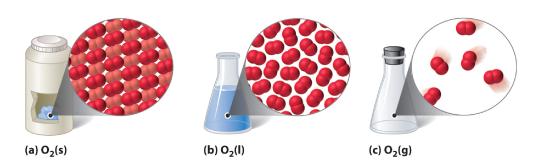
(a) L’O2 solide a un volume et une forme fixes, et les molécules sont serrées les unes contre les autres. (b) L’O2 liquide se conforme à la forme de son récipient mais a un volume fixe ; il contient des molécules relativement denses. (c) L’O2 gazeux remplit complètement son récipient – indépendamment de la taille ou de la forme du récipient – et se compose de molécules largement séparées.
L’état d’une substance donnée dépend fortement des conditions. Par exemple, H2O se trouve couramment dans les trois états : glace solide, eau liquide et vapeur d’eau (sa forme gazeuse). Dans la plupart des cas, l’eau est le liquide essentiel à la vie ; nous la buvons, nous cuisinons avec elle et nous nous baignons dedans. Lorsque la température est suffisamment froide pour transformer le liquide en glace, nous pouvons skier ou patiner dessus, l’emballer dans une boule de neige ou un cône de neige, et même construire des habitations avec. Vapeur d’eauLa distinction entre un gaz et une vapeur est subtile : le terme « vapeur » désigne la forme gazeuse d’une substance qui est un liquide ou un solide dans des conditions normales (25°C, 1,0 atm). L’azote (N2) et l’oxygène (O2) sont ainsi appelés des gaz, mais l’eau gazeuse présente dans l’atmosphère est appelée vapeur d’eau. La vapeur d’eau est un composant de l’air que nous respirons, et elle est produite chaque fois que nous chauffons de l’eau pour faire cuire des aliments ou préparer du café ou du thé. La vapeur d’eau à des températures supérieures à 100°C est appelée vapeur. La vapeur est utilisée pour faire fonctionner de grandes machines, notamment des turbines qui produisent de l’électricité. Les propriétés des trois états de l’eau sont résumées dans le tableau 10.1.1
La structure géométrique et les propriétés physiques et chimiques des atomes, des ions et des molécules ne dépendent généralement pas de leur état physique ; les molécules d’eau individuelles dans la glace, l’eau liquide et la vapeur, par exemple, sont toutes identiques. En revanche, les propriétés macroscopiques d’une substance dépendent fortement de son état physique, qui est déterminé par les forces intermoléculaires et des conditions telles que la température et la pression.
La figure 10.1.2 montre l’emplacement dans le tableau périodique des éléments que l’on trouve couramment à l’état gazeux, liquide et solide. À l’exception de l’hydrogène, les éléments qui se présentent naturellement sous forme de gaz se trouvent sur le côté droit du tableau périodique. Parmi eux, tous les gaz nobles (groupe 18) sont des gaz monatomiques, tandis que les autres éléments gazeux sont des molécules diatomiques (H2, N2, O2, F2 et Cl2). L’oxygène peut également former un deuxième allotrope, la molécule triatomique hautement réactive qu’est l’ozone (O3), qui est également un gaz. En revanche, le brome (sous forme de Br2) et le mercure (Hg) sont des liquides dans des conditions normales (25°C et 1,0 atm, communément appelées « température et pression ambiantes »). Le gallium (Ga), qui fond à 29,76°C seulement, peut être transformé en liquide simplement en tenant un récipient dans votre main ou en le gardant dans une pièce non climatisée pendant une chaude journée d’été. Les autres éléments sont tous solides dans des conditions normales.
Figure 10.1.2 Éléments qui se présentent naturellement sous forme de gaz, de liquides et de solides à 25°C et 1 atm
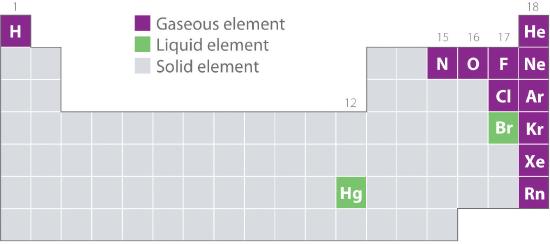
Les gaz nobles et le mercure se présentent sous forme d’espèces monatomiques, alors que tous les autres gaz et le brome sont des molécules diatomiques.
De nombreux éléments et composés que nous avons rencontrés jusqu’à présent se trouvent généralement sous forme de gaz ; certains des plus courants sont énumérés dans le tableau 10.1.2 . Les substances gazeuses comprennent de nombreux hydrures binaires, tels que les halogénures d’hydrogène (HX) ; les hydrures des chalcogènes ; les hydrures des éléments du groupe 15 N, P et As ; les hydrures des éléments du groupe 14 C, Si et Ge ; et le diborane (B2H6). En outre, de nombreux oxydes covalents simples des non-métaux sont des gaz, tels que CO, CO2, NO, NO2, SO2, SO3 et ClO2. De nombreux composés organiques de faible masse moléculaire sont également des gaz, notamment tous les hydrocarbures comportant quatre atomes de carbone ou moins et des molécules simples telles que l’éther diméthylique, le chlorure de méthyle (CH3Cl), le formaldéhyde (CH2O) et l’acétaldéhyde (CH3CHO). Enfin, les réfrigérants, tels que les chlorofluorocarbones (CFC) et les hydrochlorofluorocarbones (HCFC), sont des gaz qui peuvent être facilement liquéfiés par compression et, à leur tour, les liquides peuvent être transformés en gaz en diminuant la pression sur les liquides. Le changement de phase du liquide au gaz dans les tubes à l’intérieur du réfrigérateur refroidit, tandis que la compression dans les serpentins au fond ou à l’arrière du réfrigérateur réchauffe la pièce. L’ammoniac et le SO2 sont d’autres gaz compressibles qui ont été utilisés comme réfrigérants mais ne peuvent pas être utilisés dans les maisons en raison de leur nature toxique. L’ammoniac est encore utilisé comme réfrigérant dans les grands établissements commerciaux en raison de son efficacité et de son faible coût.
Toutes les substances gazeuses mentionnées précédemment (autres que les gaz nobles monatomiques) contiennent des liaisons covalentes ou polaires et sont des molécules non polaires ou polaires. En revanche, les fortes attractions électrostatiques des composés ioniques, tels que le NaBr (point d’ébullition = 1390°C) ou le LiF (point d’ébullition = 1673°C), les empêchent d’exister en tant que gaz à température et pression ambiantes. En outre, les membres les plus légers d’une famille donnée de composés sont très probablement des gaz, et les points d’ébullition des composés polaires sont généralement supérieurs à ceux des composés non polaires de masse moléculaire similaire. Par conséquent, dans une série donnée de composés, les membres les plus légers et les moins polaires sont ceux qui ont le plus de chances d’être des gaz. Cependant, à quelques exceptions près, les composés comportant plus d’environ cinq atomes de la période 2 ou inférieure sont trop lourds pour exister en tant que gaz dans des conditions normales.
Note the Pattern
Les substances gazeuses contiennent souvent des liaisons covalentes ou polaires, existent en tant que molécules non polaires ou légèrement polaires, ont des masses moléculaires relativement faibles et contiennent cinq atomes ou moins des périodes 1 ou 2.
Alors que les gaz ont un large éventail d’utilisations, une utilisation particulièrement sinistre d’une substance gazeuse aurait été employée par les Perses sur la ville romaine de Dura en Syrie orientale au troisième siècle de notre ère. Les Perses ont creusé un tunnel sous le mur de la ville pour y pénétrer et la conquérir. Les preuves archéologiques suggèrent que lorsque les Romains ont répondu par des contre-tunnels pour arrêter le siège, les Perses ont enflammé des cristaux de bitume et de soufre pour produire un gaz dense et toxique. Il est probable que des soufflets ou des cheminées distribuaient les fumées toxiques. Les restes d’environ 20 soldats romains ont été découverts à la base du mur de la ville, à l’entrée d’un tunnel de moins de 2 m de haut et de 11 m de long. Parce qu’il est très improbable que les Perses aient pu massacrer autant de Romains à l’entrée d’un espace aussi confiné, les archéologues supposent que les anciens Perses ont utilisé la guerre chimique pour réussir à conquérir la ville.
Exemple 10.1.1
Quels composés prédiriez-vous être des gaz à température et pression ambiantes ?
- cyclohexène
- carbonate de lithium
- cyclobutane
- oxyde de vanadium (III)
- acide benzoïque (C6H5CO2H)
Donné : composés
Demande : état physique
Stratégie:
A Décidez si chaque composé est ionique ou covalent. Un composé ionique est très probablement un solide à température et pression ambiantes, tandis qu’un composé covalent peut être un solide, un liquide ou un gaz.
B Parmi les composés covalents, ceux qui sont relativement non polaires et ont de faibles masses moléculaires sont très probablement des gaz à température et pression ambiantes.
Solution:
A Le carbonate de lithium est Li2CO3, contenant des ions Li+ et CO32-, et l’oxyde de vanadium (III) est V2O3, contenant des ions V3+ et O2-. Ces deux composés sont principalement ioniques et devraient être solides. Les trois autres composés sont tous covalents.
B L’acide benzoïque a plus de quatre atomes de carbone et est polaire, il est donc peu probable qu’il soit un gaz. Le cyclohexène et le cyclobutane sont tous deux des molécules essentiellement non polaires, mais le cyclobutane (C4H8) a une masse moléculaire nettement inférieure à celle du cyclohexène (C6H10), qui a lui aussi plus de quatre atomes de carbone. Nous prédisons donc que le cyclobutane est très probablement un gaz à température et pression ambiantes, alors que le cyclohexène est un liquide. En effet, avec un point d’ébullition de seulement 12°C, contre 83°C pour le cyclohexène, le cyclobutane est bien un gaz à température et pression ambiante.
Exercice
Quels composés prédiriez-vous être des gaz à température et pression ambiante ?
- n-butanol
- fluorure d’ammonium (NH4F)
- ClF
-
oxyde d’éthylène
- HClO4
Réponse : c ; d
Résumé
La matière en vrac peut exister sous trois états : gaz, liquide et solide. Les gaz ont la plus faible densité des trois, sont hautement compressibles et remplissent complètement leurs récipients. Les éléments qui existent sous forme de gaz à température et pression ambiantes sont regroupés sur le côté droit du tableau périodique ; ils se présentent sous forme de gaz monatomiques (les gaz nobles) ou de molécules diatomiques (certains halogènes, N2, O2). De nombreux composés inorganiques et organiques comportant quatre atomes non hydrogène ou moins sont également des gaz à température et pression ambiantes. Toutes les substances gazeuses sont caractérisées par de faibles interactions entre les molécules ou atomes constitutifs.
Key Takeaway
- Les molécules des substances gazeuses contiennent souvent des liaisons covalentes ou polaires, sont des molécules non polaires ou légèrement polaires, et ont des masses moléculaires relativement faibles.
Problèmes conceptuels
-
Expliquez les différences entre les propriétés microscopiques et macroscopiques de la matière. Le point d’ébullition d’un composé est-il une propriété microscopique ou macroscopique ? masse moléculaire ? Pourquoi ?
-
Déterminez si le point de fusion, le moment dipolaire et la conductivité électrique sont des propriétés macroscopiques ou microscopiques de la matière et expliquez votre raisonnement.
-
Comment les propriétés microscopiques de la matière influencent-elles les propriétés macroscopiques ? Pouvez-vous établir un lien entre la masse moléculaire et le point d’ébullition ? Pourquoi ou pourquoi pas ? La polarité peut-elle être liée au point d’ébullition ?
-
Pour une substance qui a des phases gazeuse, liquide et solide, classez ces phases par ordre croissant de
- densité.
- force des interactions intermoléculaires.
- compressibilité.
- mouvement moléculaire.
- ordre dans la disposition des molécules ou des atomes.
-
Expliquez ce qui ne va pas dans cette affirmation : « L’état de la matière détermine en grande partie les propriétés moléculaires d’une substance. »
-
Décrivez les facteurs les plus importants qui déterminent l’état d’un composé donné. Quelles sont les conditions externes qui influencent l’existence d’une substance dans l’un des trois états de la matière ?
-
Quels éléments du tableau périodique existent sous forme de gaz à température et pression ambiantes ? Parmi ceux-ci, quelles sont les molécules diatomiques et quelles sont les molécules monatomiques ? Quels éléments sont liquides à température et pression ambiantes ? Quelle partie du tableau périodique contient des éléments dont les hydrures binaires sont très probablement des gaz à température ambiante ?
-
L’observation suivante est-elle correcte ? « Presque tous les hydrures binaires non métalliques sont des gaz à température ambiante, mais les hydrures métalliques sont tous des solides. » Expliquez votre raisonnement.
-
L’observation suivante est-elle correcte ? « Tous les hydrures des chalcogènes sont des gaz à température et pression ambiante sauf l’hydrure binaire de l’oxygène qui est un liquide. » Expliquez votre raisonnement. Vous attendriez-vous à ce que le 1-chloropropane soit un gaz ? l’iodopropane ? Pourquoi ?
-
Expliquez pourquoi les composés ioniques ne sont pas des gaz dans des conditions normales.
Réponses
-
-
-
.
-
-
Les propriétés moléculaires d’une substance contrôlent son état de matière dans un ensemble donné de conditions, et non l’inverse. La présence de forces intermoléculaires fortes favorise un état condensé de la matière (liquide ou solide), tandis qu’une interaction intermoléculaire très faible favorise l’état gazeux. En outre, la forme des molécules dicte si une phase condensée est un liquide ou un solide.
-
-
Les éléments qui existent sous forme de gaz se trouvent principalement dans le coin supérieur droit et sur le côté droit du tableau périodique. Les éléments suivants existent sous forme de gaz : H, He, N, O, F, Ne, Cl, Ar, Kr, Xe et Rn. Ainsi, la moitié des halogènes, tous les gaz nobles et les chalcogènes et picnogènes les plus légers sont des gaz. Parmi ceux-ci, tous, à l’exception des gaz nobles, existent sous forme de molécules diatomiques. Seuls deux éléments existent sous forme liquide à une température ambiante normale de 20°C-25°C : le mercure et le brome. La partie supérieure droite du tableau périodique comprend également la plupart des éléments dont les hydrures binaires sont des gaz. En outre, les hydrures binaires des éléments des groupes 14 à 16 sont des gaz.
-
-
-
.