US Pharm. 2018;43(12):HS-2-HS-6.
ABSTRACT : Les saignements gastro-intestinaux (GIB) sont une source importante d’hospitalisations aux États-Unis. Les GIB sont classés en deux types : les saignements gastro-intestinaux supérieurs et les saignements gastro-intestinaux inférieurs. Chaque type peut présenter des signes distinctifs différents et nécessiter une prise en charge différente. Le GIB supérieur dépend du traitement endoscopique et peut bénéficier de divers traitements pharmacologiques dans des scénarios spécifiques, tels que les inhibiteurs de la pompe à protons et les macrolides. La prise en charge du GIB inférieur est axée sur la coloscopie et le traitement mécanique des saignements, avec peu d’intervention pharmacologique. Les pharmaciens peuvent fournir un service efficace à ces patients à de multiples points de soins du patient.
Les saignements gastro-intestinaux (GIB) sont un problème médical relativement courant, causant une part importante de la morbidité, des hospitalisations et même de la mortalité chaque année aux États-Unis. Le taux brut estimé d’hospitalisation secondaire à un type quelconque d’hémorragie gastro-intestinale aux États-Unis est estimé à environ 375 pour 100 000 par an.1-3 Pour les hémorragies gastro-intestinales aiguës, certaines études identifient un taux de mortalité à 30 jours pouvant atteindre 14 %, tandis que d’autres rapportent une fourchette comprise entre 6 % et 10 % par an, les taux augmentant chez les patients plus âgés et présentant un plus grand nombre de comorbidités sous-jacentes associées.4-7 On estime que plus de 2,5 milliards de dollars sont dépensés chaque année pour la prise en charge des patients hospitalisés atteints de GIB.8
En raison de la nature du GIB, il est important de différencier l’état de la maladie, car la localisation du saignement peut dicter à la fois la présentation et le traitement (TABLEAUX 1-3). Historiquement, la distinction entre le GIB supérieur (UGIB) et le GIB inférieur (LGIB) était basée sur la localisation du saignement par rapport au ligament de Treitz.9,10 Avec cette définition, un saignement proximal au ligament de Treitz est classé comme un UGIB, tandis qu’un saignement distal au ligament de Treitz est classé comme un LGIB. Bien que d’autres définitions existent dans certaines publications, cette définition est généralement établie dans la plupart des pratiques.11,12



A la présentation, le bilan de toute suspicion de GIB est initialement similaire, quelle que soit l’origine du saignement. L’évaluation immédiate doit se concentrer sur la stabilité hémodynamique du patient. Cette priorité a été bien établie dans d’autres modèles hémorragiques et reste vraie dans les cas de GIB.16-18 Une évaluation physique de la pression artérielle, de la fréquence cardiaque et de l’état orthostatique doit être effectuée, et une réanimation doit être fournie si nécessaire. Cette réanimation doit commencer par l’administration de liquides par voie intraveineuse, mais peut également nécessiter des transfusions de culots globulaires.
L’évaluation supplémentaire des patients présentant un GIB doit inclure une anamnèse ciblée visant à identifier la nature, la durée et la source potentielle du saignement, ainsi que des tests de laboratoire (NFS, BMP, études de coagulation).17,18 Lors de l’évaluation de ces patients du point de vue du pharmacien, il est important de noter toute utilisation actuelle ou récente de médicaments pouvant augmenter le risque de saignement, y compris des agents tels que les anti-inflammatoires non stéroïdiens, les antiplaquettaires et/ou les anticoagulants. L’identification précoce de ces facteurs peut aider à accélérer à la fois le diagnostic et la réponse au traitement approprié.
L’évaluation et la stratification du risque sont cliniquement utiles pour aider à distinguer les patients à haut et à faible risque de résultats indésirables.17,18 En stratifiant les patients en groupes de risque évalués, une première prise de décision éclairée peut être faite. Plus précisément, la stratification peut donner un aperçu de facteurs tels que le moment de l’endoscopie ou de la coloscopie, le niveau de soins nécessaire et le moment de la sortie. Divers outils établis sont disponibles pour aider à l’évaluation du risque individuel.
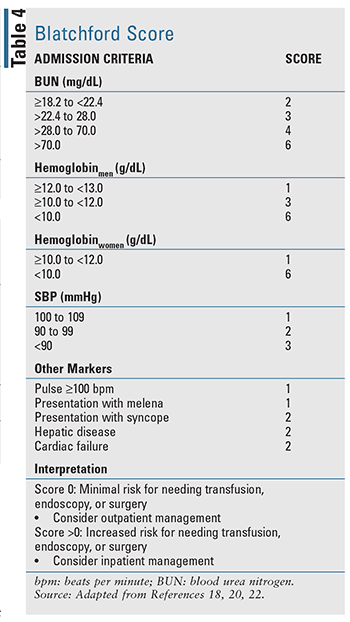
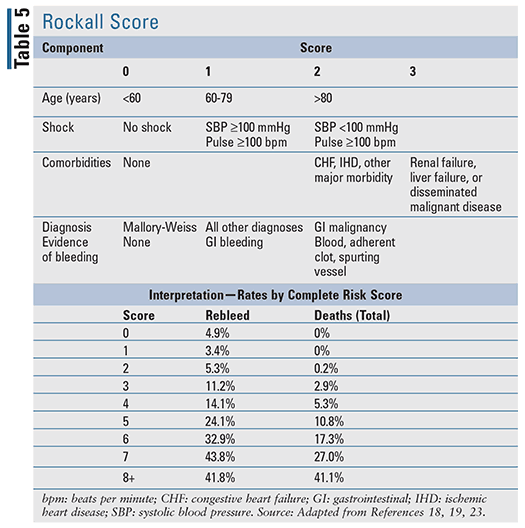
Pour les patients présentant un BIGU aigu, plusieurs outils de prédiction clinique ont été développés, y compris deux outils bien évalués cités dans les directives fondées sur des preuves : le score de Blatchford (TABLEAU 4) et le score de Rockall (TABLEAU 5).17-20 Le score de Rockall utilise les données cliniques immédiatement à la présentation.19 Les facteurs évaluant la gravité de l’hémorragie, tels que la pression artérielle systolique et la fréquence cardiaque, sont évalués parallèlement aux caractéristiques du patient, telles que l’âge et les comorbidités, ce qui permet d’obtenir un outil d’évaluation du pronostic et potentiellement de la mortalité. De même, le score de Blatchford utilise des données cliniques et de laboratoire pour aider à prédire le risque d’intervention et la mortalité.20 Pour le LGIB aigu, les règles pronostiques disponibles pour évaluer le risque sont limitées et moins validées par rapport au UGIB.22
Pharmacothérapie des hémorragies digestives hautes
Les inhibiteurs de la pompe à protons (IPP) sont la classe médicamenteuse la plus associée au traitement du UGIB. Chez un patient atteint d’UGIB, l’acide gastrique peut inhiber l’agrégation plaquettaire et affaiblir la coagulation potentielle, entraînant une altération de l’arrêt des saignements. Pour inhiber ce processus, l’inhibition de la sécrétion d’acide gastrique destinée à élever le pH de l’estomac à 6 ou plus peut aider à stabiliser les caillots et à améliorer les résultats cliniques.24
Les IPP sont uniques en ce qu’ils ont une application potentielle à la fois avant et après l’endoscopie. Dans le cadre de la pré-endoscopie, les lignes directrices ne forment pas de consensus sur leur utilisation, mais ils peuvent diminuer la proportion de patients présentant un risque élevé de stigmates d’hémorragie au moment de l’intervention.25 Malgré le bénéfice potentiel dans cette population, les données probantes suggèrent que l’utilisation des IPP n’a pas d’effet sur la re-saignement, la chirurgie nécessaire ou la mortalité, ce qui conduit à une certaine controverse clinique concernant leur application. Cependant, les patients pour lesquels l’endoscopie ne peut pas être réalisée ou sera retardée ont démontré une diminution potentielle du risque de re-saignement grâce à l’utilisation des IPP. Les preuves suggèrent que les IPP diminuent l’incidence des stigmates à haut risque d’hémorragie au moment de l’endoscopie, mais n’ont pas d’effet sur les re-saignements, la chirurgie nécessaire ou la mortalité.17,26 Après le traitement endoscopique, les IPP peuvent être utilisés de façon aiguë et chronique.17
Fusion continue versus IPP intermittent
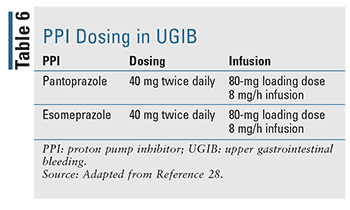
La posologie et l’administration appropriées des IPP ont été évaluées de près ces dernières années (TABLEAU 6). Un bolus IV suivi d’une perfusion a longtemps été le traitement normal et demeure le traitement de choix dans les lignes directrices actuellement disponibles, mais les données suggèrent que l’administration biquotidienne d’un bolus IV n’est pas inférieure en ce qui concerne les résultats relatifs aux saignements répétés, à la mortalité et à la durée du séjour à l’hôpital.17,27 La littérature récente a démontré que l’utilisation intermittente des IPP n’était pas inférieure et offrait un avantage clair en ce qui concerne la dose de médicament, le coût et l’utilisation des ressources. Les auteurs suggèrent que les lignes directrices soient mises à jour pour recommander un traitement intermittent par IPP dans le cadre d’un GIB traité par endoscopie.27 En pratique, de nombreuses institutions favorisent désormais une posologie intermittente afin de diminuer l’utilisation des ressources et le coût global.
Intraveineux IPP versus intraveineux antagonistes H2
Considérant que les antagonistes H2 (H2A) sont utilisés avec une intention similaire dans d’autres états pathologiques, leur utilisation dans le cadre du GIBU a été étudiée aux côtés des IPP. Une méta-analyse de 2015 évaluant les deux classes dans le cadre d’un BGCI a révélé que si la différence en termes de mortalité n’était pas significative, des résultats tels que le taux de saignement récurrent et le taux d’intervention chirurgicale présentaient un avantage clair pour les IPP. Ce déficit est probablement dû à l’infériorité des H2A pour maintenir le pH gastrique au-dessus de 6,0, le pH approximatif où les processus de coagulation peuvent fonctionner.29
Macrolides
Dans un effort pour améliorer la visualisation pendant l’endoscopie et ainsi diminuer le besoin de répéter l’endoscopie, l’érythromycine IV, un macrolide antimicrobien qui agit également comme un agent prokinétique, est couramment utilisée. Une dose unique de 250 mg ou de 3 mg/kg est généralement bien tolérée.17,30 Une méta-analyse de 2016 a conclu que l’utilisation de l’érythromycine avant l’endoscopie réduisait significativement le besoin d’une endoscopie de contrôle et la durée du séjour à l’hôpital, et elle est donc recommandée dans les directives de la Société européenne d’endoscopie gastro-intestinale.30,31
Il est juste de se demander si le bénéfice possible est un effet de classe ou spécifique à l’érythromycine. L’azithromycine, un macrolide généralement plus utilisé, a été évaluée et semble être une alternative non inférieure à l’érythromycine. L’azithromycine peut présenter certains avantages logistiques, comme le fait de ne pas devoir être reconstituée et d’être généralement plus disponible en raison de son utilisation dans le traitement empirique de la pneumonie.32
Traitement de l’H pylori
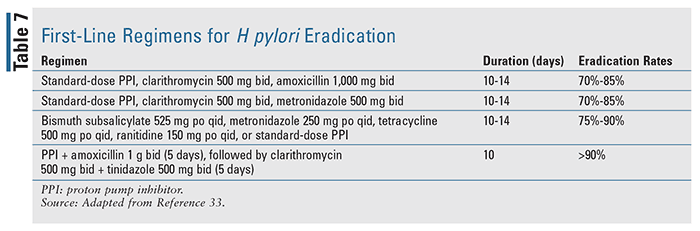
Les patients chez qui on a diagnostiqué une hémorragie associée à une infection par Helicobacter pylori doivent être traités par un traitement d’éradication basé sur des lignes directrices, avec pour objectif la résolution complète de l’infection.17 La littérature disponible indique que l’éradication de l’H pylori est significativement plus efficace que le traitement antisécrétoire seul chez les patients atteints de BGU. Les schémas thérapeutiques de première intention pour l’éradication de H pylori sont détaillés dans le TABLEAU 7, d’après les directives de l’American College of Gastroenterology sur la prise en charge de l’infection par H pylori.33 Une fois l’infection résolue, ce groupe de patients n’a généralement pas besoin de recevoir un traitement antisécrétoire d’entretien, sauf s’ils ont besoin de médicaments anti-inflammatoires non stéroïdiens ou d’un traitement antithrombotique, avec lesquels un traitement antisécrétoire à long terme est nécessaire, car leur utilisation peut augmenter considérablement le risque de resaignement.17,18
Vue d’ensemble du traitement
Après l’évaluation initiale et la stratification du risque et une fois que le patient est stable sur le plan hémodynamique, la coloscopie précédée d’un nettoyage du côlon est la procédure diagnostique initiale pour la plupart des patients présentant un LGIB.21 La prise en charge du LGIB comprend principalement des interventions non pharmacologiques ; cependant, les pharmaciens ont toujours la possibilité de participer aux soins des patients.
Application des IPP dans le LGIB
Contrairement à l’UGIB, la littérature disponible évaluant l’utilisation des IPP dans le LGIB ne montre pas de bénéfice. Les essais évaluant l’UGIB et le LGIB ont démontré que si les IPP ne démontrent pas une amélioration des résultats dans le LGIB, ils peuvent en fait augmenter le risque de LGIB.34 Les mécanismes théorisés pour ce risque accru se concentrent souvent sur les changements possibles du microbiote, et peuvent donc potentialiser le risque possible des AINS. Ces résultats se sont avérés controversés ; cependant, ils apportent la preuve que les patients atteints de LGIB ne bénéficient pas d’un traitement par IPP. Ce risque potentiel doit être soigneusement évalué chez les patients, en particulier ceux qui présentent un risque de LGIB, car il faudra peut-être évaluer soigneusement les risques par rapport aux avantages.34
Rôle du pharmacien
Les pharmaciens de nombreuses spécialités sont dans une position unique pour aider au traitement et à la gestion des patients atteints de GIB. Les pharmaciens en consultation externe sont dans une position privilégiée pour surveiller de manière proactive les facteurs de risque potentiels chez les patients, y compris les AINS à forte dose et les anticoagulants, et réduire le risque de GIB en première ligne. De plus, ils peuvent fournir des conseils importants et optimiser les doses pour les patients avant et après un diagnostic de GIB. De même, les pharmaciens cliniques des patients hospitalisés peuvent également jouer un rôle important dans le traitement du GIB. Ils peuvent être en mesure d’apporter leur aide dans plusieurs domaines au cours de l’évaluation initiale et de la prise en charge. Le bilan initial des médicaments peut révéler des détails pertinents pour le diagnostic et le traitement des patients, comme l’identification de l’utilisation d’AINS ou d’anticoagulants en ambulatoire. Les pharmaciens peuvent également fournir des recommandations à l’équipe de soins de santé concernant les médicaments qui peuvent apporter un bénéfice à chaque cas de GIB.
1. El-Tawil A. Tendances en matière de saignement gastro-intestinal et de mortalité : où en sommes-nous ? World J Gastroenterol. 2012;18(11):1154-1158.
2. Zhao Y, Encinosa W. Hospitalisations pour saignement gastro-intestinal en 1998 et 2006. Statistical Brief #65. Fiches statistiques du Healthcare Cost and Utilization Project (HCUP). Décembre 2008.
3. Whelan CT, Chen C, Kaboli P, et al. Upper versus lower gastrointestinal bleeding : a direct comparison of clinical presentation, outcomes, and resource utilization. J Hosp Med. 2010;5(3):141-147.
4. Wilcox CM, Cryer BL, Henk HJ, et al. Mortality associated with gastrointestinal bleeding events : comparing short-term clinical outcomes of patients hospitalized for upper GI bleeding and acute myocardial infarction in a US managed care setting. Clin Exp Gastroenterol. 2009;2:21-30.
5. Garcia Rodriguez LA, Ruigómez A, Hasselgren G, et al. Comparaison de la mortalité due à un ulcère gastro-duodénal entre les patients avec ou sans antécédents d’ulcère gastro-duodénal. Epidemiology. 1998;9(4):452-456.
6. Wilcox CM, Clark WS. Causes et résultats des saignements gastro-intestinaux supérieurs et inférieurs : l’expérience de l’hôpital Grady. South Med J. 1999;92:44-50.
7. Yavorski RT, Wong RK, Maydonovitch C, et al. Analysis of 3,294 cases of upper gastrointestinal bleeding in military medical facilities. Am J Gastroenterol. 1995;90:568-573.
8. Johanson JF. Curbing the costs of GI bleeding. Am J Gastroenterol. 1998;93:1384-1385.
9. Réseau écossais de directives intercollégiales (SIGN). Prise en charge des saignements gastro-intestinaux aigus supérieurs et inférieurs. Septembre 2008. www.sign.ac.uk/assets/sign105.pdf.
10. Kim, SK, Cho CD, Wojtowycz AR. Le ligament de Treitz (le ligament suspenseur du duodénum) : corrélation anatomique et radiographique. Abdom Imaging. 2008;33:395-397.
11. Matthew B, et al. Diagnostic des saignements gastro-intestinaux : un guide pratique pour les cliniciens. World J Gastrointest Pathophysiol. 2014;5(4):467-478.
12. Raju GS, et al. Déclaration de position médicale de l’Institut de l’American Gastroenterological Association (AGA) sur les saignements gastro-intestinaux obscurs. Gastroenterology. 2007;133(5):1694-1696.
13. Tielleman T, Bujanda D, Cryer B, et al. Epidemiology and risk factors for upper gastrointestinal bleeding. Gastrointest Endosc Clin N Am. 2015;25(3):415-428.
14. Rodriguez-Hernandez H, Rodríguez-Morán M, González JL, et al. Facteurs de risque associés aux saignements gastro-intestinaux supérieurs et à la mortalité. Rev Med Inst Mex Seguro Soc. 2009;47(2):179-184.
15. Strate L. Hémorragie digestive basse : épidémiologie et diagnostic. Gastroenterol Clin North Am. 2005;34(4):643-664.
16. Cocchi MN, Kimlin E, Walsh M, et al. Identification et réanimation du patient traumatisé en état de choc. Emerg Med Clin N Am. 2007;25:623-642.
17. Laine L, Jensen DM. Gestion des patients présentant des saignements d’ulcère. Am J Gastroenterol. 2012;107:345-360.
18. Siau K, Chapman W, Sharma N, et alManagement of acute upper gastrointestinal bleeding : an update for the general physician. J R Coll Physicians Edinb. 2017;47:218-230.
19. Rockall T, Logan R, Devlin H, et alÉvaluation des risques après une hémorragie gastro-intestinale supérieure aiguë. Gut. 1996;38:316-321.
20. Blatchford O, Murray W, Blatchford M. A risk score to predict need for treatment for uppergastrointestinal haemorrhage. Lancet. 2000;356:1318-1321.
21. Recio-Ramirez, JM, Sánchez-Sánchez Mdel P, Peña-Ojeda JA, et al. La capacité prédictive du score de Glasgow-Blatchford pour la stratification du risque d’hémorragie gastro-intestinale supérieure dans un service d’urgence. Revista Española de Enfermedades Digestivas. 2015;107(5):262-267.
22. Strate L, Grainek IM. Directive clinique de l’ACG : Gestion des patients présentant une hémorragie gastro-intestinale inférieure aiguë. Am J Gastroenterol. Publication anticipée en ligne le 1er mars 2016. 2016;111:459-474.
23. Bessa X, O’Callaghan E, Balleste B, et al. Applicabilité du score de Rockall chez les patients subissant un traitement endoscopique pour une hémorragie gastro-intestinale supérieure. Dig Liver Dis. 2006;38:12-17.
24. Chaimoff C, Creter D, Djaldetti M. The effect of pH on platelet and coagulation factor activities. Am J Surg. 1978;136(2):257-259.
25. Sreedharan A, Martin J, Leontiadis GI, et al. Traitement par inhibiteur de la pompe à protons initié avant le diagnostic endoscopique dans les saignements gastro-intestinaux supérieurs. Cochrane Database Syst Rev. 2010(7):CD005415.
26. Leontiadis GI , Sharma VK , Howden CW. Traitement par inhibiteur de la pompe à protons pour les saignements de l’ulcère gastro-duodénal : Méta-analyse de la collaboration Cochrane d’essais contrôlés randomisés. Mayo Clin Proc. 2007;82:286-296.
27. Sachar H, Vaidya K, Laine L, et al. Traitement intermittent vs continu par inhibiteur de la pompe à protons pour les ulcères hémorragiques à haut risque : une revue systématique et une méta-analyse. JAMA Intern Med. 2014;174(11):1755-1762.
28. Cheng H, Sheu B. Inhibiteurs de la pompe à protons intraveineux pour les ulcères gastro-duodénaux hémorragiques : avantages cliniques et limites. World J Gastrointest Endosc. 2011;3(3):49-56.
29. Zhang YS, Li Q, He BS, et al. Traitement par inhibiteurs de la pompe à protons vs traitement par antagonistes des récepteurs H2 pour les saignements gastro-intestinaux supérieurs après endoscopie : une méta-analyse. World J Gastroenterol. 2015;21(20):6341-6351.
30. Rahman R, Nguyen D, Sohail U, et al. Administration pré-endoscopique d’érythromycine dans les saignements gastro-intestinaux supérieurs : une méta-analyse mise à jour et une revue systématique. Ann Gastroenterol. 2016,29:312-317.
31. Gralnek IM, Dumonceau JM, Kuipers EJ, et al. Diagnostic et gestion de l’hémorragie gastro-intestinale supérieure non variqueuse : Directive de la Société européenne d’endoscopie gastro-intestinale (ESGE). Endoscopie. 2015;47:1-46.
32. Issa D, Solomon S, Di Pace B, et al. Une comparaison entre les perfusions d’azithromycine et d’érythromycine dans l’amélioration de la visualisation de l’endoscopie pour les hémorragies gastro-intestinales supérieures. Congrès mondial de l’ACG2017. Session 2A.
33. Chey WD, Wong BC. Comité des paramètres de pratique de l’American College of Gastroenterology. Ligne directrice de l’American College of Gastroenterology sur la gestion de l’infection à Helicobacter pylori. Am J Gastroenterol. 2007 ; 102:1808-1825.
34. Luée A, Lanas A. Traitement par inhibiteur de la pompe à protons et hémorragie gastro-intestinale basse : équilibrer les risques et les avantages. World J Gastroenterol. 2016;22(48):10477-10481.