Instabilité structurale des enzymes
Le fait que les sites actifs soient si bien adaptés pour fournir des conditions environnementales spécifiques signifie également qu’ils sont soumis aux influences de l’environnement local. Il est vrai que l’augmentation de la température de l’environnement augmente généralement les taux de réaction, qu’ils soient catalysés par des enzymes ou non. Cependant, l’augmentation ou la diminution de la température en dehors d’une plage optimale peut affecter les liaisons chimiques au sein du site actif de telle sorte qu’elles sont moins bien adaptées à la fixation des substrats. Les températures élevées finissent par provoquer la dénaturation des enzymes, comme d’autres molécules biologiques, un processus qui modifie les propriétés naturelles d’une substance. De même, le pH de l’environnement local peut également affecter la fonction enzymatique. Les résidus d’acides aminés du site actif ont leurs propres propriétés acides ou basiques qui sont optimales pour la catalyse. Ces résidus sont sensibles aux changements de pH qui peuvent altérer la façon dont les molécules de substrat se fixent. Les enzymes sont adaptées pour fonctionner au mieux dans une certaine gamme de pH et, comme pour la température, les valeurs de pH extrêmes (acides ou basiques) de l’environnement peuvent entraîner la dénaturation des enzymes.
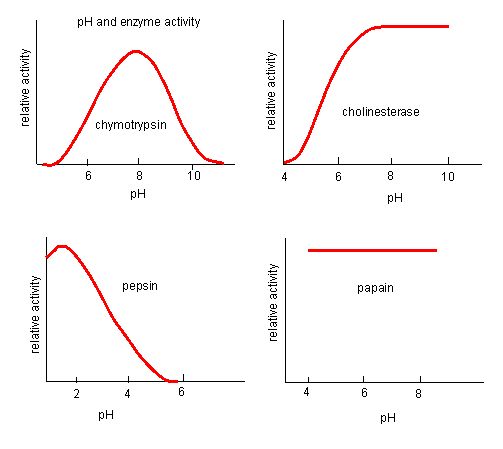
Figure 4. Les enzymes ont un pH optimal. Le pH auquel l’enzyme est la plus active sera celui où les groupes R du site actif sont protonés/déprotonés de telle sorte que le substrat puisse entrer dans le site actif et que l’étape initiale de la réaction puisse commencer. Certaines enzymes ont besoin d’un pH très bas (acide) pour être complètement actives. Dans le corps humain, ces enzymes sont très probablement situées dans le bas de l’estomac, ou situées dans les lysosomes (un organite cellulaire utilisé pour digérer les grands composés à l’intérieur de la cellule).
Source : http://biowiki.ucdavis.edu/Biochemis…_pH_Inhibition
Le processus où les enzymes se dénaturent commence généralement par le déroulement de la structure tertiaire par la déstabilisation des liaisons qui maintiennent la structure tertiaire ensemble. Les liaisons hydrogène, les liaisons ioniques et les liaisons covalentes (ponts disulfure et liaisons peptidiques) peuvent toutes être perturbées par de grands changements de température et de pH. En utilisant le tableau de l’activité enzymatique et de la température ci-dessous, faites une histoire d’énergie pour l’enzyme rouge. Expliquez ce qui pourrait se passer de 37 °C à 95 °C.
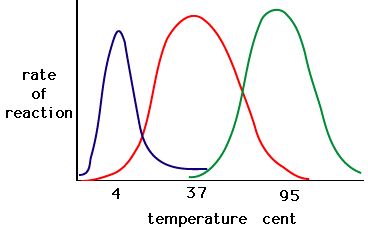
Figure 5. Les enzymes ont une température optimale. La température à laquelle l’enzyme est la plus active sera généralement la température à laquelle la structure de l’enzyme est stable ou non compromise. Certaines enzymes nécessitent une température spécifique pour rester actives et ne pas se dénaturer. Source : http://academic.brooklyn.cuny.edu/bi…ge/enz_act.htm
Emboîtement induit et fonction enzymatique
Pendant de nombreuses années, les scientifiques ont pensé que la liaison enzyme-substrat se faisait de manière simple « lock-and-key ». Ce modèle affirmait que l’enzyme et le substrat s’ajustaient parfaitement en une seule étape instantanée. Cependant, la recherche actuelle soutient une vision plus raffinée appelée « ajustement induit ». Le modèle d’ajustement induit s’étend sur le modèle « lock-and-key » en décrivant une interaction plus dynamique entre l’enzyme et le substrat. Lorsque l’enzyme et le substrat se rencontrent, leur interaction provoque un léger changement dans la structure de l’enzyme qui confirme un arrangement de liaison plus productif entre l’enzyme et l’état de transition du substrat. Cette liaison énergétiquement favorable maximise la capacité de l’enzyme à catalyser sa réaction.
Lorsqu’une enzyme se lie à son substrat, un complexe enzyme-substrat est formé. Ce complexe diminue l’énergie d’activation de la réaction et favorise sa progression rapide de l’une des nombreuses façons suivantes. À un niveau de base, les enzymes favorisent les réactions chimiques qui impliquent plus d’un substrat en réunissant les substrats dans une orientation optimale. La région appropriée (atomes et liaisons) d’une molécule est juxtaposée à la région appropriée de l’autre molécule avec laquelle elle doit réagir. Une autre façon dont les enzymes favorisent la réaction de leurs substrats est de créer un environnement énergétiquement favorable au sein du site actif pour que la réaction ait lieu. Certaines réactions chimiques peuvent se dérouler au mieux dans un environnement légèrement acide ou non polaire. Les propriétés chimiques qui émergent de l’arrangement particulier des résidus d’acides aminés au sein d’un site actif créent l’environnement énergétiquement favorable à la réaction des substrats spécifiques d’une enzyme.
L’énergie d’activation requise pour de nombreuses réactions comprend l’énergie impliquée dans la légère contorsion des liaisons chimiques afin qu’elles puissent réagir plus facilement. L’action enzymatique peut faciliter ce processus. Le complexe enzyme-substrat peut abaisser l’énergie d’activation en contorsionnant les molécules du substrat de manière à faciliter la rupture des liaisons. Enfin, les enzymes peuvent également réduire les énergies d’activation en prenant part à la réaction chimique elle-même. Les résidus d’acides aminés peuvent fournir certains ions ou groupes chimiques qui forment effectivement des liaisons covalentes avec les molécules de substrat comme étape nécessaire du processus de réaction. Dans ces cas, il est important de se rappeler que l’enzyme retournera toujours à son état initial à la fin de la réaction. L’une des propriétés caractéristiques des enzymes est qu’elles restent finalement inchangées par les réactions qu’elles catalysent. Après qu’une enzyme ait fini de catalyser une réaction, elle libère son ou ses produits.
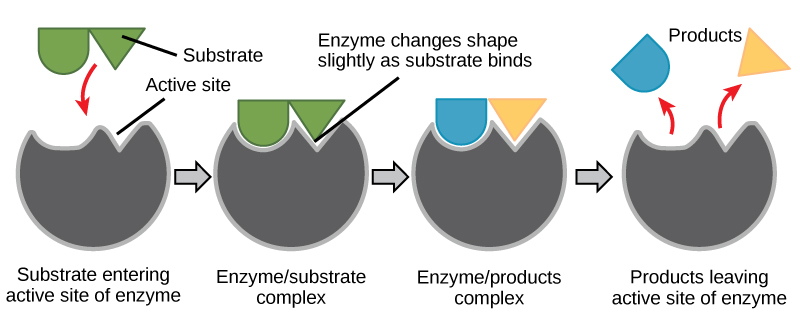
Figure 6. Selon le modèle de l’ajustement induit, l’enzyme et le substrat subissent tous deux des changements conformationnels dynamiques lors de la liaison. L’enzyme contorsionne le substrat dans son état de transition, augmentant ainsi la vitesse de la réaction.
Création d’une histoire énergétique pour la réaction ci-dessus
En utilisant la figure 6, répondez aux questions posées dans l’histoire énergétique.
1. Quels sont les réactifs ? Quels sont les produits ?
2. Quel travail a été accompli par l’enzyme ?
3. Dans quel état se trouve l’énergie au départ ? Dans quel état est transformée l’énergie à l’état final ? Celui-ci pourrait être encore délicat, mais essayez d’identifier où se trouve l’énergie dans l’état initial et dans l’état final.