24e rapport annuel sur le glaucome
Suivez les liens ci-dessous pour lire d’autres articles de la mise à jour annuelle sur le glaucome :
Soins du glaucome avec la précision du laser
Folie du MIGS : Un atlas des options
Gestion des chirurgies invasives du glaucome
Glaucome : Les modes de vie des riches et célèbres antioxydants (gagnez 2 crédits CE)
Les experts ne sont pas encore parvenus à un consensus sur une étiologie universellement acceptée du glaucome. Cependant, ils s’accordent sur ce point : la baisse de la pression intraoculaire (PIO) est le seul facteur de risque modifiable pour ralentir sa progression. La pharmacothérapie topique est l’approche traditionnelle de première intention, et les options sont plus abondantes que jamais.
Cet article, troisième partie de notre série Prenez en charge le glaucome, explore les nombreux médicaments que les DO peuvent employer, avec des conseils pour savoir quand utiliser telle ou telle thérapie pour tel ou tel patient.
L’autonomie précoce
Les médicaments qui agissent sur le système nerveux autonome (c’est-à-dire, cholinergiques et adrénergiques) sont à la base du traitement du glaucome depuis les années 1800.1,2 Les cholinergiques induisent un myosis, qui étire et stimule le maillage trabéculaire (MT) pour augmenter l’écoulement aqueux à cet endroit et vers le canal de Schlemm.3 Les membres de cette classe comprennent la pilocarpine, le carbachol, la physostigmine, la néostigmine et l’écothiophate. Parmi ceux-ci, seule la pilo est encore utilisée en routine. Le traitement présente une réponse liée à la dose avec une diminution de la PIO d’environ 20 % lorsqu’il est prescrit QID.4
Prenez en charge le glaucome
Suivez les liens ci-dessous pour lire les autres articles de notre série en quatre parties sur le glaucome :
Partie 1 : Le glaucome : Une croisade de soins primaires
Partie deux : Préparez votre boîte à outils diagnostiques
Partie quatre : Jouez un rôle dans les soins postopératoires du glaucome
Bien qu’efficace, l’utilisation des cholinergiques est limitée par ses effets secondaires oculaires et systémiques. Ceux-ci comprennent le spasme du muscle ciliaire (avec maux de tête associés et myopie induite), le myosis, la toxicité cornéenne, la rougeur, l’uvéite, la formation possible de cataracte, la dépression respiratoire et la détresse gastro-intestinale. De plus, les nouveaux médicaments ont une plus grande efficacité sur la baisse de la PIO, ce qui laisse les cholinergiques réservés à des cas spécifiques où l’effet myotique peut avoir un bénéfice supplémentaire, comme la fermeture aiguë de l’angle.
Les agonistes adrénergiques, eux, agissent sur les récepteurs alpha ou bêta adrénergiques (ou les deux s’ils sont non sélectifs). L’épinéphrine, le principal agent non sélectif, réduit la PIO en diminuant d’abord la production d’eau et en augmentant ensuite le débit à travers la MT.5 Malheureusement, son application est limitée en raison d’effets secondaires systémiques importants. La dipivefrine, un promédicament de l’épinéphrine développé dans les années 1970, permet d’utiliser des concentrations beaucoup plus faibles du composé parent, avec moins d’effets systémiques.6 Les adrénergiques non sélectifs voient une utilisation minimale aujourd’hui, sauf dans les cas où d’autres médicaments peuvent être contre-indiqués.
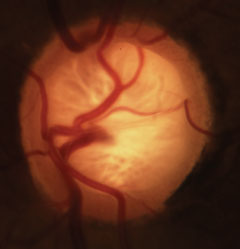
Ventouse glaucomateuse avec perte caractéristique du rebord neurorétinien, de la lamina et altération de la vascularisation. Cliquez sur l’image pour l’agrandir.
Bêta-bloquants
Les antagonistes adrénergiques, ou bêta (β)-bloquants, inhibent la production aqueuse et représentent la norme selon laquelle les nouveaux médicaments sont comparés. Plus précisément, les β-bloquants réduisent l’ultrafiltration, ce qui limite la disponibilité du substrat de l’humeur aqueuse disponible pour la transmission dans la chambre postérieure.1,7,8 Ces médicaments peuvent être non sélectifs, ce qui signifie qu’ils inhibent les deux isoformes des récepteurs β-adrénergiques (β1 et β2), ou cardiosélectifs, qui ont une affinité beaucoup plus grande pour le récepteur β1. Le β2 étant le récepteur adrénergique prédominant de l’œil, les agents non sélectifs auront un impact plus important sur le contrôle de la PIO.9,10
Les β-bloquants topiques comprennent le timolol, le lévobunolol, le métipranolol, le cartéolol et le bétaxolol. Seul le bétaxolol est cardiosélectif – ce qui le rend utile dans certaines contre-indications, mais il peut être moins efficace pour réduire la PIO.11 Lesβ-bloquants réduisent la PIO de 20 à 30% et peuvent être dosés deux fois par jour. Ils peuvent également être administrés une fois par jour, en particulier lors de l’utilisation de solutions gélifiées en raison de l’augmentation du temps de contact avec l’œil.12,13 Les antagonistes adrénergiques peuvent avoir moins d’impact pendant le sommeil, il faut donc faire attention lorsque les β-bloquants sont administrés près de l’heure du coucher, en particulier s’ils sont prescrits une fois par jour.14,15 Si les patients prennent des β-bloquants systémiques, l’effet hypotenseur oculaire des β-bloquants topiques est réduit, et d’autres classes de médicaments topiques pourraient être envisagées.16
Bien que cette classe de médicaments doive le plus souvent être évitée en cas d’affections pulmonaires ou cardiaques, dans certains cas, il peut être raisonnable d’envisager un traitement par bêta-bloquant. Cependant, cela doit être fait avec le consentement du spécialiste approprié (cardiologie ou pulmonaire).
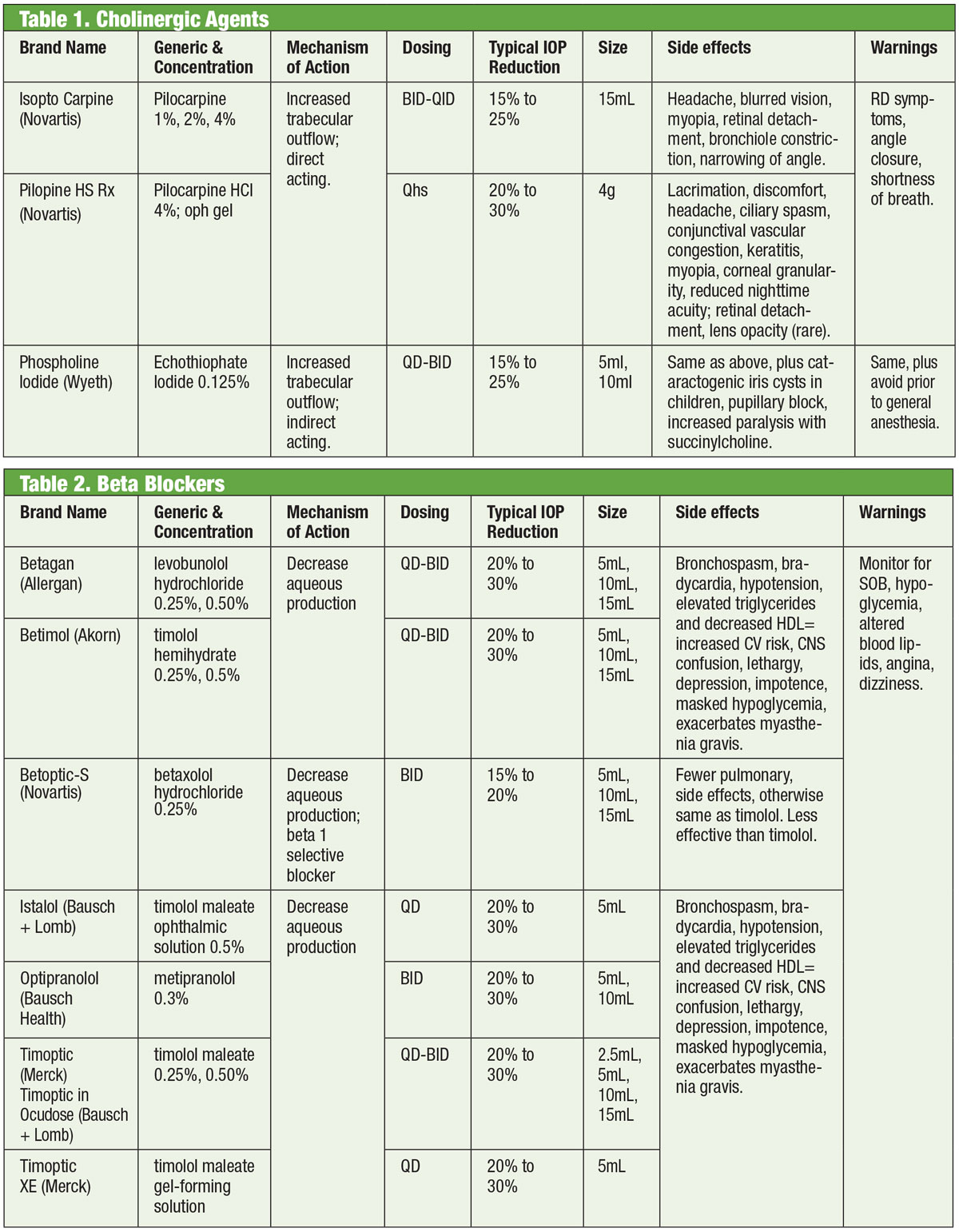
Tableaux : Bruce Onofrey, OD, RPh. Cliquez sur l’image pour l’agrandir.
Généralement, cependant, l’utilisation de β-bloquants doit être évitée chez ceux qui présentent un bloc auriculo-ventriculaire, une bradycardie sinusale et une maladie pulmonaire obstructive17.
Inhibiteurs de l’anhydrase carbonique
Les chercheurs reconnaissent la capacité des inhibiteurs de l’anhydrase carbonique (IAC) oraux à diminuer la PIO depuis les années 1950.Ils y parviennent en supprimant la production aqueuse.Cependant, les effets secondaires systémiques (tels que la fatigue, les troubles gastro-intestinaux et la paresthésie) limitent leur utilisation chronique dans le glaucome18. Les IPE oraux sont encore utilisés lorsque les IPE topiques provoquent une hypersensibilité ou lorsque l’utilisation de gouttes est exclue, ainsi que dans les cas de fermeture aiguë de l’angle.18 Les tentatives de formulation d’une variété topique ont réussi avec l’introduction du dorzolamide au milieu des années 1990 et, peu après, du brinzolamide19.
Il existe au moins sept isoenzymes différentes de l’anhydrase carbonique (AC), l’AC-II dans les processus ciliaires étant principalement impliquée dans la production aqueuse.18 Le dorzolamide et le brinzolamide sont tous deux des inhibiteurs puissants de cette isoenzyme, mais ils présentent plusieurs différences cliniquement pertinentes. Par exemple, le dorzolamide a un pH de 5,6 alors que le brinzolamide a un pH de 7,5. De plus, la brinzolamide est disponible sous forme de suspension. Ce ne sont que quelques-unes des propriétés qui peuvent expliquer les effets secondaires individuels des produits, qui peuvent inclure des picotements dans le cas du dorzolamide et une vision trouble dans le cas de la brinzolamide.19
Bien que les médicaments soient étiquetés par la FDA pour une administration TID, certains praticiens optent pour une administration BID. Dans le cas de la brinzolamide, les essais de phase III font état de réductions de la PIO cliniquement équivalentes avec les régimes BID ou TID.20 D’autres ne signalent aucune différence statistiquement significative entre la posologie BID ou TID dans le cas de la dorzolamide.18 D’autres encore préconisent la posologie TID en monothérapie et la posologie BID lorsqu’elle est utilisée comme traitement d’appoint.21
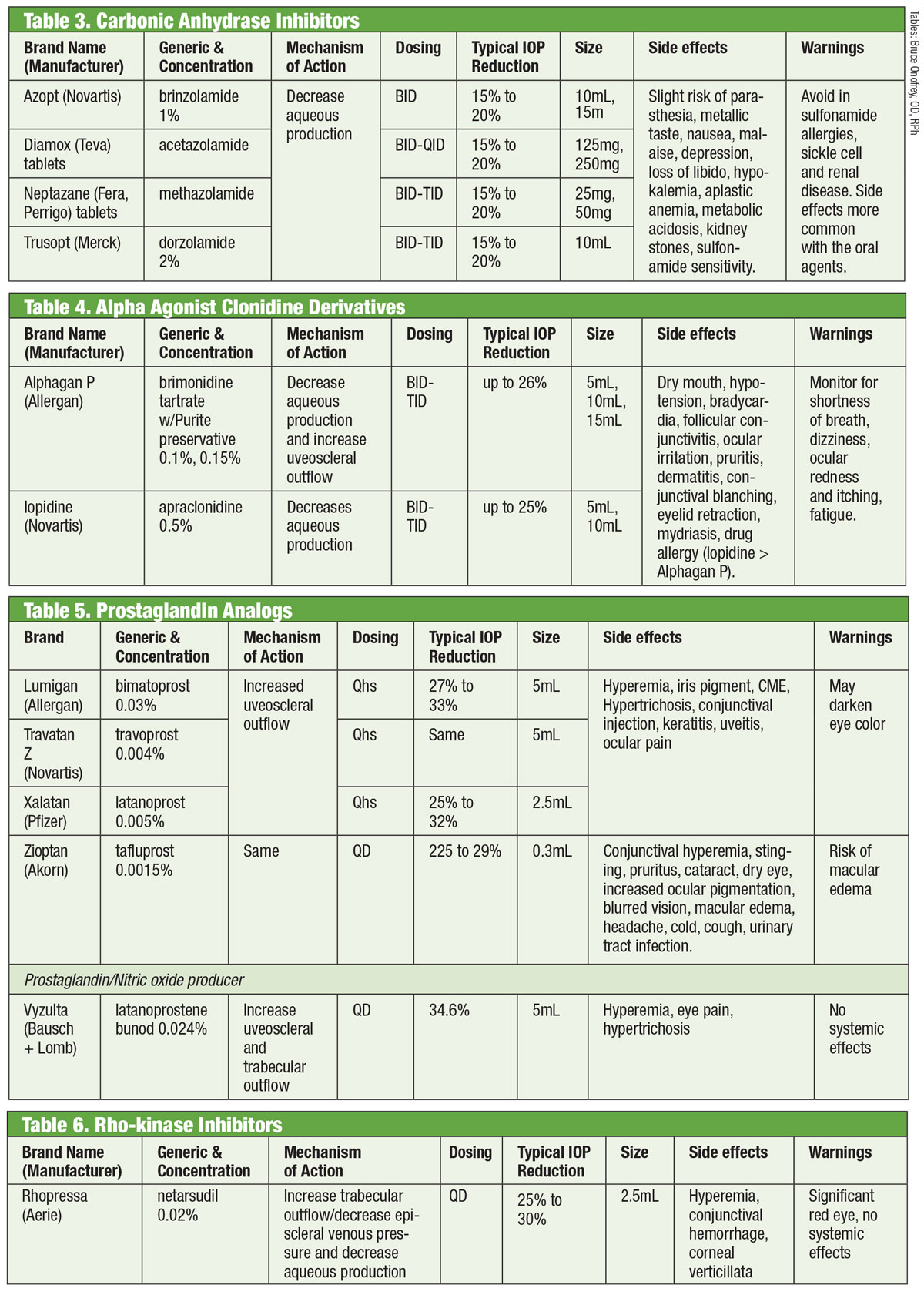
Tables : Bruce Onofrey, OD, RPh. Cliquez sur l’image pour l’agrandir.
Alpha Agonistes
La clonidine a représenté le premier alpha agoniste (AA) efficace pour abaisser la PIO. Cependant, même sous forme topique, elle produisait des effets secondaires systémiques profonds de bradycardie, de sédation et d’hypotension.22 La substitution du groupe amide de l’apraclonidine a diminué la pénétration de la barrière hémato-encéphalique, et donc les effets secondaires. Malheureusement, son efficacité diminuée dans le temps et une incidence accrue d’allergie oculaire la limitent à une utilisation à court terme.
Introduite en 1997, la brimonidine est un AA puissant, 32 fois plus sélectif pour les adrénorécepteurs β2 que l’apraclonidine.22 Elle abaisse la PIO par un double mécanisme de diminution de la production aqueuse et d’augmentation de l’écoulement uvéoscléral.23 Comme son prédécesseur, elle présente un taux d’allergie notable (jusqu’à 20 %), qui peut survenir jusqu’à huit mois après l’initiation du traitement.22 Trois formulations ont été développées, chacune ayant une efficacité similaire : 0,2 % avec du chlorure de benzalkonium (BAK) ; et 0,15 % et 0,1 % avec le conservateur Purite.24 Allergan a depuis abandonné la formulation conservée au BAK.
The Straight Dope
La marijuana médicale a fait beaucoup de nouvelles ces derniers temps, grâce à un certain nombre de changements législatifs aux États-Unis. Bien qu’elle ait fait l’objet de recherches pour réduire la PIO depuis les années 1970, les chercheurs ont constaté qu’elle n’était capable de réduire la PIO que pendant de brèves périodes. Ceci, ajouté à son profil d’effets secondaires plutôt lourd, en fait un mauvais candidat pour le traitement. Cependant, la recherche indique qu’elle pourrait avoir un rôle à jouer pour « les patients atteints de glaucome en phase terminale qui ont échoué à la thérapie médicale maximale et à la chirurgie ou qui sont de mauvais candidats à la chirurgie. »
Sun X, Xu C, Chadha N,et al. Marijuana pour le glaucome : une recette pour le désastre ou le traitement ? Yale J Biol Med. 2015 Sep ; 88(3) : 265-9.
Bien que les effets secondaires soient surtout corrélés à l’utilisation de prostaglandines, la littérature montre une uvéite antérieure induite par la brimonidine.25 La durée varie de sept jours à cinq ans avec une moyenne de près de 20 mois.
Analogues de la prostaglandine
Ils procurent la réduction de la PIO la plus robuste de toutes les gouttes en augmentant l’écoulement aqueux uvéoscléral. Les analogues de la prostaglandine (PGA) se lient à des récepteurs dans le corps ciliaire et induisent une relaxation du muscle lisse, et modifient la matrice extracellulaire dans le muscle ciliaire pour augmenter l’écoulement aqueux par les voies uvéosclérales26. Administrés une fois par jour, généralement au coucher, les PGA permettent de réduire la PIO de 30 à 35 % ; les options comprennent le latanoprost, le bimatoprost, le travoprost et le tafluprost (fournis en dose unique, sans conservateur).26 L’effet secondaire le plus courant des PGA est l’hyperémie conjonctivale, souvent au cours des premières semaines après le début du traitement.26 On peut également observer une irritation oculaire, une exacerbation des états inflammatoires existants (œdème maculaire, iritis), une atrophie du coussinet adipeux périorbitaire, une pigmentation de la peau périoculaire, des cils et de l’iris et une hypertrichose.26
Une nouvelle variante dans la catégorie des analogues de la prostaglandine est le latanoprostène bunod 0,024%. Ce composé a un double mécanisme : augmenter le débit uvéoscléral et améliorer le débit du réseau trabéculaire par l’impact de l’oxyde nitrique.27 L’œil décompose le latanoprostène bunod deux fois pour donner les composants actifs, l’acide latanoprost et l’oxyde nitrique.28 Ce dernier a un impact sur une voie de signalisation qui détend les composants contractiles de la MT, ce qui augmente le débit.28 L’impact supplémentaire fait baisser la PIO de >1 mm Hg par rapport au latanoprost seul sur plusieurs points dans le temps, avec une réduction totale de la PIO allant de 7,5 mm Hg à 9,1 mm Hg. Les effets secondaires du latanoprostène bunod étaient comparables à ceux du latanoprost seul, avec peut-être moins de pigmentation périoculaire et d’hypertrichose, selon les investigateurs.28,29
Inhibiteurs de CROCK
Dans un œil normal, la principale voie de drainage de l’humeur aqueuse est le TM. La résistance à l’humeur aqueuse à travers cette structure est accrue chez les patients atteints de glaucome, ce qui augmente la PIO.30 Jusqu’à récemment, les médicaments contre le glaucome ne parvenaient pas à cibler cette structure. Cela a changé en 2017 avec l’introduction de Rhopressa (netarsudil 0,02%, Aerie), un inhibiteur de la rho-kinase (ROCK).
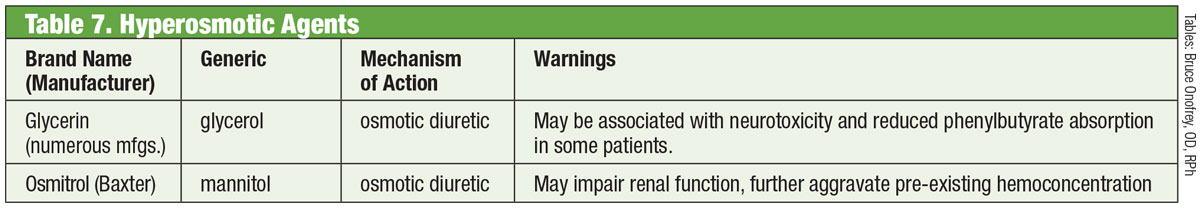
Tableau : Bruce Onofrey, OD, RPh. Cliquez sur l’image pour l’agrandir.
La rho-kinase est largement exprimée dans de nombreux tissus, y compris la MT, où elle favorise l’assemblage des fibres de contrainte d’actine et régule la contraction cellulaire31. Les inhibiteurs de ROCK augmentent l’écoulement aqueux en diminuant la contraction cellulaire induite par l’actine et la myosine et en réduisant la production de protéines de la matrice extracellulaire.32 Rhopressa a également une action inhibitrice sur le transporteur de noradrénaline (NET), ce qui en fait un inhibiteur de ROCK/NET. Le mécanisme NET peut résulter d’une réduction du flux sanguin vers le corps ciliaire par le biais d’une vasoconstriction induite par la noradrénaline, ce qui entraîne une diminution de la production aqueuse.33 En outre, le nétarsudil diminue également la pression veineuse épisclérale (PVE), offrant ainsi de multiples voies pour la réduction de la PIO.32 L’effet secondaire oculaire le plus courant est l’hyperémie oculaire (environ la moitié des patients traités), qui, pour la plupart, est légère, transitoire et se résout d’elle-même.32
À noter que la rho elle-même joue un rôle important dans la croissance et le guidage de l’axone, ainsi que dans la régulation de la survie et de la mort des neurones.34 Les chercheurs ont constaté qu’après une lésion du nerf optique, l’application topique de nétarsudil réduit la mort des cellules ganglionnaires rétiniennes et favorise la régénération axonale.34
Mettre la main à la pâte
Parfois, les patients ont besoin de plus que ce que les produits en vente libre offrent. La sensibilité des patients ou la toxicité de la surface oculaire due à l’utilisation chronique de conservateurs peuvent conduire à la recherche d’alternatives. Certains médicaments composés sont disponibles sans conservateur. Si l’observance est un problème, ces mélanges peuvent contenir jusqu’à quatre médicaments dans un seul flacon. En outre, de nombreuses combinaisons fixes ont été utilisées efficacement en dehors des États-Unis, mais ne sont pas actuellement approuvées par la FDA ; la préparation en pharmacie permet aux médecins américains d’accéder à ces régimes. Si le coût est une limitation, la préparation pourrait être un avantage supplémentaire. Bien que le produit composé ne soit souvent pas couvert par le régime d’assurance du patient, le prix d’un ou deux produits combinés peut être plus rentable que celui de plusieurs options de médicaments uniques, même les formulations génériques. Deux pharmacies de préparation offrent de multiples variations préétablies : Simple Drops d’Imprimis Pharmaceuticals et la ligne de produits Omni d’Ocular Science. Des personnalisations supplémentaires sont également possibles chez chacun d’eux.
Bien que les agents individuels soient approuvés par la FDA, certaines combinaisons particulières peuvent ne pas l’être. C’est au praticien de peser les risques et les avantages de la conformité.
Produits composés pour le glaucome :
Gouttes de limon (Imprimis Pharmaceuticals)
Tous disponibles sans conservateur.
– Tim-Lat PF (timolol/latanoprost)
– Brim-Dor PF (brimonidine/dorzolamide)
– Tim-Brim-Dor PF (timolol/brimonidine/dorzolamide)
– Tim-Dor-Lat PF (timolol/dorzolamide/latanoprost)
– Tim-…Brim-Dor-Lat PF (timolol/brinzolamide/dorzolamide/latanoprost)
– Dor-Tim (dorzolamide/timolol)
– Dorzolamide PF
– Latanoprost PF
Omni Drops (Ocular Science)
Contenant du chlorure de benzalkonium, mais à des concentrations plus faibles (0.001%) que les formulations génériques courantes (0,002%).
– Timolol/latanoprost
– Timolol/brimonidine/dorzolamide (formule AM)*
– Timolol/brimonidine/dorzolamide/latanoprost (formule PM)*
* Destinés à être utilisés à l’unisson, la version AM étant dépourvue de la prostaglandine, qui est couramment dosée une seule fois par jour.
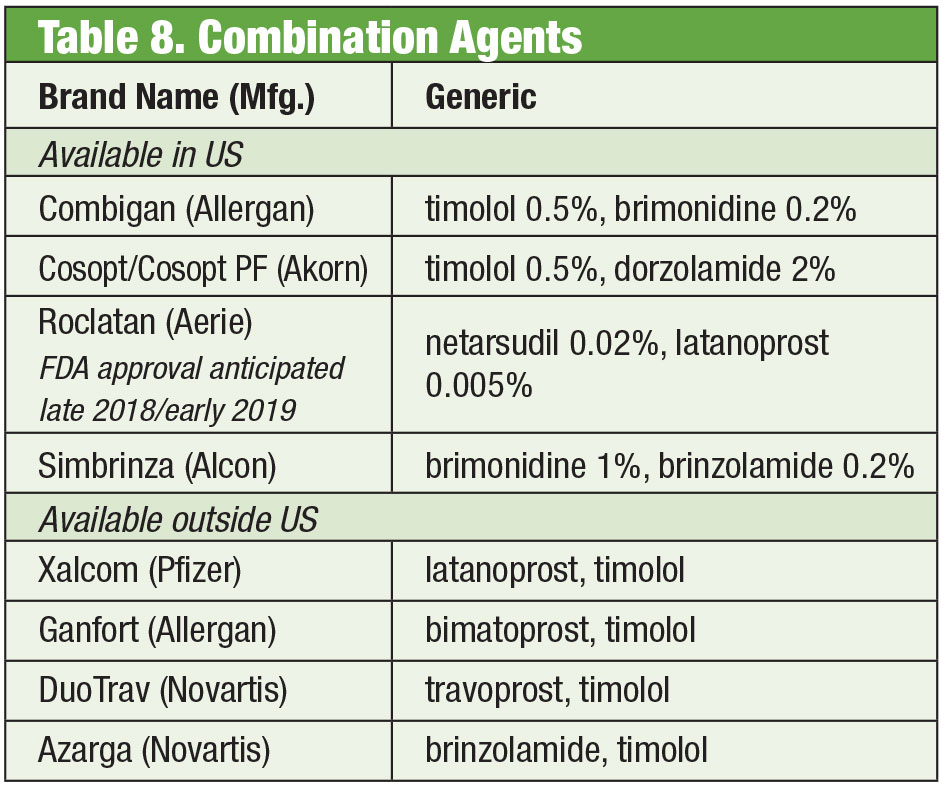
Produits d’association fixe
Malgré l’efficacité de ces produits individuels, il est fréquent que de nombreux patients atteints de glaucome aient besoin de plusieurs thérapies pour contrôler leur état35. Lorsque la bithérapie est nécessaire, il peut être préférable de proposer le même distributeur, favorisant une meilleure observance et réduisant l’impact de la toxicité sur la surface oculaire.36 Le timolol est associé à la brimonidine (sous la marque Combigan, Allergan) et au dorzolamide (sous la marque Cosopt, Akorn), tous deux administrés deux fois par jour, avec une option sans conservateur disponible pour le produit timolol-dorzolamide. Une autre association biquotidienne – Simbrinza – associe la brimonidine et le dorzolamide. Les combinaisons fixes montrent une bonne efficacité à la fois comme traitement primaire et en complément des PGA. Les effets secondaires sont comparables à ceux des composants individuels.
Homologation/Perception du patient
Bien que la décision de recommander un traitement puisse être complexe et dépende de nombreux facteurs, une fois que le médecin et le patient acceptent d’initier un traitement, certains faits de base doivent être reconnus et des principes fondamentaux doivent être employés.
Cliquez sur l’image pour l’agrandir.
La progression du champ visuel et la gravité de la maladie sont liées à une mauvaise observance du traitement37. Selon une étude, les patients atteints de maladies chroniques utilisent, en moyenne, de 30 à 70 % des doses de médicaments qui leur sont prescrites, et 50 % d’entre eux abandonnent leurs médicaments au cours des premiers mois de traitement38 . L’observance des médicaments contre le glaucome est aussi faible que celle d’autres maladies chroniques38 . Par conséquent, il peut exister un écart entre l’efficacité et l’efficience où, bien qu’il ait été prouvé que les médicaments topiques sont efficaces dans les grandes études cliniques, dans la pratique, ils peuvent être inefficaces en raison de la non-observance du patient.39
Les principaux facteurs qui contribuent à la mauvaise observance dans le glaucome sont, entre autres, le profil des effets secondaires des médicaments, le coût du traitement, l’éducation du patient et la relation médecin-patient.40 En outre, la maladie peut être asymptomatique jusqu’à un stade tardif de son évolution, avec une méconnaissance de la perte du champ visuel.41
Et maintenant, pour quelque chose de complètement différent
Les médicaments constituent l’épine dorsale de la prise en charge du glaucome depuis bien plus d’un siècle, et le développement de nouveaux médicaments se poursuit sans relâche. Mais certains chercheurs cherchent des alternatives au-delà du flacon. Des lunettes équipées d’une bobine électromagnétique, associées à une lentille de contact contenant une trace d’or, pourraient un jour contribuer à réduire la PIO. Développé par une société appelée Bionode, le combo est conçu pour générer un courant électrique qui circule dans les muscles ciliaires pour stimuler la voie de drainage naturelle et diminuer la PIO.
Académie américaine d’ophtalmologie. Les lunettes pourraient un jour traiter le glaucome. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Consulté le 3 juillet 2018.
Un obstacle supplémentaire à l’observance est la difficulté à instiller les gouttes et à respecter le schéma posologique.42 En effet, jusqu’à 80 % des patients contaminent leurs gouttes en se touchant le visage, jusqu’à 61 % n’instillent pas exactement une goutte et, plus grave encore, jusqu’à 37 % manquent l’œil avec la goutte.43 Le praticien ne doit jamais supposer que le patient maîtrise l’instillation des gouttes. Avant de commencer le traitement par gouttes, il faut enseigner au patient comment instiller les gouttes de manière appropriée et lui demander de faire une démonstration d’instillation avant de quitter le cabinet. Cette tâche peut être déléguée à un technicien optométrique et renforcée par un document éducatif sur la technique (PDF imprimable sur www.glaucoma.org/treatment/eyedrop-tips.php) ainsi que par l’utilisation de vidéos telles que celle produite par la Glaucoma Research Foundation (www.glaucoma.org/treatment/putting-in-eye-drops.php).
Si le patient a des difficultés importantes à instiller les gouttes ophtalmiques, une aide au dosage mécanique peut améliorer les chances de réussite. L’adhésion au schéma posologique correct s’améliore avec l’utilisation de rappels automatisés basés sur la télécommunication, d’applications de rappel sur smartphone et tablette.44,45 Une combinaison d’éducation en cabinet, de fixation d’objectifs, de schéma de gouttes simplifié et de technologie devrait être adoptée pour améliorer l’adhésion.46 S’attaquer aux obstacles connus à l’adhésion aux médicaments est une première étape nécessaire vers le succès.
Baisser la pression
La PIO est le seul facteur de risque glaucomateux modifiable connu et il est indéniablement prouvé que sa baisse réduit le risque de progression de la maladie.47,48 Abaisser efficacement la PIO devient donc l’objectif de la prise en charge des patients atteints de glaucome. Une fois la maladie classée avec précision, un objectif thérapeutique est généralement fixé. Les modèles de pratique préférés aux États-Unis suggèrent l’utilisation d’une plage de PIO cible qui, selon le clinicien, réduira prospectivement le risque de cécité à vie des patients tout en minimisant la charge liée au traitement.49-52
Bien que de multiples méthodologies puissent aider à déterminer une PIO cible initiale (PIO seuil, calculée, taille unique), la méthode la plus simple et la plus fondée sur les preuves consiste à réduire la PIO d’un pourcentage par rapport à la PIO diurne de pointe de base à laquelle les dommages au nerf optique se produisent. La PIO est dynamique et présente des fluctuations à court et à long terme, ce qui fait que la tonométrie actuellement disponible n’est pas parfaitement reproductible. C’est pourquoi il est recommandé au clinicien d’obtenir plusieurs lectures de la PIO à différents moments de la journée avant d’initier le traitement pour tenter d’établir un pic diurne de PIO à partir duquel établir la plage cible.53-55 Cependant, à moins d’obtenir plusieurs courbes de PIO sur 24 heures, il est peu probable qu’un véritable pic soit jamais capturé. En fin de compte, le clinicien devra évaluer la réussite du traitement en réduisant le taux de progression des tests structurels et fonctionnels.48,56,57
Les réductions cibles recommandées de la PIO en pourcentage varient de 20 % à 50 % selon l’affection (c’est-à-dire, suspect de glaucome, hypertension oculaire, glaucome à tension normale, glaucome à haute tension, glaucome à angle fermé) de la gravité de la maladie de base et de l’espérance de vie.58-61
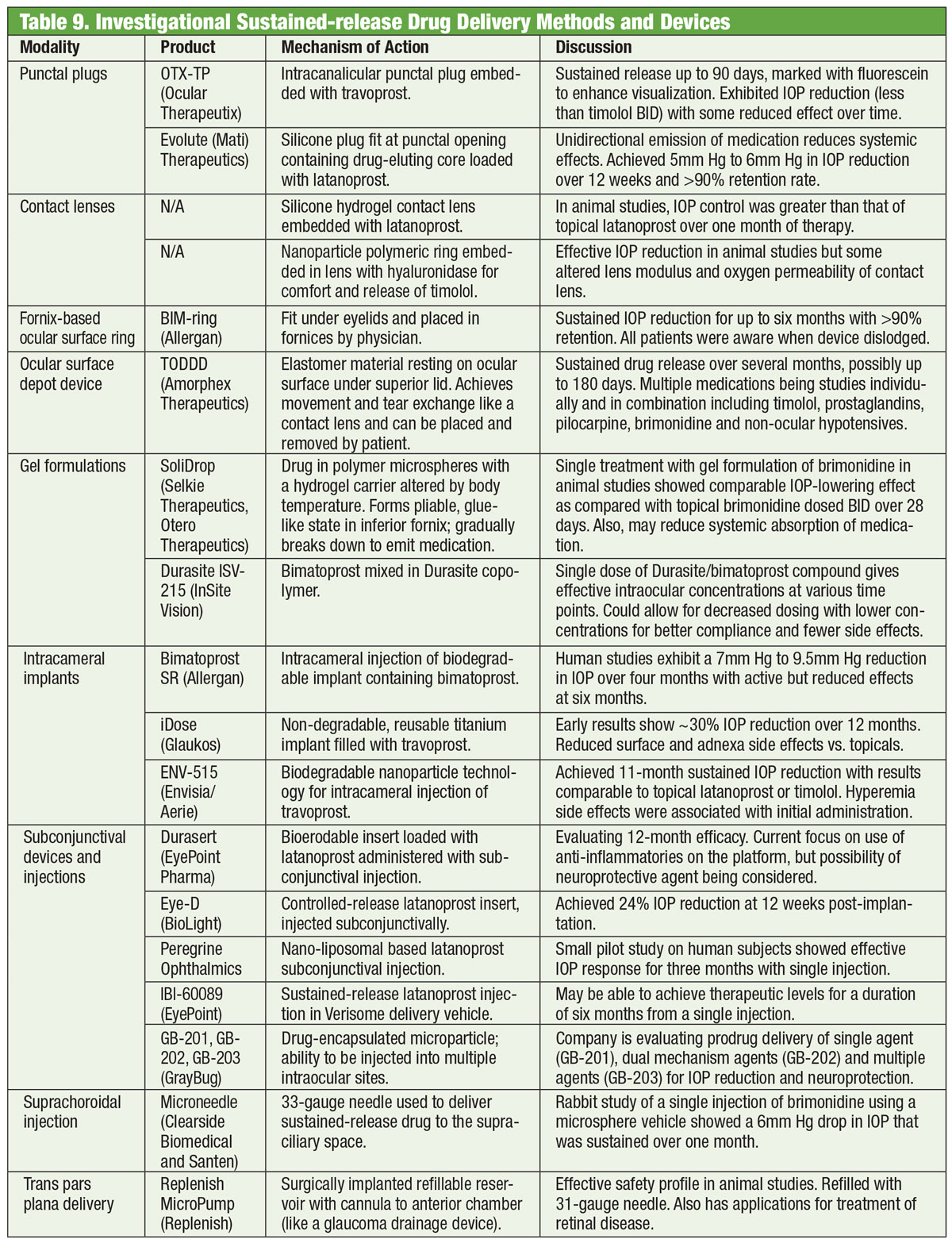
Tableau : Bruce Onofrey, OD, RPh. Cliquez sur l’image pour l’agrandir.
Pour commencer
Les AGP sont approuvés pour le traitement de première intention aux États-Unis et sont plus efficaces pour abaisser la PIO, ont un profil d’effets secondaires relativement limité et sont dosés moins fréquemment (une fois par jour) que les autres classes de médicaments62,63.
Une fois qu’un agent spécifique est sélectionné, le patient doit être revu dans un délai maximum de quatre semaines afin de jauger l’efficacité de la goutte, de parer à tout événement indésirable qui pourrait survenir, d’assurer l’adhésion du patient et de renforcer la valeur du traitement.
En définitive, une éducation appropriée et un suivi vigilant avec des tests structurels et fonctionnels permettront de minimiser la perte de vision.
Le Dr Dorkowski est le coordonnateur clinique du programme de maisons de retraite et d’aide à la vie autonome à SCO.
Le Dr Williamson est le superviseur de la résidence au centre médical VA de Memphis.
Le docteur Rixon est un titulaire au VA de Memphis et est membre de la société optométrique du glaucome.
Le Dr Onofrey est l’auteur du manuel de thérapeutique oculaire.
1. Zimmerman TJ, William P. BogerIII. Les agents bloquants bêta-adrénergiques et le traitement du glaucome. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. Une histoire de la pharmacologie du glaucome. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Effets directs des agents muscariniques sur les voies d’écoulement dans les yeux humains. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. The dose response of human intraocular pressure to pilocarpine. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. Le mécanisme d’action des médicaments adrénergiques dans le glaucome. Investig Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalyl épinéphrine : un nouveau pro-drogue dans le traitement du glaucome. Ophtalmologie. 1978;85(3):268-75.
7. Neufeld AH. Études expérimentales sur le mécanisme d’action du timolol. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. Le mécanisme du timolol dans la baisse de la pression intraoculaire : dans l’œil normal. Arch Ophthalmol. 1978;96(11):2045-8.
9. Trope GE, Clark B. Récepteurs bêta adrénergiques dans les processus ciliaires pigmentés. Br J Ophthalmol. 1982;66:788-92.
10. Cire MB, Molinoff PB. Distribution et propriétés des récepteurs bêta-adrénergiques dans l’iris-corps ciliaire humain. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Walker AM, Epstein DL. Une comparaison à double insu entre le bétaxolol et le timolol dans le traitement du glaucome à angle ouvert. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Les bêta-bloquants ophtalmiques depuis le timolol. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. Évaluation du timolol dans le glaucome chronique à angle ouvert : Une fois par jour vs deux fois par jour. Arch Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. Effets du timolol, de l’épinéphrine et de l’acétazolamide sur le flux aqueux pendant le sommeil. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. Variation circadienne de la pression intraoculaire avec les bêta-bloquants. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. Effets du traitement systémique par bêta-bloquant sur l’efficacité et la sécurité de la brimonidine et du timolol topiques. Groupes d’étude 1 et 2 sur la brimonidine. Ophthalmology. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaucome et maladies systémiques. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. Propriétés pharmacologiques et hypotensives oculaires des inhibiteurs topiques de l’anhydrase carbonique. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Topical drug delivery to the eye : dorzolamide. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamide suspension ophtalmique : une revue de sa pharmacologie et de son utilisation dans le traitement du glaucome à angle ouvert et de l’hypertension oculaire. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. Comparaison de l’effet additif de réduction de la pression intraoculaire du latanoprost et du dorzolamide lorsqu’ils sont ajoutés au timolol chez les patients atteints de glaucome à angle ouvert ou d’hypertension oculaire : une étude randomisée, ouverte et multicentrique en Grèce. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. Incidence de l’allergie à la brimonidine chez les patients précédemment allergiques à l’apraclonidine. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. Efficacité et sécurité de la brimonidine comme traitement d’appoint pour les patients ayant une pression intraoculaire élevée dans un grand essai communautaire ouvert. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidine-purite 0,1% versus brimonidine-purite 0,15% deux fois par jour dans le glaucome ou l’hypertension oculaire : un essai randomisé de 12 mois. Curr Med Res Opin. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Uvéite antérieure induite par la brimonidine. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Kaufman PL. Mise à jour sur le mécanisme d’action des prostaglandines topiques pour la réduction de la pression intraoculaire. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. Efficacité du bunod latanoprostène 0,024% par rapport au timolol 0,5% dans la réduction de la pression intraoculaire sur 24 heures. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprostène bunod solution ophtalmique 0,024% pour la baisse de la PIO dans le glaucome et l’hypertension oculaire. Expert Opin Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. Comparaison du bunod de latanoprostène 0,024% et du maléate de timolol 0,5% dans le glaucome à angle ouvert ou l’hypertension oculaire : The LUNAR study. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. Le réseau trabéculaire : Un examen de base de la forme et de la fonction. J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-2838-02-0017. Consulté le 29 juin 2018.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. Découverte de l’inhibiteur ROCK netarsudil pour le traitement du glaucome à angle ouvert. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. Deux essais cliniques de phase 3 comparant l’innocuité et l’efficacité du nétarsudil au timolol chez les patients ayant une pression intraoculaire élevée : rho kinase elevated iop treatment trial 1 et 2 (ROCKET-1 et ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. Découverte et développement préclinique du netarsudil, un nouvel agent hypotenseur oculaire pour le traitement du glaucome. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Wang Y, et al. L’administration topique d’un inhibiteur de rock/net favorise la survie des cellules ganglionnaires rétiniennes et la régénération des axones après une lésion du nerf optique. Exp Eye Res. 2017;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Modèles de traitements adjuvants chez les patients atteints de glaucome utilisant des analogues de la prostaglandine. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Combinaisons fixes. Glaucome aujourd’hui. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Scudeller L, et al. Les taux d’adhésion et la progression du champ visuel glaucomateux sont-ils corrélés ? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Utilisation des données des réclamations pharmaceutiques pour étudier l’adhésion aux médicaments du glaucome : méthodologie et résultats de l’étude Glaucoma Adherence and Persistency Study (GAPS). Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Stamper R, et al. Effectiveness of intraocular pressure-lowering medication determined by washout. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. Pourquoi les gens deviennent-ils (encore) aveugles à cause du glaucome ? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. Un point de vue sur le glaucome-Est-ce que nous le voyons clairement ? Eye. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. Les obstacles les plus courants à l’adhésion aux médicaments contre le glaucome : A cross-sectional survey. Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Instillation de gouttes et glaucome. Curr Opin Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Rappels automatisés basés sur la télécommunication et adhésion à la posologie uniquotidienne des médicaments contre le glaucome : The automated dosing reminder study. JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. L’application Wills eye glaucoma : Intérêt des patients et de leurs soignants pour une application sur smartphone et tablette pour le glaucome. J Glaucoma. 2016;25(9):e787-e791.
46. Joseph A, Pasquale LR. Attributs associés à l’adhésion au traitement médical du glaucome et ses effets sur les résultats du glaucome : Un examen fondé sur des preuves et des stratégies potentielles pour améliorer l’adhésion. Semin Ophthalmol. 2017;32(1):86-90.
47. Clement CI, Bhartiya S, Shaarawy T. New perspectives on target intraocular pressure. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Personnalisation de la pression intraoculaire : pression intraoculaire cible dans le cadre de la surveillance de la pression intraoculaire sur 24 heures. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. La pression cible dans le traitement du glaucome. J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. Prise en charge du patient atteint de glaucome à angle ouvert. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Abaissement agressif précoce de la pression intraoculaire, pression intraoculaire cible, et un nouveau concept pour les soins du glaucome. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr. BE, Rosenberg LF, Gedde SJ, et al. Lignes directrices du modèle de pratique préférée pour le glaucome primaire à angle ouvert. Ophtalmologie. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. Les modèles de pression intraoculaire diurne ne sont pas répétables à court terme chez les individus sains. Ophtalmology. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhDemail, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. Long-term reproducibility of diurnal intraocular pressure patterns in patients with glaucoma. Ophtalmologie. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Variabilité journalière de la pression intraoculaire dans le glaucome et l’hypertension oculaire. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Utilité clinique de la surveillance de la pression intraoculaire en dehors des heures normales de bureau chez les patients atteints de glaucome. Arch Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Peak intraocular pressure and glaucomatous progression in primary open-angle glaucoma. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study : un essai randomisé détermine que les médicaments hypotenseurs oculaires topiques retardent ou préviennent l’apparition du glaucome primaire à angle ouvert. Arch Ophthalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Reduction of Intraocular Pressure and Glaucoma Progression : Résultats de l’essai Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. The advanced glaucoma intervention study (AGIS) : La relation entre le contrôle de la pression intraoculaire et la détérioration du champ visuel. Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Progression du champ visuel dans l’étude collaborative de traitement initial du glaucome. L’impact du traitement et d’autres facteurs de base. Ophtalmology. 2009;116(2):200-207.e1.
62. Albert A. Le latanoprost dans le traitement du glaucome. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. Impact de l’introduction du latanoprost générique sur l’adhésion au traitement du glaucome. Ophthalmology. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. Une comparaison randomisée et contrôlée du latanoprostène bunod et du latanoprost 0,005% dans le traitement de l’hypertension oculaire et du glaucome à angle ouvert : L’étude VOYAGER. Br J Ophthalmol. 2015;99(6):738-45.