Le cancer est le résultat de la rupture des contrôles qui régulent les cellules. Les causes de cette défaillance comprennent toujours des changements dans des gènes importants. Ces changements sont souvent le résultat de mutations, des changements dans la séquence d’ADN des chromosomes. Les mutations peuvent être de très petits changements, n’affectant que quelques nucléotides, ou elles peuvent être très importantes, entraînant des changements majeurs dans la structure des chromosomes.
Les petites et grandes mutations peuvent toutes deux affecter le comportement des cellules. Des combinaisons de mutations dans des gènes importants peuvent conduire au développement d’un cancer. Les éléments abordés sur cette page décrivent la relation entre mutation et cancer, les différents types de mutations et leurs causes. De plus amples informations sur les sujets de cette page peuvent également être trouvées dans la plupart des manuels d’introduction à la biologie, nous recommandons Campbell Biology, 11e édition.1
Sujets de cette page :
- Mutation et cancer
- Mutations héréditaires et cancer
- Types de mutation
- Mutations ponctuelles
- Translocations
- Amplification génique
- Inversions, délétions et duplications
- Aneuploïdie
- Modifications épigénétiques
- Causes de la mutation
- Résumé de la mutation
- Connaître le flux : Mutation
Mutation et cancer
Les comportements anormaux dont font preuve les cellules cancéreuses sont le résultat d’une série de mutations dans des gènes régulateurs clés. Les cellules deviennent progressivement plus anormales au fur et à mesure que des gènes sont endommagés. Souvent, les gènes qui contrôlent la réparation de l’ADN sont eux-mêmes endommagés, ce qui rend les cellules encore plus sensibles à des niveaux toujours plus élevés de désordre génétique.
Vous trouverez ci-dessous une animation qui démontre la relation entre les chromosomes, les gènes et l’ADN.
On pense que la plupart des cancers proviennent d’une seule cellule précurseur mutante. Lorsque cette cellule se divise, les cellules » filles » qui en résultent peuvent acquérir différentes mutations et différents comportements au cours d’une période donnée. Les cellules qui acquièrent un avantage en matière de division ou de résistance à la mort cellulaire auront tendance à prendre le dessus sur la population. De cette manière, les cellules tumorales sont capables d’acquérir un large éventail de capacités qui ne sont normalement pas présentes dans la version saine du type de cellule représenté. Les changements de comportement observés dans les cellules cancéreuses sont au centre de la section Biologie du cancer du site.
Les mutations dans les gènes régulateurs clés (suppresseurs de tumeurs et proto-oncogènes) modifient le comportement des cellules et peuvent potentiellement conduire à la croissance non régulée observée dans le cancer.
Pour presque tous les types de cancer étudiés à ce jour, il semble que la transition d’une cellule normale et saine à une cellule cancéreuse soit une progression par étapes qui nécessite de nombreux changements génétiques qui s’additionnent pour créer la cellule cancéreuse. Ces mutations se produisent à la fois sur les oncogènes et les suppresseurs de tumeurs. C’est l’une des raisons pour lesquelles le cancer est beaucoup plus répandu chez les personnes âgées. Pour générer une cellule cancéreuse, une série de mutations doit se produire dans la même cellule. Comme la probabilité qu’un gène subisse une mutation est très faible, il va de soi que la probabilité que plusieurs mutations différentes se produisent dans la même cellule est vraiment très improbable. Pour cette raison, les cellules d’un corps âgé de 70 ans ont eu plus de temps pour accumuler les changements nécessaires à la formation de cellules cancéreuses, mais celles d’un enfant ont beaucoup moins de chances d’avoir acquis les changements génétiques requis. Bien sûr, certains enfants ont un cancer, mais il est beaucoup plus fréquent chez les personnes plus âgées. Le graphique ci-dessous montre les taux de cancer du côlon aux États-Unis en fonction de l’âge. Ce graphique a été obtenu auprès de l’Institut national du cancer. 2
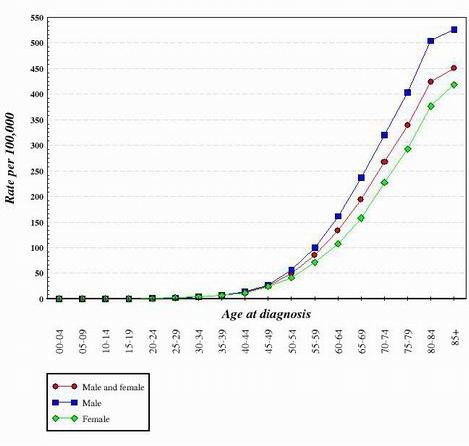
En observant la forme de courbes comme celles présentées ci-dessus, on a conclu que plusieurs modifications génétiques sont nécessaires pour créer des cellules qui deviennent cancéreuses.
En laboratoire, les chercheurs ont tenté de créer des cellules tumorales en modifiant ou en introduisant des protéines régulatrices clés. Plusieurs études ont tenté de définir le nombre minimal de modifications génétiques nécessaires pour créer une cellule cancéreuse, avec des résultats intrigants.3
Dans la nature, les mutations peuvent s’accumuler dans les cellules au fil du temps et si le « bon » groupe de gènes est muté, un cancer peut en résulter. Une étude de 2012 a montré que les cellules souches de la moelle osseuse d’un individu sain accumulent de nombreuses mutations à mesure que la personne vieillit. Il suffit de quelques mutations supplémentaires sur des gènes clés pour provoquer un cancer. Ces résultats impliquent que les cellules « normales » et les cellules cancéreuses ne sont peut-être pas si différentes que cela dans de nombreux cas.4
Mutations héréditaires dans le cancer
Pour compliquer les choses, il est clair que les changements nécessaires pour créer une cellule cancéreuse peuvent être accomplis de nombreuses façons différentes. Bien que tous les cancers doivent surmonter le même spectre de fonctions régulatrices pour se développer et progresser, les gènes impliqués peuvent différer. En outre, l’ordre dans lequel les gènes sont dérégulés ou perdus peut également varier. A titre d’exemple, les tumeurs du cancer du côlon de deux individus différents peuvent impliquer des ensembles très différents de suppresseurs de tumeurs et d’oncogènes, même si le résultat (le cancer) est le même.
La grande hétérogénéité observée dans les cancers, même ceux du même organe, signifie que le diagnostic et le traitement sont compliqués. Les progrès actuels dans la classification moléculaire des tumeurs devraient permettre la conception rationnelle de protocoles de traitement basés sur les gènes réellement impliqués dans un cas donné. Les nouveaux tests de diagnostic peuvent impliquer le dépistage de centaines ou de milliers de gènes afin de créer un profil personnalisé de la tumeur chez un individu. Ces informations devraient permettre d’adapter les traitements anticancéreux à chaque individu. Pour plus d’informations à ce sujet, voir la section Génomique/Protéomique.
Les modifications génétiques qui conduisent à une croissance cellulaire non régulée peuvent être acquises de deux manières différentes. Il est possible que la mutation se produise progressivement sur un certain nombre d’années, conduisant au développement d’un cas « sporadique » de cancer. Il est également possible d’hériter de gènes dysfonctionnels, ce qui entraîne le développement d’une forme familiale d’un type de cancer particulier. Voici quelques exemples de cancers à composante héréditaire connue :
- Cancer du sein- L’héritage de versions mutantes des gènes BRCA1 et BRCA2 sont des facteurs de risque connus. Bien que beaucoup, sinon la plupart, des personnes atteintes d’un cancer du sein ne présentent pas d’altérations détectables dans ces gènes, le fait d’avoir une forme mutante augmente la probabilité de développer un cancer du sein.
- Cancer du côlon- Les défauts dans les gènes de réparation de l’ADN tels que MSH2 sont connus pour prédisposer les individus au cancer colorectal héréditaire sans polypose (HNPCC).
- Rétinoblastome- Les défauts dans le gène suppresseur de tumeur Rb sont connus pour causer ce cancer de l’œil et plusieurs autres types de cancers. Vous trouverez plus d’informations sur cette maladie particulière dans la section sur Rb
C’est une liste incomplète des types de cancer héréditaires connus, et il est certain que d’autres formes héréditaires de cancer seront identifiées au fur et à mesure que la génétique des différents types de cancer sera clarifiée.
Plus d’informations sur ce sujet peuvent être trouvées dans les chapitres 2 et 4 de The Biology of Cancer de Robert A. Weinberg.
Types de mutation
Le processus par lequel les protéines sont fabriquées, la traduction, est basé sur la « lecture » de l’ARNm qui a été produit via le processus de transcription. Toute modification de l’ADN qui code pour un gène entraîne une altération de l’ARNm produit. À son tour, l’ARNm modifié peut conduire à la production d’une protéine qui ne fonctionne plus correctement. Même la modification d’un seul nucléotide le long de l’ADN d’un gène peut conduire à une protéine complètement non fonctionnelle.
Il existe plusieurs façons différentes de modifier l’ADN. La section suivante décrit plus en détail les différents types de modification génétique.
Mutations ponctuelles
Les altérations génétiques peuvent être placées dans deux catégories générales. La première catégorie comprend les changements qui ne modifient qu’un ou quelques nucléotides le long d’un brin d’ADN. Ces types de changements sont appelés mutations ponctuelles.
Lorsque les ribosomes lisent une molécule d’ARN messager, tous les trois nucléotides sont interprétés comme un acide aminé. Ces codes de trois lettres sont appelés codons. Pour faire une analogie avec une phrase anglaise : » Le gros chat a mangé le rat » contiendrait 6 codons. Les changements causés par la mutation peuvent donner des résultats tels que « Le gros chat a mangé le rat » ou « Le gros chat » ou « Le gros chat a mangé le rat… ». L’impact sur la protéine dépend de l’endroit où le changement se produit et du type de changement.
Les codons à trois lettres lus par les ribosomes peuvent être modifiés par mutation de l’une des trois façons suivantes :
Mutations non-sens
Le nouveau codon entraîne une terminaison prématurée de la protéine, produisant une protéine raccourcie et qui, souvent, ne fonctionne pas correctement ou pas du tout.
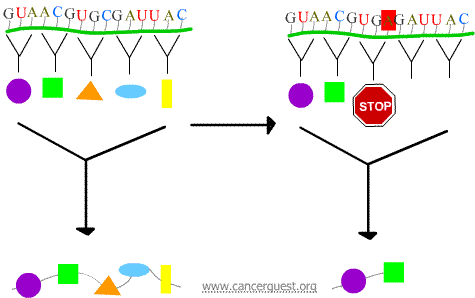
Mutations faux-sens
Le nouveau codon entraîne l’insertion d’un acide aminé incorrect dans la protéine. Les effets sur la fonction de la protéine dépendent de ce qui est inséré à la place de l’acide aminé normal.

Mutations faux-sens
La perte ou le gain de 1 ou 2 nucléotides entraîne une mauvaise lecture du codon affecté et de tous les codons qui suivent. Cela conduit à un produit protéique très différent et souvent non fonctionnel.
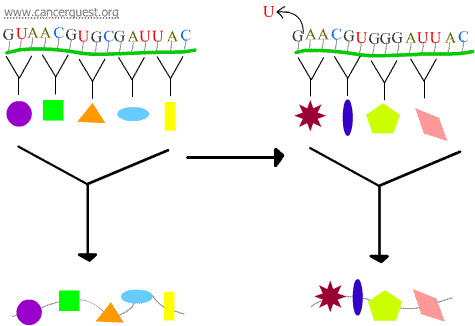
Erreurs de transcription
Certains dommages à l’ADN entraînent un nucléotide modifié ou un petit groupe de nucléotides qui ne peuvent pas être » lus » par l’ARN polymérase. Lorsque le complexe ARN polymérase atteint ces endroits, il contourne parfois les dommages en ajoutant des nucléotides dans un effort pour continuer à avancer, même si cela signifie mettre la mauvaise chose. Ce processus est connu sous le nom de mutagenèse transcriptionnelle et il pourrait jouer un rôle important dans le développement du cancer.5
Translocations
Une autre catégorie de mutations implique des altérations de plus grandes quantités d’ADN, souvent au niveau du chromosome. Elles sont appelées translocations et impliquent la rupture et le déplacement de fragments de chromosomes. Souvent, les ruptures dans deux chromosomes différents permettent la formation de deux « nouveaux » chromosomes, avec de nouvelles combinaisons de gènes.
Bien qu’il puisse sembler que cela ne cause pas beaucoup de problèmes, puisque tous les gènes sont encore présents, le processus peut entraîner une dérégulation de la croissance cellulaire de plusieurs façons-
1. Les gènes peuvent ne pas être transcrits et traduits de manière appropriée dans leur nouvel emplacement.
2. Le déplacement d’un gène peut entraîner une augmentation ou une diminution de son niveau de transcription.
3. La rupture et la réunion peuvent également se produire à l’intérieur d’un gène (comme indiqué en vert ci-dessus), conduisant à son inactivation.
Pour certains cancers, des translocations particulières sont très fréquentes et peuvent même être utilisées pour diagnostiquer la maladie. Les translocations sont fréquentes dans les leucémies et les lymphomes et ont été moins souvent identifiées dans les cancers des tissus solides. Par exemple, un échange entre les chromosomes 9 et 22 est observé chez plus de 90 % des patients atteints de leucémie myéloïde chronique (LMC). L’échange conduit à la formation d’une forme raccourcie du chromosome 22 appelée chromosome de Philadelphie (d’après le lieu de sa découverte). Cette translocation conduit à la formation d’un oncogène à partir du proto-oncogène abl.67
Les autres cancers qui sont souvent (ou toujours) associés à des translocations particulières comprennent le lymphome de Burkitt, les lymphomes à cellules B et plusieurs types de leucémie.
Amplification génique
Dans ce processus très inhabituel, le processus normal de réplication de l’ADN est sérieusement faussé. Le résultat est qu’au lieu de faire une seule copie d’une région d’un chromosome, de nombreuses copies sont produites. Cela conduit à la production de nombreuses copies des gènes situés dans cette région du chromosome. Parfois, tant de copies de la région amplifiée sont produites qu’elles peuvent effectivement former leurs propres petits pseudo-chromosomes appelés chromosomes double-minute.
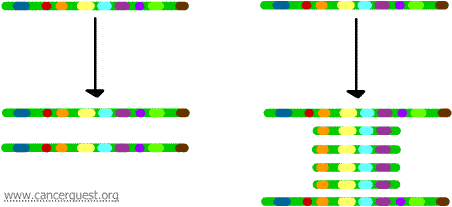
Les gènes sur chacune des copies peuvent être transcrits et traduits, ce qui conduit à une surproduction de l’ARNm et de la protéine correspondant aux gènes amplifiés, comme indiqué ci-dessous. Les lignes ondulées représentent l’ARNm produit via la transcription de chaque copie du gène.
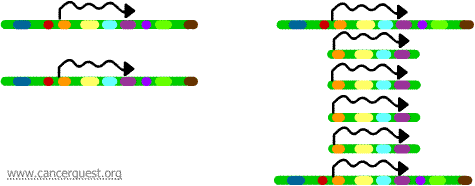
Bien que ce processus ne soit pas observé dans les cellules normales, il se produit assez souvent dans les cellules cancéreuses. Si un oncogène est inclus dans la région amplifiée, alors la surexpression de ce gène qui en résulte peut conduire à une croissance cellulaire dérégulée. L’amplification de l’oncogène myc dans un large éventail de tumeurs et l’amplification de l’oncogène ErbB-2 ou HER-2/neu dans les cancers du sein et des ovaires en sont des exemples. Dans le cas de l’oncogène HER-2/neu, les traitements cliniques ont été conçus pour cibler les cellules surexprimant le produit protéique.
L’amplification génique contribue également à l’un des plus grands problèmes du traitement du cancer : la résistance aux médicaments. Les tumeurs résistantes aux médicaments peuvent continuer à se développer et à se propager même en présence de médicaments de chimiothérapie. Un gène couramment impliqué est appelé MDR pour multiple drug resistance. Le produit protéique de ce gène agit comme une pompe située dans la membrane des cellules. Elle est capable d’éjecter sélectivement les molécules de la cellule, y compris les médicaments de chimiothérapie. Cette éjection rend les médicaments inefficaces.
Ce sujet est abordé plus en détail dans la section sur la résistance aux médicaments. L’amplification de différents gènes peut rendre inefficaces d’autres médicaments de chimiothérapie.
Inversions, duplications et délétions
Inversions
Dans ces altérations, des segments d’ADN sont libérés d’un chromosome puis réinsérés dans une orientation opposée. Comme dans les exemples précédents, ce réarrangement peut conduire à une expression génique anormale, soit en activant un oncogène, soit en désactivant un gène suppresseur de tumeur.
Duplications/Délétions
Par des erreurs de réplication, un gène ou un groupe de gènes peut être copié plus d’une fois au sein d’un chromosome. Ceci est différent de l’amplification génique dans la mesure où les gènes ne sont pas répliqués en dehors du chromosome et où ils ne sont copiés qu’une fois supplémentaire, et non des centaines ou des milliers de fois. Les gènes peuvent également être perdus en raison de l’échec du processus de réplication ou d’autres dommages génétiques.

Aneuploïdie
L’aneuploïdie est le changement génétique qui implique la perte ou le gain de chromosomes entiers. En raison de problèmes dans le processus de division cellulaire, les chromosomes répliqués peuvent ne pas se séparer correctement dans les cellules filles. Il peut en résulter des cellules qui ont trop de chromosomes ou trop peu de chromosomes. Un exemple d’une condition aneuploïde assez commune qui n’est pas liée au cancer est le syndrome de Down, dans lequel il y a une copie supplémentaire du chromosome 21 dans toutes les cellules de l’individu affecté.
Dans l’animation ci-dessous, des copies de deux chromosomes sont faites mais lorsque la cellule se divise, les chromosomes ne sont pas distribués uniformément aux deux cellules qui sont formées (cellules filles). Le résultat est qu’une des cellules a trop de chromosomes et l’autre pas assez.
Les cellules cancéreuses sont très souvent aneuploïdes. Les humains ont normalement 46 chromosomes dans leurs cellules, mais les cellules cancéreuses en ont souvent beaucoup plus, parfois plus de 100. La présence de ces chromosomes supplémentaires rend les cellules instables et perturbe gravement les contrôles de la division cellulaire. Un débat est actuellement en cours pour savoir si tous les cancers sont aneuploïdes ou non. Indépendamment du fait que ce soit le cas, il est clair que l’aneuploïdie est une caractéristique commune des cellules cancéreuses.
Modifications épigénétiques
En plus des altérations réelles de la séquence de l’ADN, l’expression des gènes peut être modifiée par des changements de l’ADN et de la chromatine qui ne modifient pas la séquence. Comme ces changements ne modifient pas la séquence de l’ADN dans les gènes, ils sont appelés changements épigénétiques. Deux types de changements épigénétiques sont décrits ci-dessous.
Méthylation
Dans cette altération, certains nucléotides de l’ADN sont modifiés par l’ajout d’un groupe méthyle (-CH3) à la base. La méthylation de l’ADN est associée à l’inactivation de cette région particulière de l’ADN. Des schémas anormaux de méthylation de l’ADN ont été observés dans les cellules cancéreuses. Comme les changements décrits, la méthylation modifie l’expression des gènes affectés.
Acétylation
Dans ce changement épigénétique, les protéines histones autour desquelles l’ADN est enroulé deviennent modifiées par l’ajout de groupes acétyles (-CH3CHO). Cette modification conduit à un relâchement de l’interaction ADN:histone et est associée à une augmentation de l’expression des gènes. La modification des processus d’ajout et de retrait des groupes acétyles à l’ADN est un domaine actif de la recherche sur le traitement du cancer.
Plus d’informations sur les modifications épigénétiques et les traitements du cancer.
Causes de la mutation
Comme nous l’avons vu, les cellules cancéreuses sont créées à partir de cellules précurseurs normales via une accumulation de dommages génétiques. Les mécanismes par lesquels les modifications sont induites sont variés. Au sens large, les agents de changement génétique (mutation) entrent principalement dans les catégories décrites ci-dessous et sont abordées en profondeur dans la section suivante.
Mutations spontanées
Mutations spontanées : Les bases (A, T, G, C) de l’ADN sont modifiées ou perdues en raison d’erreurs de réplication non réparées ou d’événements moléculaires aléatoires. Par exemple, la perte d’un groupe amino de la cytosine, une base normale présente dans l’ADN, conduit à la production d’uracile, une base qui ne se trouve pas normalement dans l’ADN. Si ce changement n’est pas détecté et inversé, une mutation peut en résulter. Parfois, une base entière peut être perdue en raison de la rupture de la liaison entre le squelette de l’ADN et la base. Cela entraîne un vide dans la double hélice d’ADN qui, s’il n’est pas réparé, peut conduire à une mutation la prochaine fois que l’ADN est copié (c’est-à-dire pendant la réplication).
Mutations induites
Mutations induites : Des mutations peuvent être induites en exposant des organismes (ou des cellules) à divers traitements. Certains des plus courants sont :
Radiation- Un des premiers mutagènes connus, la radiation est un puissant inducteur de mutations. Différents types de rayonnements provoquent différents types de modifications génétiques. Le rayonnement ultraviolet (UV) provoque des mutations ponctuelles. Les rayons X peuvent provoquer des ruptures dans la double hélice de l’ADN et entraîner des translocations, des inversions et d’autres types de dommages aux chromosomes. L’exposition aux rayons UV du soleil est liée au cancer de la peau. Il convient de noter que les propriétés des rayonnements qui endommagent l’ADN ont été utilisées dans plusieurs traitements du cancer basés sur les rayonnements.
La photo ci-dessous montre un type de mutation qui est causé par les rayonnements ultraviolets. Dans cet exemple, le bombardement de la double hélice de l’ADN par les rayons UV provoque l’union de deux bases. Cela modifie la structure de l’ADN et peut entraîner des changements permanents s’ils ne sont pas réparés.
Un autre type de rayonnement est l’énergie émise par des éléments radioactifs naturels (comme le radon et l’uranium) ou des sources artificielles comme celles que l’on trouve (et crée) dans les réacteurs nucléaires. Les rayonnements de ce type se présentent sous différentes formes et peuvent causer différents types de dommages aux cellules et aux tissus. Les rayonnements peuvent endommager directement l’ADN ou provoquer la formation de produits chimiques (c’est-à-dire d’espèces réactives de l’oxygène ou ROS) qui peuvent ensuite endommager l’ADN ou d’autres composants cellulaires.
L’exposition aux rayonnements des matériaux radioactifs a été bien documentée. Les analyses des survivants des bombes atomiques larguées sur le Japon pendant la Seconde Guerre mondiale ont montré de fortes augmentations des leucémies peu de temps après l’exposition, puis des augmentations d’autres types de cancer au cours des décennies suivantes.8
Des quantités dangereuses de matériaux radioactifs ont également été libérées accidentellement par des centrales nucléaires. L’exposition aux rayonnements due au rejet accidentel de matières radioactives du réacteur nucléaire de Tchernobyl a été associée à une augmentation du cancer de la thyroïde et d’autres cancers malins.9
Les appareils d’imagerie médicale (comme les machines à rayons X et les scanners) exposent également les patients aux rayonnements. Les quantités utilisées pour un seul test ne sont pas censées causer des quantités significatives de cancer, mais l’impact à long terme de nombreux tests sur plusieurs années n’est pas clair.10 De même, l’exposition des passagers d’avion aux scanners corporels dans les aéroports n’est pas censée poser un risque de cancer.11 Les passagers des avions sont également exposés aux rayonnements provenant de l’espace, mais à un faible niveau et on ne pense pas qu’ils présentent un risque de cancer, même pour les membres du personnel navigant.1112
Mutagènes chimiques- De nombreux produits chimiques différents sont connus pour provoquer des mutations. Ces produits chimiques exercent leur effet en se liant à l’ADN ou aux éléments constitutifs de l’ADN et en interférant avec les processus de réplication ou de transcription. Quelques exemples de mutagènes puissants sont le benzo-a-pyrène, un produit chimique présent dans la fumée de cigarette, et l’aflatoxine, un mutagène que l’on trouve le plus souvent sur des produits agricoles mal stockés.
Inflammation chronique- Une inflammation chronique peut entraîner des dommages à l’ADN en raison de la production de produits chimiques mutagènes par les cellules du système immunitaire. Un exemple serait l’inflammation à long terme causée par l’infection par le virus de l’hépatite. En savoir plus sur les virus et le cancer.
Radicaux d’oxygène- Lors de la capture d’énergie à partir des aliments, qui se produit dans nos mitochondries, des produits chimiques peuvent être générés qui sont très réactifs et sont capables d’endommager les membranes cellulaires et l’ADN lui-même. Ces intermédiaires réactifs de l’oxygène (IRO) peuvent également être générés par l’exposition des cellules aux rayonnements, comme le montre le schéma ci-dessous.
L’activité mutagène des ROI est associée au développement du cancer ainsi qu’aux activités de plusieurs traitements anticancéreux, notamment la radiothérapie et la chimiothérapie. 131415
Division cellulaire anormale
Pendant la mitose, il est possible que le processus de division cellulaire ne parvienne pas à diviser précisément les chromosomes répliqués en deux cellules filles. Une erreur de ce type conduira à la production de cellules aneuploïdes. Ces cellules sont soit dépourvues de gènes, soit ont gagné un nombre important de gènes. Ce processus rare peut créer des cellules qui sont plus enclines à une division cellulaire non régulée. Comme indiqué précédemment, un grand pourcentage de cancers isolés chez l’homme sont aneuploïdes.
Si une cellule présente une mutation dans un gène dont le produit protéique est responsable de la « vérification » du processus de division, les choses peuvent rapidement échapper à tout contrôle et les cellules filles de chaque division peuvent devenir de plus en plus anormales.
Les virus en tant que mutagènes
On pense que les virus sont responsables d’un pourcentage important de cas de cancer. Les virus peuvent provoquer le cancer de diverses manières et le mode d’action de chaque type de virus est susceptible d’être légèrement différent. Certains virus (dont de nombreux rétrovirus) peuvent provoquer des mutations en insérant leurs gènes dans le génome de la cellule infectée. L’ADN inséré peut détruire ou modifier l’activité des gènes concernés.161718
Les virus peuvent également provoquer des mutations de manière indirecte. A titre d’exemple : Une infection par le virus de l’hépatite peut durer de nombreuses années. Pendant cette période, le système de défense de l’organisme tente de se débarrasser du virus en produisant des produits chimiques toxiques. Ces produits chimiques peuvent endommager des cellules « secondaires », par ailleurs saines, et les entraîner sur la voie du cancer. Il existe de nombreuses autres façons dont les virus peuvent causer le cancer.1920
En raison de l’importance des virus dans le développement de nombreux cancers, nous avons créé une section consacrée aux virus et au cancer.
Les transposons en tant que mutagènes
Les transposons sont de courtes séquences d’ADN qui ont la capacité de se déplacer d’un emplacement dans l’ADN à un autre emplacement. Les transposons codent pour une enzyme, la transposase, qui agit pour épisser le transposon dans de nouveaux emplacements dans un génome (voir le schéma, ci-dessous à gauche, d’un transposon) Les transposons ont été découverts par Barbara McClintock et elle a obtenu un prix Nobel pour son travail.2122 Le génome humain contient de nombreuses copies inactivées de transposons qui ont perdu leur capacité à se déplacer ou à « sauter » vers de nouveaux emplacements. Environ 50 % du génome humain est composé de transposons » morts « .23
Le mouvement des transposons actifs peut entraîner des mutations, modifiant l’activité des gènes. Un exemple visible du mouvement des transposons (appelé transposition), est la coloration des grains dans le maïs indien (voir ci-dessous à droite). On pense que les transposons actifs chez l’homme sont impliqués dans les maladies humaines, notamment le cancer242526.


Résumé de la mutation
Modification génétique (mutation) Introduction
- Les comportements anormaux manifestés par les cellules cancéreuses sont le résultat d’une série de mutations dans des gènes régulateurs clés (c’est-à-dire les gènes de réparation de l’ADN).
- On pense que la plupart des cancers proviennent d’une seule cellule précurseur qui acquiert suffisamment de mutations pour devenir une cellule cancéreuse.
Mutations de l’ADN
- Les changements génétiques peuvent être petits, n’affectant qu’un ou quelques nucléotides (mutations ponctuelles) ou ils peuvent être assez importants, modifier la structure d’un ou plusieurs chromosomes.
- Mutations ponctuelles
- La traduction est la production d’une protéine par des enzymes qui « lisent » trois « mots » nucléotidiques (codons) le long d’un ARN messager (ARNm).
- Même la modification d’un seul nucléotide le long de l’ADN d’un gène peut conduire à une protéine complètement non fonctionnelle. Les mutations sont regroupées en fonction des changements qu’elles créent dans le produit protéique résultant du gène affecté.
- Mutations non-sens – Le nouveau codon (mutant) entraîne l’arrêt prématuré de la synthèse des protéines.
- Mutations faux-sens – Le codon modifié entraîne l’insertion d’un acide aminé incorrect dans la protéine.
- Mutations à décalage de cadre – La perte ou le gain de 1 ou 2 nucléotides dans un ARNm entraîne une mauvaise lecture des codons. Il en résulte fréquemment des protéines raccourcies et non fonctionnelles.
- Modifications au niveau du chromosome
- Translocations – Rupture et (parfois) échange de fragments de chromosomes.
- Amplification génique – Une réplication anormale crée des copies multiples d’une région d’un chromosome. Au final, cela conduit à une surproduction des protéines correspondantes.
- Inversions – Des segments d’ADN sont libérés d’un chromosome puis réinsérés dans l’orientation opposée.
- Duplications/délétions – Un gène ou un groupe de gènes peut être entièrement perdu ou copié plus d’une fois dans un chromosome.
- Aneuploïdie – Une modification génétique qui implique la perte ou le gain de chromosomes entiers.
- Des mutations spontanées peuvent se produire en raison d’un ADN non réparé ou d’événements moléculaires aléatoires.
- L’aneuploïdie est très fréquente dans les cellules cancéreuses.
Modifications épigénétiques
- L’expression des gènes peut être modifiée par des modifications de l’ADN et de la chromatine qui ne changent pas la séquence génétique. Les exemples incluent la méthylation de l’ADN et l’acétylation des histones.
- Méthylation – Certains nucléotides de l’ADN sont modifiés par l’ajout d’un groupe méthyle qui est associé à l’inactivation de cette région de l’ADN
- Acétylation – L’ajout de groupes acétyles relâche l’ADN et augmente l’expression des gènes.
Mutations induites
- Les mutations peuvent être induites en exposant les organismes (ou les cellules) à une variété de traitements :
- Radiation – Les rayons UV provoquent des mutations ponctuelles et les rayons X provoquent des formes multiples de dommages.
- Mutagènes chimiques – Peuvent se lier à l’ADN ou aux éléments constitutifs de l’ADN et interférer avec les processus de réplication ou de transcription.
- Inflammation chronique – Dommages à l’ADN dus à la production de produits chimiques mutagènes par les cellules du système immunitaire
- Radicaux oxygénés – Résultent de la production d’énergie d’une cellule et peuvent endommager l’ADN.
Autres modifications génétiques
- Une division cellulaire aberrante entraînant une division incorrecte des chromosomes peut entraîner une aneuploïdie.
- Les virus peuvent causer des dommages génétiques de plusieurs façons différentes et sont associés à un large éventail de cancers.
Mutation et cancer
- Il semble que la transition d’une cellule normale et saine à une cellule cancéreuse soit une progression par étapes.
- Le développement du cancer nécessite des changements génétiques dans plusieurs oncogènes et suppresseurs de tumeurs différents.
- Tous les cancers doivent surmonter le même spectre de fonctions régulatrices pour se développer et progresser, mais les gènes impliqués peuvent différer.
- L’hétérogénéité du cancer complique le diagnostic et le traitement.
- Il est possible d’hériter de gènes dysfonctionnels conduisant au développement d’une forme familiale d’un type de cancer particulier.
Savoir le flux : Mutation
Savoir le flux est un jeu interactif pour vous permettre de tester vos connaissances. Pour jouer :
- Glissez les choix appropriés de la colonne de droite et placez-les dans l’ordre dans les cases de gauche. Notez que vous n’utiliserez que cinq des six choix pour terminer le jeu.
- Une fois terminé, cliquez sur « Vérifier » pour voir combien vous en avez eu de corrects.
- Pour les réponses incorrectes, cliquez sur « Description » pour revoir les informations sur les processus.
- Pour essayer à nouveau, choisissez « Réinitialiser » et recommencez.
-
1
-
2
-
3
-
4
-
5
-
En savoir plusUne cellule est en cours de synthèse d’ADN
-
En savoir plusPlusieurs copies d’une région d’un chromosome sont fabriquées
- .
Apprendre plusTranscription de gènes amplifiés
-
Apprendre plusTranscription de gènes amplifiés
-
Apprendre plusLa surproduction d’une protéine clé protéine clé conduit à la croissance d’une tumeur résistante aux médicaments
-
En savoir plusLa duplication se produit
Jouez à nouveau
- 1. Urry, L. A., Cain, M. L., Wasserman, S. A., Minorsky, P. V., & Reece, J. B. (2017). Campbell Biology (11e éd.). Pearson.
- 2. Surveillance, Epidemioloy, and End Results (SEER) représenté par National Cancer Institute
- 3. Hahn WC, Counter CM, Lundberg AS, Beijerbergen RL, Brooks MW, Weinberg RA. « Création de cellules tumorales humaines avec des éléments génétiques définis ». Nature 400 : 464-468
- 4. Welch JS, Ley TJ, Link DC, Westervelt P, Walter MJ, Graubert TA, DiPersio JF, Ding L, Mardis ER, Wilson RK et al. L’origine et l’évolution des mutations dans la leucémie myéloïde aiguë. Cell, 20 juillet 2012
- 5. Brégeon D, Doetsch PW. Mutagenèse transcriptionnelle : causes et implication dans le développement tumoral. Nat Rev Cancer. 2011 Mar;11(3):218-27.
- 6. Nowell PC, Hungerford DA. « Études chromosomiques sur les leucocytes humains normaux et leucémiques ». J Natl Cancer Inst (1960). 25 : 85-100.
- 7. Rowley JD. « Une nouvelle anomalie chromosomique cohérente dans la leucémie myélogène chronique identifiée par fluorescence de quinacrine et coloration de Giemsa. » Nature (1973). 243 : 290-293.
- 8. Ozasa K, Shimizu Y, Sakata R, Sugiyama H, Grant EJ, Soda M, Kasagi F, Suyama A. RISK OF CANCER AND NON-CANCER DISEASES IN THE ATOMIC BOMB SURVIVORS. Radiat Prot Dosimetry. 2011 Apr 18.
- 9. Cardis E, Hatch M. The Chernobyl accident–an epidemiological perspective. Clin Oncol (R Coll Radiol). 2011;23(4):251-260. doi:10.1016/j.clon.2011.01.510 Mar 9.
- 10. Fazel R, Krumholz HM, Wang Y, Ross JS, Chen J, Ting HH, Shah ND, Nasir K, Einstein AJ, Nallamothu BK. Exposition aux rayonnements ionisants à faible dose provenant des procédures d’imagerie médicale. N Engl J Med. 2009 Aug 27;361(9):849-57.
- 11. a. b. Mehta P, Smith-Bindman R. Airport Full-Body Screening : Quel est le risque ? Arch Intern Med. 2011 Mar 28.
- 12. Bagshaw M. Le rayonnement cosmique dans l’aviation commerciale. Travel Med Infect Dis. 2008 mai;6(3):125-7. Epub 2007 Nov 26.
- 13. Kang DH. « Stress oxydatif, dommages à l’ADN et cancer du sein ». AACN Clin Issues. (2002). 13:540-549
- 14. Athar M. « Stress oxydatif et carcinogenèse expérimentale ». Indian J. Exp. Biol. (2002). 40:656-667
- 15. Marnett LJ. « Radicaux oxy, peroxydation lipidique et dommages à l’ADN ». (2002)181-182:219-222
- 16. Nair V. Oncogenèse induite par les rétrovirus et sécurité des vecteurs rétroviraux. Curr Opin Mol Ther. 2008 Oct;10(5):431-8.
- 17. Brady G, Macarthur GJ, Farrell PJ. Le virus d’Epstein-Barr et le lymphome de Burkitt. Postgrad Med J. 2008 Jul;84(993):372-7.
- 18. Ruprecht K, Mayer J, Sauter M, Roemer K, Mueller-Lantzsch N. Endogenous retroviruses and cancer. Cell Mol Life Sci. 2008 Nov;65(21):3366-82.
- 19. Lupberger J, Hildt E. Hepatitis B virus-induced oncogenesis. World J Gastroenterol. 2007 Jan 7;13(1):74-81.
- 20. Castello G, Scala S, Palmieri G, Curley SA, Izzo F. HCV-related hepatocellular carcinoma : De l’inflammation chronique au cancer. Clin Immunol. 2010 Mar;134(3):237-50. Epub 2009 Nov 11.
- 21. McClintock B. L’origine et le comportement des loci mutables dans le maïs. Proc Natl Acad Sci U S A. 1950 Jun;36(6):344-55.
- 22. McClintock, Barbara Conférence du prix Nobel
- 23. Burns KH, Boeke JD. La tectonique des transposons humains. Cell. 2012 May 11;149(4):740-52.
- 24. Kozeretska IA, Demydov SV, Ostapchenko LI. Les éléments génétiques mobiles et le cancer. Des mutations à la thérapie génique. Exp Oncol. 2011 Dec;33(4):198-205.
- 25. Solyom S, Kazazian HH Jr. Éléments mobiles dans le génome humain : implications pour la maladie. Genome Med. 2012 Feb 24;4(2):12.
- 26. Iskow RC, McCabe MT, Mills RE, Torene S, Pittard WS, Neuwald AF, Van Meir EG, Vertino PM, Devine SE. Mutagenèse naturelle des génomes humains par les rétrotransposons endogènes. Cell. 25 juin 2010;141(7):1253-61.