Bien que la dengue était autrefois une maladie périodique qui provoquait des épidémies à long intervalle, elle est aujourd’hui considérée comme la plus importante maladie virale transmise par les moustiques dans le monde . Chaque année, environ cinquante à cent millions de cas de dengue sont enregistrés dans le monde . Un demi-million de ces cas se traduisent par la forme la plus grave de la dengue (DF), appelée fièvre hémorragique de la dengue (DHF). La DHF est une maladie qui touche principalement les enfants de moins de 15 ans et se caractérise par l’apparition soudaine de fièvre, de thrombocytopénie et de syndrome de fuite vasculaire. La DHF est due à une infection par le virus de la dengue, qui fait partie de la famille des Flaviviridae . Le virus est un ARN positif monocaténaire, icosaèdre et enveloppé. Le noyau icosaèdre a un diamètre de quarante à cinquante nanomètres et contient la protéine C qui encapsule le génome viral . Deux protéines virales, M et E, qui composent l’enveloppe lipidique, entourent le noyau. L’infection est causée par l’un des quatre sérotypes du virus de la dengue (DENV) : DENV-1, DENV-2, DENV-3 et DENV-4 . L’infection par l’un des sérotypes ne confère pas d’immunité contre l’infection par les autres sérotypes .
Si une personne qui a déjà été infectée est infectée à nouveau, elle a un risque accru de développer le syndrome de choc de la dengue (SDC) et la DHF, qui se traduit par l’affaiblissement et la rupture des vaisseaux et des hémorragies internes . Les anticorps non neutralisants peuvent favoriser l’absorption du virus par les cellules qui expriment des récepteurs Fc, ce qui permet un renforcement anticorps-dépendant du DHF . Plusieurs espèces de moustiques Aedes sont des vecteurs du virus de la dengue et transmettent le virus en piquant un hôte humain. Aedes aegypti ; un petit moustique tropical et subtropical, noir et blanc, que l’on trouve en Amérique centrale, en Amérique latine, en Asie du Sud-Est et dans le Pacifique occidental, est le principal vecteur .
Epidémiologie
Aujourd’hui, la DHF est considérée au niveau international comme la plus importante maladie virale transmise par les moustiques. Elle est endémique dans plus de 100 pays dans le monde, en particulier dans les régions tropicales et subtropicales . Aux États-Unis, l’espèce Aedes aegyptispecies responsable de la DHF peut être trouvée de façon saisonnière en Louisiane, dans le sud de la Floride, au Nouveau-Mexique, en Arizona, au Texas, en Géorgie, en Alabama, au Mississippi, en Caroline du Nord et du Sud, au Kentucky, en Oklahoma et au Tennessee . Au cours des 50 dernières années, l’incidence de la dengue a été multipliée par 30 .
Selon l’Organisation mondiale de la santé (OMS), on estime que 50 à 100 millions d’infections de la dengue se produisent chaque année. Parmi ces cas, 500 000 évoluent vers une DHF entraînant 22 000 décès, principalement d’enfants . Selon les données officielles soumises à l’OMS, les cas de dengue dans les Amériques, en Asie du Sud-Est et dans le Pacifique occidental ont dépassé 1,2 million en 2008 et plus de 3 millions en 2013. En 2013, 2,35 millions de cas de dengue ont été signalés dans les seules Amériques, dont 37 687 cas de DHF . Après la première épidémie connue de DHF en 1953 à 1954 aux Philippines, la maladie a continué à se propager dans toute l’Asie du Sud-Est .
Durant les années 1950, 1960 et la majeure partie des années 1970, l’épidémie de dengue était rare dans la plupart des pays d’Amérique du Sud et d’Amérique centrale, car le moustique vecteur primaire, Aedes aegypti, avait été éradiqué. Cependant, une fois l’eextermination arrêtée, Aedes aegypti a commencé à réinvestir ces régions. En 1997, Aedes aegypti et le virus de la dengue se sont de nouveau répandus dans le monde entier (Figures 1 et 2). Selon l’OMS, plus de 2,5 milliards de personnes vivent dans des régions où la dengue/FH est endémique et risquent d’être infectées par le virus de la dengue. Plusieurs facteurs contribuent à la transmission virale par Aedes aegypti, notamment la température, les précipitations, l’exode rural, la croissance démographique, le stockage de l’eau et l’augmentation des déchets solides, qui constituent des habitats larvaires pour le vecteur. Il peut également y avoir des épidémies de DHF associées à des voyages. La dengue est l’infection à arbovirus la plus répandue dans le monde .
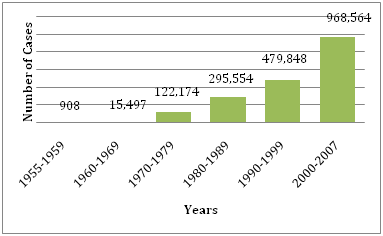
Figure 1 : Nombre moyen de DF/DHF signalés à l’OMS au cours des années fournies .
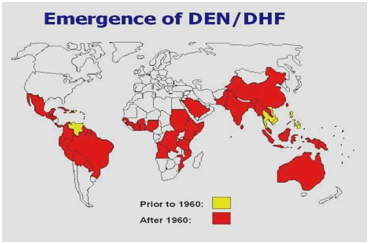
Figure 2 : Distribution de la dengue/fièvre hémorragique de la dengue dans les Amériques, les Caraïbes, l’Afrique et le Moyen-Orient.
Facteurs de risque pour la DF et la transmission du virus de la dengue
La dengue est une importante maladie virale transmise par les arthropodes . Les recherches montrent que le genre Aedes, principalement les moustiques Aedes aegypti et Aedes albopictus, se sont adaptés pour vivre près des zones d’habitation humaine et sont responsables de la transmission de la dengue. Les moustiques se nourrissent pendant la journée et préfèrent les êtres humains aux autres animaux. Aedes aegypti est le moustique qui se nourrit le plus de sang humain (76,9 %), suivi par Aedes albopictus et Aedes vittatus (75 % et 33,3 % respectivement). L’incidence de la dengue a été associée à la quantité de végétation, à la couverture arborée, à la qualité des logements et à la superficie des terres environnantes.
A côté des gîtes larvaires artificiels, il a également été démontré que le climat influençait l’écologie de la dengue en affectant la dynamique des vecteurs, le développement des agents et l’interaction moustique/homme.13 La température contribue à influencer les taux de développement des vecteurs, la mortalité, le comportement et contrôle la réplication virale au sein du vecteur. Les climats chauds permettent le développement des larves et l’augmentation de la vitesse de réplication du virus, tandis que les climats froids ralentissent le développement viral et diminuent le temps de survie des moustiques, réduisant ainsi la possibilité d’un vecteur infectieux et la transmission de la dengue. La température interagit également avec les précipitations en tant que principal régulateur de l’évaporation, affectant ainsi directement la disponibilité des habitats aquatiques et indirectement la couverture et l’utilisation des sols, ce qui peut favoriser ou entraver la croissance des populations de vecteurs .
Les changements démographiques et sociaux tels que la croissance démographique, l’urbanisation et les transports modernes contribuent grandement à l’augmentation de l’incidence et à la propagation géographique de l’activité de la dengue . Lorsque les voyageurs quittent les zones endémiques, ils ont tendance à servir de véhicules pour une plus grande propagation . La virulence de la souche virale et la variation génétique du virus de la dengue se prêtent également à un plus grand potentiel de transmission épidémique de la DHF .
Pathogenèse de la dengue hémorragique
Lorsque le moustique se nourrit de l’hôte humain, il injecte le virus de la dengue (DENV) dans la circulation sanguine et dans l’épiderme et le derme environnants. Il en résulte l’infection des cellules de Langerhans immatures et des kératinocytes par endocytose médiée par les récepteurs . La protéine E, la protéine de surface, est reconfigurée et permet la fusion membranaire et la libération de l’ARN viral dans la cellule infectée. Les protéines non structurelles, NS1 et NS2A, contrôlent la réplication de l’ARN viral et NS1 peut également être impliquée dans l’activation de la cascade du complément. Les cellules infectées peuvent ensuite mourir par apoptose ou nécrose ou migrer vers les ganglions lymphatiques où les macrophages sont recrutés (figure 3). L’infection par l’un des quatre sérotypes de la dengue (DENV-1 à DENV-4) peut être asymptomatique dans la majorité des cas, car le système immunitaire de l’hôte est capable de la neutraliser localement, mais elle peut également provoquer un éventail de manifestations cliniques, la forme la plus grave étant la DHF, qui peut évoluer vers le DSS et la mort. La DHF est définie cliniquement comme une fièvre continue de 2 à 7 jours avec des manifestations hémorragiques muqueuses ou cutanées associées à une thrombocytopénie (<100 000 cellules/mm3) et un hématocrite supérieur de plus de 20% à la valeur de base du patient ou de la population du même âge . Les caractéristiques pathologiques de la DHF sont la fuite de plasma des surfaces pleurales ou péritonéales et la coagulopathie intrinsèque, qui est mesurée cliniquement soit par un test du garrot positif, soit par des signes de saignement spontané comme des pétéchies ou des ecchymoses, des saignements gingivaux ou une épistaxis, ou une hémorragie gastro-intestinale .

Figure 3 : Après avoir été piqués par le moustique porteur Aedes aegypti, les cellules de Langerhans et les kératinocytes immatures sont infectés par le DENV. Les cellules infectées descendent ensuite dans la lymphe où les macrophages sont recrutés. De là, l’infection est disséminée dans divers organes, notamment le foie, la rate et la moelle osseuse. La nécrose de la moelle osseuse par le DENV peut entraîner une suppression de l’hématopoïèse et une diminution de la thrombogenèse dans le sang . La réponse inflammatoire, provoquée par la libération de chimiokines et de cytokines par les mastocytes, les macrophages et les lymphocytes, entraîne une augmentation de la perméabilité vasculaire, un dysfonctionnement des plaquettes, une thrombocytopénie et une fuite de plasma. Bien que le mécanisme ne soit pas bien compris, cette cascade semble également provoquer des saignements spontanés, conduisant aux manifestations cliniques de pétéchies, de saignements gingivaux et d’hémorragies gastro-intestinales .
Cette forme sévère de la maladie est souvent le résultat d’une infection secondaire où l’hôte est infecté par un second sérotype et où une interaction complexe entre le virus et la réponse immunitaire de l’hôte s’ensuit . Bien que le mécanisme à l’origine de cette réaction ne soit pas bien compris, il semble que l’infection antérieure puisse créer des anticorps à réaction croisée qui se fixent sur le nouveau sérotype, mais sont incapables de le neutraliser. C’est ce qu’on appelle la théorie du renforcement dépendant des anticorps (ADE). On pense que les anticorps formés au cours d’infections antérieures contre les protéines structurelles du DENV, telles que la protéine E ou la prM, sont incapables de neutraliser le nouvel agent pathogène et entraînent plutôt une liaison accrue aux cellules positives aux récepteurs Fcγ, ce qui permet la réplication amplifiée du virus. En réponse, le système immunitaire libère une réponse cytokine exagérée, conduisant à une perméabilité vasculaire accrue et à une coagulopathie .
Les mastocytes ont également été impliqués dans la pathogenèse de la DHF. Dans certains cas, les mastocytes semblent assurer une fonction protectrice lorsque des molécules antivirales sont libérées par la dé granulation et que d’autres cellules immunitaires, telles que les lymphocytes T et les cellules tueuses naturelles (NK), sont recrutées, toutes contribuant à neutraliser le virus . Cependant, dans d’autres cas, les mécanismes de contrôle locaux ne peuvent pas contenir le virus, et celui-ci se déplace dans la circulation sanguine ou le système lymphatique pour activer les mastocytes dans d’autres organes tels que le foie, la rate et les ganglions lymphatiques. Lorsque la dé granulation se produit dans ces organes, des protéases sont libérées et des médiateurs inflammatoires, tels que les leucotriènes et le facteur de croissance endothélial vasculaire (VEGF), sont synthétisés, ce qui augmente la perméabilité des capillaires et entraîne une fuite de plasma . Ce point est important car différents groupes de mastocytes libèrent des médiateurs distincts au cours du processus de granulation. Le complexe virus-anticorps, peut-être par l’intermédiaire de l’antigène NS1 du virus de la dengue, et la production de cytokines entraînent également une activation du complément. La libération de fragments C3a et C5a est connue pour augmenter la perméabilité vasculaire et contribuer ainsi à la fuite de plasma .
Le type et la quantité de cytokines libérées jouent un rôle important pour dicter la gravité de la maladie. La protéine inflammatoire macrophagique 1β (MIP-1β) semble être un indicateur d’une maladie moins sévère car elle est libérée par les cellules mononucléaires infectées et les cellules NK activées. Elle agit comme un chimio-attracteur pour davantage de cellules NK, les attirant vers le site inflammatoire, limitant la réplication virale et l’effet cytokine en aval. Il a été démontré que l’interféron γ (IFN-γ), quant à lui, induit une fuite plasmatique et augmente l’absorption des particules de dengue par le biais de l’augmentation des récepteurs Fc sur les cellules cibles et est donc associé à des manifestations cliniques plus sévères et à un mauvais pronostic . D’autres cytokines dont on a constaté l’augmentation dans la DHF et qui ont été impliquées dans l’induction de la fuite plasmatique comprennent l’interleukine 2 (IL-2), le facteur de nécrose tumorale α (TNF- α), le facteur d’inhibition de la migration des macrophages (MIF), la protéine chimio tactique monocytaire-1 (MCP-1), l’interleukine-8 (IL-8) et la boîte de groupe à haute mobilité-1 (HMGB-1). Les effets de la libération de cytokines ne se limitent pas à la perméabilité vasculaire et à la fuite de plasma, mais sont également impliqués dans les manifestations hémorragiques de la DHF. Cependant, le mécanisme sous-jacent à l’origine des hémorragies dans la DHF est mal compris. Bien que la plupart des cellules infectées soient susceptibles de mourir par apoptose, une certaine nécrose se produit, entraînant la libération de toxines qui activent les systèmes de coagulation et de fibrinolyse. Lorsque des niveaux élevés de nécrose se produisent dans la moelle osseuse en raison d’une charge virale élevée, l’hématopoïèse est supprimée, ce qui entraîne une pénurie thrombolytique. La diminution de la thrombogenèse et le dysfonctionnement des plaquettes qui en résultent peuvent être à l’origine de la fragilité capillaire et des manifestations cliniques qui en découlent et que l’on observe dans l’ICD . Certaines études indiquent que l’implication du foie dans l’infection par le DENV peut être impliquée dans les tendances aux hémorragies spontanées, avec une corrélation entre des niveaux élevés d’enzymes hépatiques et une tendance accrue aux hémorragies .
Signes et symptômes cliniques
La manifestation clinique de la maladie comprend une infection asymptomatique, une dengue légère (DF), une dengue hémorragique (DHF) ou un syndrome de choc de la dengue (DSS), qui est souvent grave en raison d’une perméabilité capillaire anormale et d’une fuite de plasma . La dengue sévère survient généralement chez des patients qui ont déjà été infectés par un virus de la dengue (c’est-à-dire une infection secondaire). Des taux élevés d’infection sévère par la dengue ont également été signalés chez les nourrissons atteints d’une infection primaire par le virus de la dengue et nés de mères ayant été infectées précédemment par un virus de la dengue .
La phase initiale de la DHF se présente comme une fièvre de dengue. La symptomatologie de cette phase initiale dépend de l’âge du patient et comprend une fièvre élevée et soudaine (parfois avec deux 2 pics-saddle backed), des maux de tête sévères, une diminution de l’appétit, des myalgies et des arthralgies sévères, une éruption cutanée maculopapulaire qui apparaît trois à quatre jours après l’apparition initiale de la fièvre, une douleur rétro-orbitaire, une photophobie, une lymphadénopathie, des saignements légers (épistaxis, saignements gingivaux, saignements gastro-intestinaux, hématurie et ménorragie) et un test du garrot positif. Les cas de DHF sont caractérisés par quatre manifestations cliniques majeures qui sont une forte fièvre, des phénomènes hémorragiques, et souvent, une hépatomégalie et une insuffisance circulatoire. La maladie fébrile aiguë caractéristique de la phase initiale consiste en des températures supérieures à 39°C et le restent pendant 2 à 7 jours.
Les symptômes susmentionnés de la phase initiale s’aggravent progressivement avec une fièvre et des maux de tête continus, une douleur ou une sensibilité abdominale sévère, des vomissements persistants, une hématémèse, un méléna, des pétéchies, des ecchymoses faciles, une agitation, une léthargie, une somnolence, une irritabilité, des saignements ou des ecchymoses sous la peau . Après 2 à 7 jours de fièvre, une chute rapide de la température est souvent accompagnée de signes de troubles circulatoires de gravité variable. Le patient peut transpirer, être agité, avoir les extrémités froides et présenter des modifications du pouls et de la tension artérielle. Après 24-48 heures de l’apparition des caractéristiques spécifiques de la DHF, on observe que l’hémostase anormale et la fuite de plasma sont les symptômes caractéristiques.
Un bon indicateur de ces avancées est une hypertrophie du foie de plus de 2 cm, car l’hépatomégalie tend à précéder la fuite de plasma . De nombreux patients se rétablissent avec ou sans traitement fluide et électrolytique. Dans les cas graves, la perte de plasma peut évoluer vers un choc et la mort si elle n’est pas traitée. La recherche suggère qu’à la fois une infection secondaire de la dengue et la riposte exagérée de la réponse du système immunitaire cytokine augmentent la prédilection pour un patient de développer DHF.
Les produits viraux tels que la glycoprotéine NS1 influenceraient l’activation du complément et la perméabilité vasculaire entraînant une fuite de plasma qui se développe en ascite ou en épanchement pleural . La réponse cytokinique est également responsable de l’augmentation de la perméabilité vasculaire, ce qui a pour conséquence de réduire la pression oncotique intravasculaire et de faciliter la perte de liquide dans les compartiments extravasculaires (Figure 4). L’hémostase anormale consiste en une thrombocytopénie concomitante à une augmentation de l’hématocrite, un temps de thromboplastine partielle prolongé avec une concentration réduite de fibrinogène, ainsi que les pétéchies mentionnées précédemment, des hémorragies gastro-intestinales sévères, des ecchymoses et des épistaxis .
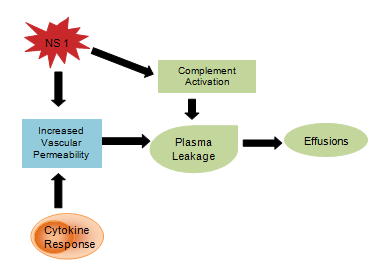
Figure 4 : Réponse du système immunitaire aux cytokines.
Pendant la phase virémique fébrile de la DHF, on pense que la thrombocytopénie et les manifestations ultérieures sont dues à la suppression de la moelle osseuse. Comme mentionné précédemment, la suppression de la moelle osseuse résulte du fait qu’elle est un site de réplication du virus et qu’elle attaque spécifiquement les cellules progénitrices hématopoïétiques , Cependant, la destruction des plaquettes à médiation immunitaire a également été suggérée par la découverte de complexes virus-anticorps trouvés à la surface des plaquettes de patients atteints de DHF.
Les manifestations cliniques peu fréquentes comprennent une hépatite aiguë, une insuffisance hépatique, une insuffisance rénale aiguë, une encéphalopathie ou une cardiomyopathie (myocardite aiguë) . Une étude sur la DHF fatale chez l’adulte a examiné les causes de mortalité autres que le syndrome de choc de la dengue (DSS) chez les patients atteints de dengue sévère et a conclu que l’hypothermie, la leucocytose et la bandémie pouvaient être des signes déclencheurs de la dengue sévère. L’étude conseille en outre aux cliniciens d’être conscients du développement possible d’une hémorragie gastro-intestinale massive, en particulier chez les patients présentant une altération précoce de la conscience, une thrombocytopénie profonde, un TP prolongé et/ou une leucocytose .
Diagnostic, traitement et gestion
Un diagnostic précoce et précis est essentiel pour des soins cliniques appropriés. Il existe de nombreuses méthodes permettant d’établir le diagnostic de la dengue. Le diagnostic peut être réalisé par l’isolement du virus, de l’acide nucléique viral, des anticorps et des antigènes, ou par une combinaison de toutes ces techniques. La détection du virus de la dengue par culture est le test de diagnostic définitif, mais des considérations pratiques limitent son utilisation. La détection de l’ARN viral est plus rapide mais la contamination peut entraîner un résultat faussement positif. De même, le test sérologique peut produire un résultat faussement positif en raison des anticorps à réaction croisée .
Les infections aiguës sont détectées dans le sérum, le plasma et les cellules sanguines circulantes pendant la phase de convalescence précoce, qui correspond aux 5 à 8 jours initiaux des symptômes. À ce moment-là, la charge virale primaire peut atteindre 103 particules d’ARN/ml ou être supérieure à 106 particules d’ARN/ml dans les infections secondaires. Actuellement, la combinaison des tests de détection de l’antigène NS1 et des anticorps, ainsi que les méthodes moléculaires, telles que la réaction en chaîne de la polymérase avec transcription inverse en temps réel (RT-PCR), sont de plus en plus utilisées pour le diagnostic, car elles permettent d’obtenir des résultats plus rapides et plus sensibles. L’analyse immunohistochimique et l’immunofluorescence confirment également la présence du virus grâce aux antigènes viraux. Les anticorps IgM sont les premiers à apparaître dans les 3 à 5 premiers jours de l’infection .
Ils sont à leur niveau maximal 2 semaines après l’apparition des symptômes puis diminuent généralement pour atteindre des niveaux indétectables après 30-60 jours . Les anticorps IgG, qui ont une réaction croisée plus importante, sont détectés à des niveaux faibles après les 7-9 jours initiaux des symptômes, augmentent lentement jusqu’à être quadruplés et restent détectables après plusieurs mois et peut-être même la vie . La réponse des antigènes et des anticorps humains dépend de l’état immunitaire de l’hôte et n’est présente que lors d’une infection primaire ou secondaire. Il n’existe pas de traitement spécifique ou de médicaments antiviraux pour la dengue. La physiopathologie de la dengue augmente la perméabilité vasculaire, ce qui entraîne une perte importante de plasma du compartiment intravasculaire vers l’espace extravasculaire.
Cette perte de liquide peut conduire à un choc et, sans correction appropriée, à une hypoxie, une acidose métabolique et finalement à la mort. Par conséquent, la prise en charge primaire nécessite des soins de soutien pour les patients hospitalisés avec un équilibre des fluides et des électrolytes. Le volume globulaire doit être contrôlé toutes les heures, toutes les 4 à 6 heures. Une perte de plasma significative est définie comme une augmentation de >20% du volume de l’hématocrite ou de l’hématocrite. Lorsqu’un patient atteint ces niveaux, un remplacement rapide et agressif du volume est nécessaire .
Le taux de remplacement du liquide de perfusion dépend du volume globulaire et du débit urinaire. Il existe de multiples fluides utilisés pour le remplacement des pertes plasmatiques, notamment le sérum physiologique, le lactate de Ringer ou l’acétate de Ringer, la solution de glucose diluée à 5%, le plasma ou les substituts du plasma tels que la dextrine 40 et le sang entier frais . En plus du remplacement des liquides par voie intraveineuse, des électrolytes peuvent être introduits par voie orale, car ils soulageront une partie de la soif et de la déshydratation dues à la fièvre. Des analgésiques de soutien comme l’acétaminophène peuvent être utilisés pour traiter la fièvre et d’autres symptômes. Les AINS et l’aspirine doivent être évités car ils pourraient précipiter le syndrome de Reye.
Lorsque les patients atteints de DHF se rétablissent, ils doivent répondre aux critères suivants avant de quitter l’hôpital : amélioration clinique visible, afébrile sans utilisation d’antipyrétiques pendant >24 heures, augmentation de l’appétit, hématocrite stable, débit urinaire adéquat, trois jours après le rétablissement d’une acidose métabolique sévère, numération plaquettaire >50 000/mm3, et pas de détresse respiratoire due à un épanchement pleural ou une ascite .
Prévention et éradication d’aedes aegypti
Aedes aegypti, le vecteur le plus répandu du virus de la dengue, est la cible principale des activités de surveillance et de contrôle. D’autres vecteurs, tels qu’Aedes albopictus, peuvent produire la dengue, mais les activités de surveillance et de contrôle des différents vecteurs ne doivent être envisagées que s’il existe des preuves fiables que ces vecteurs ont joué un rôle épidémiologiquement significatif dans la transmission des infections par la dengue . La première initiative visant à éliminer Aedes aegypti a eu lieu à Cuba en 1901. La fumigation et l’élimination des foyers de moustiques par la destruction des conteneurs abandonnés ont été les premières étapes de l’éradication du vecteur . Après l’apparition d’épidémies de fièvre jaune au Brésil en 1928 et 1932, il est devenu évident que la protection complète des populations urbaines dépendait de l’éradication absolue de l’Aedes aegyptimosquito ; cela a conduit à l’approbation par l’Organisation panaméricaine de la santé (OPS) du plan continental d’éradication de l’Aedes aegyptier en 1947 pour lutter contre la fièvre jaune urbaine. Depuis 1947, le Bureau sanitaire panaméricain (BSP) a encouragé intensément les campagnes dans tous les pays touchés, et leur succès a été démontré en 1962, lorsque 18 pays continentaux et un certain nombre d’îles des Caraïbes avaient réussi à éradiquer la maladie. Grâce à ces efforts, le génotype V du DENV-2 américain est le seul virus de la dengue qui subsiste aujourd’hui .
Malgré les efforts pour éradiquer le vecteur, Aedes aegypti n’a pas été éradiqué à Cuba, aux États-Unis, au Venezuela et dans plusieurs pays des Caraïbes . Des décennies d’efforts humains sans précédent pour éradiquer Aedes aegyptifell se sont effondrées très rapidement et ont conduit à une infestation. Le manque de surveillance et la détérioration de la structure du programme d’éradication, l’assainissement insuffisant de l’environnement et la participation insuffisante des communautés sont quelques-uns des facteurs qui ont conduit au déclin des efforts d’éradication du vecteur . À ce jour, il n’existe aucun vaccin pour prévenir les infections par la dengue. Takeda Vaccines Inc. développe un candidat-vaccin vivant atténué, appelé vaccin tétravalent contre la dengue (TDV), qui est composé d’une souche atténuée de DENV-2 (TDV-2) et de trois virus chimériques contenant les gènes des protéines prM et E de DENV-1, -3 et -4 qui ont été exprimés dans le contexte du squelette génomique atténué de TDV-2 (TDV-1, TDV-3 et TDV-4, respectivement). Le vaccin s’est révélé bien toléré et immunogène lors d’un essai clinique de phase 2 dans les pays endémiques de la dengue chez les adultes et les enfants.
Le vaccin est en phase 3 de développement . En outre, Sanofi Pasteur a développé un vaccin recombinant, vivant-atténué, tétravalent contre la dengue (CYD-TDV) qui a montré une sécurité et une efficacité cohérentes chez les individus de ≥9 ans dans les pays endémiques ; il est en phase avancée de développement . Dengvaxia (CYD-TDV) de Sanofi Pasteur a été enregistré pour la première fois au Mexique en décembre 2015 et a été évalué comme une série de 3 doses sur un calendrier de 0/6/12 mois dans des études cliniques de phase III . Il y a environ cinq candidats vaccins supplémentaires en cours d’évaluation dans les essais cliniques . Les voyageurs dans les zones endémiques de la dengue sont à risque de contracter la dengue ; ainsi, pour la prévention, ils devraient être encouragés à choisir des hébergements avec des fenêtres et des portes bien protégées, à utiliser un insectifuge, à porter des vêtements appropriés et à vider et couvrir toute eau stagnante qui peut éventuellement devenir des sites de reproduction des moustiques .
Situation mondiale actuelle
À l’heure actuelle, on s’attend à ce que l’incidence de la dengue continue à augmenter en raison de nombreux facteurs, notamment le statut socio-économique, le changement climatique continu, les voyages et la mondialisation. Les vaccins sont toujours en cours de développement et aucune thérapie antivirale spécifique n’existe actuellement pour répondre à la menace croissante de la dengue . L’estimation mondiale de l’incidence de la dengue se situe entre 50 et 200 millions. Cependant, l’utilisation d’approches cartographiques suggère récemment que le nombre de l’incidence est plus proche de 400 millions . En 2012, l’OMS a classé la dengue comme l’une des maladies virales vitales transmises par les moustiques. Cette classification est justifiée par l’importante propagation géographique du virus ainsi que de son vecteur dans des zones qui n’étaient pas touchées auparavant (Figure 5).
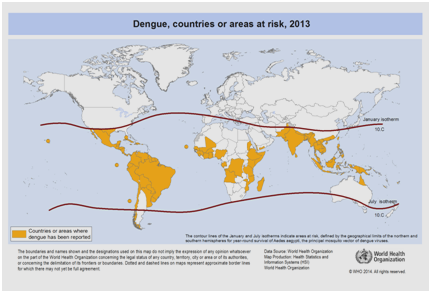
Figure 5 : Pays ou régions du monde où la dengue a été signalée en 2013, selon les données recueillies par l’Organisation mondiale de la santé .
Elle est également soutenue par le coût que la maladie entraîne avec elle. En comparant le fardeau de la dengue et d’autres maladies transmissibles dans la région touchée, la dengue cause beaucoup plus de souffrances humaines et constitue un fardeau plus important que les autres maladies à transmission vectorielle . Selon l’OMS, la dengue est la principale cause d’hospitalisation et de décès chez les enfants en Asie du Sud-Est. Selon une étude de Hammond et al., la majorité de la morbidité et de la mortalité liées à cette maladie est associée aux enfants plutôt qu’aux autres groupes d’âge. Les nourrissons âgés de 4 à 9 mois et les enfants âgés de 5 à 9 ans sont les plus touchés par la dengue (figure 6). La gravité de la maladie chez ces enfants est souvent due à une infection secondaire par le DENV. Une étude écologique réalisée par Dıaz-Quijano et Waldman en Amérique latine et dans les Caraïbes a révélé que les déterminants du taux de mortalité lié à la dengue dans ces populations comprenaient la durée de l’endémicité reconnue, la densité de population et les précipitations .
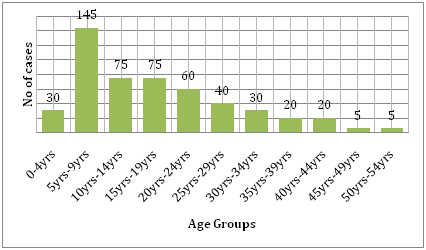
Figure 6 : Répartition de la cohorte d’étude à León par groupe d’âge .
En plus de l’impact de la morbidité et de la mortalité, le virus de la dengue fait peser un lourd fardeau financier sur les régions touchées, dont beaucoup sont mal équipées pour supporter ces coûts. En 2010, le fardeau financier du virus de la dengue a été estimé à 2,1 milliards de dollars par an en moyenne dans les Amériques (en dollars US 2010), avec une fourchette de 1 à 4 milliards de dollars dans les analyses de sensibilité et des variations substantielles d’une année à l’autre . Selon l’OMS, la dengue est désormais considérée comme un problème mondial, l’Asie-Pacifique comptant la plus forte proportion (75 %) de la population mondiale exposée au virus de la dengue. Le Pacifique occidental a également connu une augmentation continue du nombre de cas de DF signalés au cours de la dernière décennie .
Même avec l’absence de transmission de la DF au milieu du 20e siècle, il y a maintenant la présence d’une endémie accrue de DF indigène dans les Amériques. Rien que sur le continent américain, en 2010, plus de 1,6 million de cas de dengue ont été signalés, dont 49 000 cas de dengue sévère . En Afrique, les épidémies de dengue augmentent en taille et en fréquence mais ne sont pas systématiquement signalées à l’OMS. Entre 1960 et 2010, des cas sporadiques ont été signalés par 22 pays africains, comme le suggèrent les données disponibles sur les épidémies. En Europe, aucune épidémie de FD n’a été signalée depuis une flambée en Grèce en 1928. Il existe désormais des menaces d’épidémie en Europe, attribuée à Aedes albopictus en raison de voyages depuis des pays où la maladie est endémique. On estime qu’il y aura une augmentation de l’incidence de la maladie dans les années à venir en raison de facteurs de risque multifactoriels.