Introducción
La enfermedad renal crónica (ERC) tiene una alta prevalencia en todo el mundo. En China, casi 1 de cada 10 personas tiene algún grado de disfunción renal, lo que suma casi 150 millones de pacientes (1). La anemia y el hiperparatiroidismo secundario son las dos complicaciones más comunes asociadas a la ERC (2, 3). De hecho, se ha informado de que casi el 90% de los pacientes con ERC avanzada (clasificados como ERC en estadio 4 y 5) padecen anemia (4). Se ha demostrado que la aparición y la gravedad de la anemia están bien correlacionadas con la disminución de la tasa de filtración glomerular (4). La identificación, evaluación y tratamiento tempranos de la anemia pueden disminuir la morbilidad y la mortalidad, así como mejorar la calidad de vida de los pacientes con ERC.
El hiperparatiroidismo secundario se caracteriza por niveles elevados de hormona paratiroidea (PTH) en suero. El exceso de PTH puede perjudicar la eritropoyesis al ejercer un efecto tóxico directo sobre las células progenitoras eritroides y un efecto indirecto a través de la inducción de fibrosis en la médula ósea (5, 6). Además, la baja concentración de hemoglobina en pacientes urémicos puede ser el resultado de un aumento de la fragilidad osmótica de los eritrocitos debido a la elevada concentración de PTH (7). Se ha establecido una correlación inversa entre la PTH y los niveles de hemoglobina (8-10). Meytes et al. encontraron que las concentraciones de PTH dentro de 7,5-30 U/mL, que son comparables a los niveles séricos de PTH en pacientes urémicos, indujeron la inhibición significativa del crecimiento de las unidades formadoras de ráfagas (BFU-E) en cultivos de médula ósea murinos, lo que sugiere una posible vía de participación del exceso de PTH en la génesis de la anemia de la uremia (11).
Los agentes estimulantes de la eritropoyesis (AEE) se han convertido en una seña de identidad del tratamiento de la anemia en pacientes con ERC y son la medicación más prescrita en pacientes en diálisis, con una utilización del >95% en China (1). La primera eritropoyetina humana recombinante, la epoetina alfa, se autorizó en Estados Unidos en 1988 (12). La epoetina-alfa y la epoetina-beta son agentes terapéuticos de acción corta y rentables, y se administran de una a tres veces por semana en la mayoría de los pacientes con ERC. Sin embargo, su dosis aumenta con un intervalo de dosificación prolongado para alcanzar o mantener un nivel de hemoglobina objetivo. Epiao®(3.000 μ/tubo) es un tipo de Epoetina-alfa ampliamente utilizado en China, mientras que Recormon®(2.000 μ/tubo) es un tipo de Epoetina-beta más comúnmente utilizado en Europa, y se ha utilizado en China durante aproximadamente 4 años.
Los resultados de ensayos clínicos recientes han demostrado que las dosis que alcanzan objetivos de hemoglobina elevados suscitan la preocupación de un mayor riesgo de muerte o de resultados adversos como eventos tromboembólicos y accidentes cerebrovasculares (13-16). Andrews et al. descubrieron que una mayor frecuencia de dosis en un nivel de dosis alto aumentaba la incidencia de toxicidades trombóticas en comparación con los animales sometidos a dosis menos frecuentes en grupos de dosis más bajas, a pesar de que el hematocrito era similarmente alto en todos los grupos (17), lo que sugiere que un hematocrito alto no es el único factor causal que conduce a las toxicidades relacionadas con los AEE, sino que también se asocia con el nivel de dosis, la frecuencia de dosis y la duración de la dosis. Por lo tanto, debe prestarse mucha atención a las toxicidades relacionadas con los AEE independientes del hematocrito alto.
En la actualidad, se dispone de datos limitados sobre la posible relación entre la dosis de AEE y la PTH en pacientes urémicos mantenidos en hemodiálisis regular. Este estudio retrospectivo tuvo como objetivo investigar la asociación entre la dosis de AEE y los niveles de PTH intacta (iPTH) en pacientes en hemodiálisis, basándose en los datos clínicos del sistema de base de datos informáticos de nuestro hospital.
Materiales y métodos
Pacientes y procedimientos
Este estudio de cohorte retrospectivo se llevó a cabo desde febrero de 2015 hasta mayo de 2015 en el Hospital Xiamen Zhongshan, Universidad de Xiamen, China. Este estudio incluyó a pacientes urémicos en hemodiálisis mantenida durante al menos 3 meses, que utilizaron AEE para el tratamiento de la anemia. Se excluyeron del estudio los pacientes que cumplían los siguientes criterios (1) edad <18 años; (2) pacientes con infección activa, neoplasia, anemia ferropénica (definida como ferritina <100 ng/mL y saturación <20%), o hemorragia activa en los 3 meses siguientes; (3) pacientes con datos incompletos. Los pacientes elegibles se clasificaron en dos grupos, según el AEE utilizado: Grupo Recormon y grupo Epiao.
Recogida de datos
Los datos se obtuvieron de Jinshida, el sistema de base de datos informática del Hospital Xiamen Zhongshan, que recodificó los datos clínicos de 376 pacientes en hemodiálisis. Se recogieron los siguientes datos: edad, sexo, peso seco, diagnóstico de enfermedades primarias, nitrógeno ureico en sangre (BUN), creatinina sérica (Scr), hemoglobina, calcio, fósforo, albúmina, iPTH, ferritina sérica, saturación de transferrina y dosis de AEE. Estos datos se midieron por la mañana el día de la hemodiálisis (antes de la diálisis). De acuerdo con las directrices de la organización Kidney Disease Improving Global Outcomes (KDIGO), se definió como normal un nivel de hemoglobina entre 110 y 130 g/L en pacientes urémicos con hemodiálisis mantenida (8). Los valores de referencia para el calcio y el fósforo séricos se definieron como valores entre 2,1-2,54 y 1,1-1,78 mmol/L, respectivamente (18). Los pacientes se clasificaron además en función de los niveles de iPTH: 150, 300, 600 y 1.500 pg/mL (19, 20).
Etica del estudio
Este estudio se llevó a cabo analizando los datos retrospectivos obtenidos del Sistema de Registro Electrónico de Pacientes de nuestro hospital. El protocolo del estudio sobre la investigación en seres humanos fue aprobado por el Comité de Ética del Hospital Zhongshan de la Universidad de Xiamen. Se obtuvo el consentimiento informado por escrito de todos los sujetos.
Análisis estadístico
El análisis estadístico se realizó con el software SPSS para Windows versión 17.0. Los datos se expresaron como porcentajes o media ± error estándar de la media (SEM). Los datos demográficos y las mediciones de laboratorio entre los grupos se compararon mediante la prueba de chi-cuadrado de Pearson, la prueba exacta de Fisher o la corrección de continuidad de Yate. Un valor P <0,05 se consideró estadísticamente significativo.
Resultados
Características de los pacientes urémicos mantenidos en hemodiálisis regular
Un total de 240 pacientes urémicos mantenidos en hemodiálisis regular fueron incluidos en este estudio. Las características basales de los pacientes se muestran en la Tabla 1. No hubo diferencias significativas en la edad, el sexo, el peso seco, las enfermedades primarias, el BUN, el Scr, la hemoglobina, el fosfato sérico, el calcio, la albúmina, la ferritina sérica y la saturación de transferrina entre los grupos Recormon y Epiao (Tabla 1, P > 0,05).

Tabla 1. Características basales de los pacientes.
El nivel medio de hemoglobina de todos los sujetos fue de 103,15 ± 1,07 g/L. Los pacientes con un nivel de hemoglobina entre 110 y 130 g/L representaban el 30,4% (n = 84). La anemia se dividió en cinco clases basadas en el nivel de hemoglobina, según la gravedad de la anemia (21, 22): nivel de hemoglobina <60 g/L (2,1%, n = 5), nivel de hemoglobina ≥60 y <90 g/L (21,7%, n = 52), nivel de hemoglobina ≥90 y <110 g/L (38.7%, n = 93), nivel de hemoglobina ≥110 y <130 g/L (30,4%, n = 73), y nivel de hemoglobina ≥130 g/L (7,1%, n = 17).
Relación entre el grado de anemia y la PTHi
Se analizó la relación entre los diferentes grados de anemia y la PTHi. Los resultados revelaron que el nivel de hemoglobina se asoció negativamente con la PTHi (Figura 1A; Tabla 2; P < 0,05). Sin embargo, no se encontró ninguna asociación significativa entre la anemia y el nivel de calcio o fósforo séricos (Figura 1B; Tabla 2; P > 0,05 para ambos).
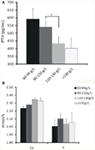
Figura 1. Relación entre las concentraciones de hemoglobina y los niveles de iPTH, calcio o fósforo séricos. (A) La concentración de hemoglobina aumentó a medida que disminuía el nivel de iPTH por estratificación. (B) No se encontró ninguna asociación significativa entre la concentración de hemoglobina y el nivel de calcio o fósforo en suero. Los datos se calcularon mediante la prueba t. *P < 0,05.

Tabla 2. Mediciones de los niveles séricos de calcio, fósforo y iPTH en función de los valores de hemoglobina por estratificación.
Los pacientes con 150-300 pg/mL de iPTH tenían los niveles más altos de hemoglobina, ferritina sérica y saturación de transferrina
Cuando el nivel de iPTH estaba dentro de los 150-300 pg/mL, los pacientes en hemodiálisis tenían los niveles medios más altos de hemoglobina, ferritina sérica y saturación de transferrina; que eran 106.25 g/L, 248,98 μg/L, y 30,97%, respectivamente (Figura 2).
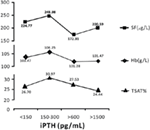
Figura 2. Los pacientes con niveles de iPTH dentro de 150-300 pg/mL tenían los niveles más altos de hemoglobina, ferritina sérica y saturación de transferrina. Los datos se expresan como porcentajes o media ± SEM.
Comparación de Recormon frente a Epiao en el tratamiento de la anemia
Los pacientes tratados con Recormon y Epiao tenían niveles de hemoglobina similares (103,54 ± 1,72 g/L, n = 98 frente a 102,59 ± 1,38 g/L, n = 142, P > 0,05; Figura 3A). Sin embargo, la dosis de Recormon (3.853,66 ± 225,13 μ/semana, n = 98) para el tratamiento de la anemia fue significativamente menor que la de Epiao (7.083,33 ± 264,93 μ/semana, n = 142, P < 0,05; Figura 3B, Tabla 1).
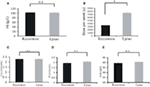
Figura 3. Comparación de Recormon frente a Epiao en el tratamiento de la anemia. (A) Los pacientes tratados con Recormon y Epiao tuvieron niveles de hemoglobina similares (103,54 ± 1,72 g/L, n = 98 frente a 102,59 ± 1,38 g/L, n = 142, P > 0,05). (B) La dosis de Recormon para el tratamiento de la anemia fue significativamente menor que la de Epiao, 3.853,66 ± 225,13 μ/semana, n = 98 frente a 7.083,33 ± 264,93 μ/semana, n = 142. (C-E) No hubo diferencias significativas en los niveles de calcio (C), fósforo (D) y albúmina (E) entre los grupos Recormon y Epiao. Los datos se calcularon mediante la prueba t; P > 0,05.
Los niveles séricos de calcio, fósforo y albúmina no fueron significativamente diferentes entre los grupos Recormon y Epiao (respectivamente, 2.27 ± 0,47 frente a 2,29 ± 0,01 mmol/L, P > 0,05; 1,94 ± 0,10 frente a 2,06 ± 0,04 mmol/L, P > 0,05; 39,5 ± 0,44 frente a 40,2 ± 0.35 g/L, P > 0,05; Figuras 3C-E; Tabla 1).
La relación entre las dosis de AEE y los niveles de iPTH
Para todos los pacientes en hemodiálisis, los niveles de iPTH en el grupo Recormon fueron más bajos que en el grupo Epiao (336.66 ± 57,76 pg/mL, n = 98 frente a 531,05 ± 39,57 pg/mL, n = 142; P < 0,05; Figura 4A; Tabla 1). Se encontró una tendencia similar en los pacientes en hemodiálisis con niveles de hemoglobina entre 110 y 130 g/L (319,50 ± 74,9 pg/mL en el grupo Recormon, n = 28 frente a 499,5 ± 64,38 pg/mL en el grupo Epiao, n = 45; P < 0,05; Figura 4A).
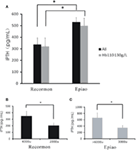
Figura 4. La asociación entre la dosis de AEE y los niveles de iPTH. (A) El nivel de iPTH en los grupos Recormon y Epiao. (B) En el grupo Recormon, los niveles de iPTH en los pacientes tratados con Recormon a 2.000 frente a 4.000 μ/semana. (C) En el grupo de Epiao, niveles de iPTH en pacientes tratados con Epiao a 3.000 y >6.000 μ/semana. Los datos se calcularon mediante la prueba t; *P < 0,05.
Entre los pacientes con niveles de hemoglobina entre 110 y 130 g/L, el nivel de iPTH fue de 201,54 ± 42.67 pg/mL (n = 10) en los pacientes tratados con Recormon a 2.000 μ/semana, que fue significativamente inferior al de los pacientes tratados con Recormon a 4.000 μ/semana (348,16 ± 117,9 pg/mL, n = 13; P < 0,05, Figura 4B). Del mismo modo, el nivel medio de iPTH en los pacientes tratados con Epiao a 3.000 μ/semana fue significativamente inferior al de los pacientes tratados con Epiao >6.000 μ/semana (347,15 ± 75,94 pg/mL, n = 12 frente a 661,01 ± 198,45 pg/mL, n = 27; P < 0,05, Figura 4C).
Discusión
Este estudio retrospectivo es el primero que aporta pruebas de que dosis más altas de AEE (Epoetina-alfa y -beta) podrían estar asociadas a niveles más altos de iPTH en pacientes urémicos mantenidos en hemodiálisis regular. Además, encontramos que los pacientes con niveles de iPTH dentro de 150-300 pg/mL tenían los niveles más altos de hemoglobina, ferritina sérica y saturación de transferrina, lo que era consistente con el nivel recomendado de iPTH basado en las directrices KDIGO (9).
La anemia es una de las complicaciones más comunes de la ERC. La Organización Mundial de la Salud ha definido la anemia como la presencia de una concentración de hemoglobina inferior a 13,0 g/dl en hombres y mujeres posmenopáusicas, o una concentración de hemoglobina <12,0 g/dl en el resto de mujeres. El uso de los AEE mejoró notablemente la vida de muchos pacientes anémicos con ERC. Sin embargo, se ha demostrado que las dosis altas de AEE se asocian a un mayor riesgo de resultados adversos en adultos y niños con ERC. Los pacientes tratados con dosis altas de AEE tienen un riesgo de mortalidad 1,2-1,5 mayor (23). En este estudio, encontramos una asociación inversa significativa entre los niveles de iPTH y las concentraciones de hemoglobina en pacientes en hemodiálisis tratados con AEE, lo que coincide con los hallazgos de estudios anteriores (8-10).
En este estudio, los pacientes de los grupos Recormon y Epiao presentaron concentraciones de hemoglobina similares; sin embargo, la dosis utilizada para Recormon fue significativamente menor que la de Epiao. También se encontró que el nivel de iPTH en el grupo de Recormon fue significativamente menor que en el grupo de Epiao. Para determinar aún más la asociación entre la dosis de AEE y los niveles de iPTH, analizamos los datos clínicos de los pacientes tratados con Recormon o Epiao por separado. El nivel de iPTH fue notablemente inferior en los pacientes tratados con Recormon a 2.000 μ/semana que en los tratados con Recormon a 4.000 μ/semana. Se encontró una tendencia similar en los pacientes tratados con Epiao a una dosis de 3.000 o 6.000 μ/semana, lo que sugiere que las dosis altas de AEE pueden estar relacionadas con niveles elevados de iPTH. Estos resultados indican que las toxicidades de los AEE no podrían explicarse únicamente por un hematocrito elevado. Dado que las dosis elevadas de AEE pueden estar asociadas a niveles elevados de PTHi en pacientes en diálisis mantenida, la mejor forma de tratar a los pacientes con enfermedad renal terminal es minimizar o suspender la dosis de AEE, especialmente en pacientes con eventos cardiovasculares o cerebrovasculares recientes, emergencias hipertensivas o eventos tromboembólicos agudos. De hecho, teniendo en cuenta el mayor riesgo de eventos cardiovasculares con concentraciones de hemoglobina casi normales y dosis elevadas de AEE en la ERC, en Taiwán no se recomienda utilizar dosis desproporcionadamente altas de AEE para lograr un nivel de hemoglobina dentro de 100-110 g/L (24).
Aunque la patogénesis de la anemia en la ERC es multifactorial, la falta de eritropoyetina es la principal causa de anemia en los pacientes con ERC (25). Otros factores que contribuyen a la anemia asociada a la ERC son la deficiencia de hierro, la anemia por inflamación, la supresión de la eritropoyesis, el acortamiento de la supervivencia de los glóbulos rojos por las toxinas urémicas y la pérdida de sangre, como la hemorragia gastrointestinal. Dado que la deficiencia de hierro es también un factor causal común de la anemia, en 1996 se fomentó la administración de suplementos de hierro por vía intravenosa en Taiwán. Según la experiencia del tratamiento de la anemia de la ERC en Taiwán, se puede lograr un objetivo razonable de hemoglobina utilizando la dosis más baja posible de AEE y la administración de suplementos de hierro por vía intravenosa (24).
Nuestro estudio tiene varias limitaciones. En primer lugar, este estudio observacional es un estudio de un solo centro. En segundo lugar, dado el potencial sesgo de confusión y de selección por indicación, es necesario interpretar estos datos con cautela. De hecho, nuestra observación sobre la asociación entre la PTHi y los AEE requiere una mayor exploración mediante estudios prospectivos longitudinales. En tercer lugar, hay un predominio en el número de pacientes tratados con Epiao (142 para Epiao frente a 98 para Rocormon), lo que probablemente se deba al precio relativamente barato de Epiao en comparación con Recormon (Tabla 1). En cuarto lugar, las intervenciones farmacológicas, como los agentes antihipertensivos, podrían haber dado lugar a fluctuaciones transitorias o incluso a interferencias en los niveles de iPTH o de hemoglobina.
En conclusión, este estudio demuestra que dosis más altas de AEE podrían estar asociadas a niveles más altos de iPTH en pacientes urémicos mantenidos en hemodiálisis regular. La implicación de dosis más altas de AEE en la patogénesis del hiperparatiroidismo secundario sigue sin estar clara y puede requerir más investigación. Nuestros hallazgos sugieren que el uso de la dosis más baja posible de AEE puede minimizar los riesgos potenciales, a la vez que se logra un objetivo razonable de hemoglobina.
Contribuciones de los autores
El manuscrito fue revisado y aprobado por todos los autores, y no está en consideración para su publicación en otro lugar en una forma similar y en cualquier idioma.
Declaración de conflicto de intereses
Los autores declaran que la investigación se llevó a cabo en ausencia de cualquier relación comercial o financiera que pudiera interpretarse como un potencial conflicto de intereses.
Financiación
Esta investigación fue apoyada por el Fondo del Programa de Innovación Médica de la provincia de Fujian (nº 2011027).
Abreviaturas
BUN, nitrógeno ureico en sangre; ERC, enfermedad renal crónica; AEE, agente estimulante de la eritropoyesis; Hb, hemoglobina; iPTH, hormona paratiroidea intacta; Scr, creatinina sérica.
1. Zhang L, Wang F, Wang L, Wang W, Liu B, Liu J, et al. Prevalencia de la enfermedad renal crónica en China: una encuesta transversal. Lancet (2012) 379:815-22. doi: 10.1016/S0140-6736(12)60033-6
PubMed Abstract | CrossRef Full Text | Google Scholar
2. Martin KJ, González EA. Enfermedad ósea metabólica en la enfermedad renal crónica. J Am Soc Nephrol (2007) 18:875-85. doi:10.1681/ASN.2006070771
PubMed Abstract | CrossRef Full Text | Google Scholar
3. Rodriguez M, Nemeth E, Martin D. The calcium-sensing receptor: a key factor in the pathogenesis of secondary hyperparathyroidism. Am J Physiol Renal Physiol (2005) 288:F253-64. doi:10.1152/ajprenal.00302.2004
PubMed Abstract | CrossRef Full Text | Google Scholar
4. Levin A, Thompson CR, Ethier J, Carlisle EJ, Tobe S, Mendelssohn D, et al. Aumento del índice de masa ventricular izquierda en la enfermedad renal temprana: impacto de la disminución de la hemoglobina. Am J Kidney Dis (1999) 34:125-34. doi:10.1016/S0272-6386(99)70118-6
PubMed Abstract | CrossRef Full Text | Google Scholar
5. Kwack C, Balakrishnan VS. Manejo de la hiporrespuesta a la eritropoyetina. Semin Dial (2006) 19:146-51. doi:10.1111/j.1525-139X.2006.00141.x
PubMed Abstract | CrossRef Full Text | Google Scholar
6. Gallieni M, Corsi C, Brancaccio D. Hyperparathyroidism and anemia in renal failure. Am J Nephrol (2000) 20:89-96. doi:10.1159/000013563
PubMed Abstract | CrossRef Full Text | Google Scholar
7. Wu SG, Jeng FR, Wei SY, Su CZ, Chung TC, Chang WJ, et al. Red blood cell osmotic fragility in chronically hemodialyzed patients. Nephron (1998) 78:28-32. doi:10.1159/000044878
PubMed Abstract | CrossRef Full Text | Google Scholar
8. Baradaran A, Nasri H. Intensificación de la anemia por hiperparatiroidismo secundario en pacientes en hemodiálisis. Med J Islam Acad Sci (2001) 14(4):161-6.
Google Scholar
9. Sliem H, Tawfik G, Moustafa F, Zaki H. Relación del hiperparatiroidismo secundario asociado con el factor de crecimiento de fibroblastos-23 en suero en la enfermedad renal terminal: un estudio de casos y controles. Indian J Endocrinol Metab (2011) 15:105-9. doi:10.4103/2230-8210.81939
PubMed Abstract | CrossRef Full Text | Google Scholar
10. Trovato GM, Carpinteri G, Spina S, Squatrito G, Catalano D, Iannetti E. Hiperparatiroidismo, anemia y eritropoyetina: efectos sobre la función sistólica de los pacientes en diálisis. Abstracts of 31 st Congress of European Renal Association/European dialysis ND Transplantation Association, September 5-8, 1999 Madrid. Nephrol Dial Transpl (1999) 14:190.
Google Scholar
11. Meytes D, Bogin E, Ma A, Dukes PP, Massry SG. Efecto de la hormona paratiroidea en la eritropoyesis. J Clin Invest (1981) 67:1263-9. doi:10.1172/JCI110154
PubMed Abstract | CrossRef Full Text | Google Scholar
12. Eschbach JW, Abdulhadi MH, Browne JK, Delano BG, Downing MR, Egrie JC, et al. Eritropoyetina humana recombinante en pacientes anémicos con enfermedad renal terminal. Resultados de un ensayo clínico multicéntrico de fase III. Ann Intern Med (1989) 111(12):992-1000. doi:10.7326/0003-4819-111-12-992
PubMed Abstract | CrossRef Full Text | Google Scholar
13. Besarab A, Bolton WK, Browne JK, Egrie JC, Nissenson AR, Okamoto DM, et al. The effects of normal as compared with low hematocrit values in patients with cardiac disease who are receiving hemodialysis and epoetin. N Engl J Med (1998) 339:584-90. doi:10.1056/NEJM199808273390903
PubMed Abstract | CrossRef Full Text | Google Scholar
14. Singh AK. ¿Debemos mantener los niveles de hemoglobina como una medida de resultado viable? Nephrol News Issues (2010) 24(15-6):18.
PubMed Abstract | Google Scholar
15. Phrommintikul A, Haas SJ, Elsik M, Krum H. Mortalidad y concentraciones de hemoglobina objetivo en pacientes anémicos con enfermedad renal crónica tratados con eritropoyetina: un meta-análisis. Lancet (2007) 369:381-8. doi:10.1016/S0140-6736(07)60194-9
PubMed Abstract | CrossRef Full Text | Google Scholar
16. Regidor D, McClellan WM, Kewalramani R, Sharma A, Bradbury BD. Cambios en la dosificación de agentes estimulantes de la eritropoyesis (AEE) y en los niveles de hemoglobina en pacientes con enfermedad renal crónica no sometidos a diálisis en Estados Unidos entre 2005 y 2009. Nephrol Dial Transplant (2011) 26:1583-91. doi:10.1093/ndt/gfq573
PubMed Abstract | CrossRef Full Text | Google Scholar
17. Andrews DA, Pyrah ITG, Boren BM, Tannehill-Gregg SH, Lightfoot-Dunn RM. El hematocrito alto resultante de la administración de agentes estimulantes de la eritropoyesis no es totalmente predictivo de mortalidad o toxicidades en especies preclínicas. Toxicol Pathol (2014) 42:510-23. doi:10.1177/0192623313486317
PubMed Abstract | CrossRef Full Text | Google Scholar
18. Enfermedad renal: Improving Global Outcomes (KDIGO) CKD-MBD Work Group. Guía de práctica clínica KDIGO para el diagnóstico, la evaluación, la prevención y el tratamiento de la enfermedad renal crónica-trastorno mineral y óseo (CKD-MBD). Kidney Int Suppl (2009) 113:S1-130. doi:10.1038/ki.2009.188
CrossRef Full Text | Google Scholar
19. Tentori F, Blayney MJ, Albert JM, Gillespie BW, Kerr PG, Bommer J, et al. Riesgo de mortalidad para los pacientes en diálisis con diferentes niveles de calcio sérico, fósforo y PTH: el estudio Dialysis Outcomes and Practice Patterns (DOPPS). Am J Kidney Dis (2008) 52(3):519-30. doi:10.1053/j.ajkd.2008.03.020
PubMed Abstract | CrossRef Full Text | Google Scholar
20. Fundación Nacional del Riñón. Guías de práctica clínica K/DOQI para la enfermedad renal crónica: evaluación, clasificación y estratificación. Am J Kidney Dis (2002) 39(2 Suppl 1):S1-266.
Google Scholar
21. Pisoni RL, Bragg-Gresham JL, Young EW, Akizawa T, Asano Y, Locatelli F, et al. Manejo de la anemia y resultados de 12 países en el Dialysis Outcomes and Practice Patterns Study (DOPPS). Am J Kidney Dis (2004) 44(1):94-111. doi:10.1053/j.ajkd.2004.08.005
PubMed Abstract | CrossRef Full Text | Google Scholar
22. Enfermedad renal: Improving Global Outcomes (KDIGO) Grupo de trabajo sobre anemia. Guía de práctica clínica KDIGO para la anemia en la enfermedad renal crónica. Kidney Int Suppl (2012) 2:279-335.
Google Scholar
23. Suttorp MM, Hoekstra T, Mittelman M, Ott I, Krediet RT, Dekker FW, et al. Tratamiento con altas dosis de agentes estimulantes de la eritropoyesis y mortalidad: análisis con un enfoque secuencial de Cox y un modelo estructural marginal. Pharmacoepidemiol Drug Saf (2015) 24(10):1068-75. doi:10.1002/pds.3855
PubMed Abstract | CrossRef Full Text | Google Scholar
24. Hung SC, Kuo KL, Tarng DC, Hsu CC, Wu MS, Huang T-P. Manejo de la anemia en pacientes con enfermedad renal crónica: Taiwan practice guidelines. Nephrology (Carlton) (2014) 19:735-9. doi:10.1111/nep.12332
PubMed Abstract | CrossRef Full Text | Google Scholar
25. Randolph JF, Scarlett JM, Stokol T, MacLeod JN. Eficacia clínica y seguridad de la eritropoyetina canina recombinante en perros con anemia por insuficiencia renal crónica y perros con aplasia de glóbulos rojos inducida por eritropoyetina humana recombinante. J Vet Intern Med (2004) 18:81-91. doi:10.1111/j.1939-1676.2004.tb00139.x
CrossRef Full Text | Google Scholar