24º Informe Anual sobre el Glaucoma
Siga los siguientes enlaces para leer otros artículos de la actualización anual sobre el glaucoma:
Cuidado del glaucoma con precisión láser
La locura de la SMIG: Un atlas de opciones
Cómo gestionar las cirugías invasivas de glaucoma
Glaucoma: Estilos de vida de los ricos y famosos en antioxidantes (obtenga 2 créditos CE)
Los expertos aún no han llegado a un consenso sobre una etiología universalmente aceptada del glaucoma. Sin embargo, sí están de acuerdo en esto: la reducción de la presión intraocular (PIO) es el único factor de riesgo modificable para frenar su progresión. La farmacoterapia tópica es el enfoque tradicional de primera línea, y las opciones son más abundantes que nunca.
Este artículo, tercera parte de nuestra serie «Tome las riendas del glaucoma», explora los numerosos medicamentos que pueden emplear los DO, con consejos sobre cuándo utilizar cada terapia para cada paciente.
Autonomía temprana
Los medicamentos que actúan sobre el sistema nervioso autónomo (es decir, colinérgicos y adrenérgicos) han sido la base de la terapia del glaucoma desde el siglo XIX.1,2 Los colinérgicos inducen la miosis, que estira y estimula la malla trabecular (MT) para aumentar el flujo de salida acuoso en ella y en el canal de Schlemm.3 Los miembros de esta clase incluyen la pilocarpina, el carbacol, la fisostigmina, la neostigmina y el ecotiofato. De ellos, sólo la pilocarpina sigue siendo de uso rutinario. El tratamiento presenta una respuesta relacionada con la dosis, con una disminución de la PIO de aproximadamente un 20% cuando se prescribe QID.4
Encargarse del glaucoma
Siga los enlaces siguientes para leer otros artículos de nuestra serie de cuatro partes sobre el glaucoma:
Primera parte: Glaucoma: Una cruzada de atención primaria
Segunda parte: Cómo preparar su caja de herramientas de diagnóstico
Cuarta parte: Desempeñe su papel en el cuidado postoperatorio del glaucoma
Aunque es eficaz, el uso de colinérgicos está limitado por sus efectos secundarios oculares y sistémicos. Estos incluyen espasmo del músculo ciliar (con dolor de cabeza asociado y miopía inducida), miosis, toxicidad corneal, enrojecimiento, uveítis, posible formación de cataratas, depresión respiratoria y malestar gastrointestinal. Además, los medicamentos más nuevos tienen una mayor eficacia en la reducción de la PIO, lo que hace que los colinérgicos se reserven para casos específicos en los que el efecto miótico pueda tener un beneficio añadido, como el cierre agudo del ángulo.
Los agonistas adrenérgicos, por otra parte, inciden en los receptores adrenérgicos alfa o beta (o en ambos si no son selectivos). La epinefrina, el principal agente no selectivo, reduce la PIO disminuyendo primero la producción acuosa y aumentando después el flujo de salida a través del TM.5 Desgraciadamente, su aplicación es limitada debido a sus importantes efectos secundarios sistémicos. La dipivefrina, un profármaco de la epinefrina desarrollado en la década de 1970, permite utilizar concentraciones mucho más bajas del compuesto original, con menos efectos sistémicos.6 Los adrenérgicos no selectivos tienen un uso mínimo en la actualidad, excepto en los casos en los que otros fármacos pueden estar contraindicados.
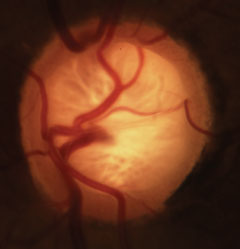
Ventosas glaucomatosas con pérdida característica del borde neurorretiniano, lámina y alteración de la vasculatura. Haga clic en la imagen para ampliarla.
Bloqueantes beta
Los antagonistas adrenérgicos, o beta (β)-bloqueantes, inhiben la producción acuosa y representan el estándar con el que se comparan los nuevos medicamentos. En concreto, los β-bloqueantes reducen la ultrafiltración, lo que limita la disponibilidad de sustrato de humor acuoso disponible para su transmisión a la cámara posterior.1,7,8 Estos medicamentos pueden ser no selectivos, lo que significa que inhiben ambas isoformas de los receptores β-adrenérgicos (β1 y β2), o cardioselectivos, que tienen una afinidad mucho mayor por el receptor β1. El β2 es el receptor adrenérgico predominante del ojo, por lo que los agentes no selectivos tendrán un mayor impacto en el control de la PIO.9,10
Los β-bloqueantes tópicos incluyen timolol, levobunolol, metipranolol, carteolol y betaxolol. Sólo el betaxolol es cardioselectivo, lo que lo hace útil en ciertas contraindicaciones, pero puede ser menos eficaz para reducir la PIO.11 Los betabloqueantes reducen la PIO entre un 20% y un 30% y pueden administrarse dos veces al día. También pueden administrarse una vez al día, sobre todo cuando se utilizan soluciones en forma de gel debido a su mayor tiempo de contacto ocular.12,13 Los antagonistas adrenérgicos pueden tener un menor impacto durante el sueño, por lo que debe tenerse cuidado cuando los β-bloqueantes se administran cerca de la hora de acostarse, especialmente si se prescriben como régimen de una vez al día.14,15 Si los pacientes están tomando β-bloqueantes sistémicos, el efecto hipotensor ocular de los β-bloqueantes tópicos se reduce, y podría considerarse la utilización de otras clases de medicamentos tópicos.16
Aunque esta clase de medicamentos debe evitarse principalmente en las afecciones pulmonares o cardíacas, en casos seleccionados puede ser razonable considerar el tratamiento con betabloqueantes. Sin embargo, esto debe hacerse con el consentimiento del especialista apropiado (cardiología o pulmonar).
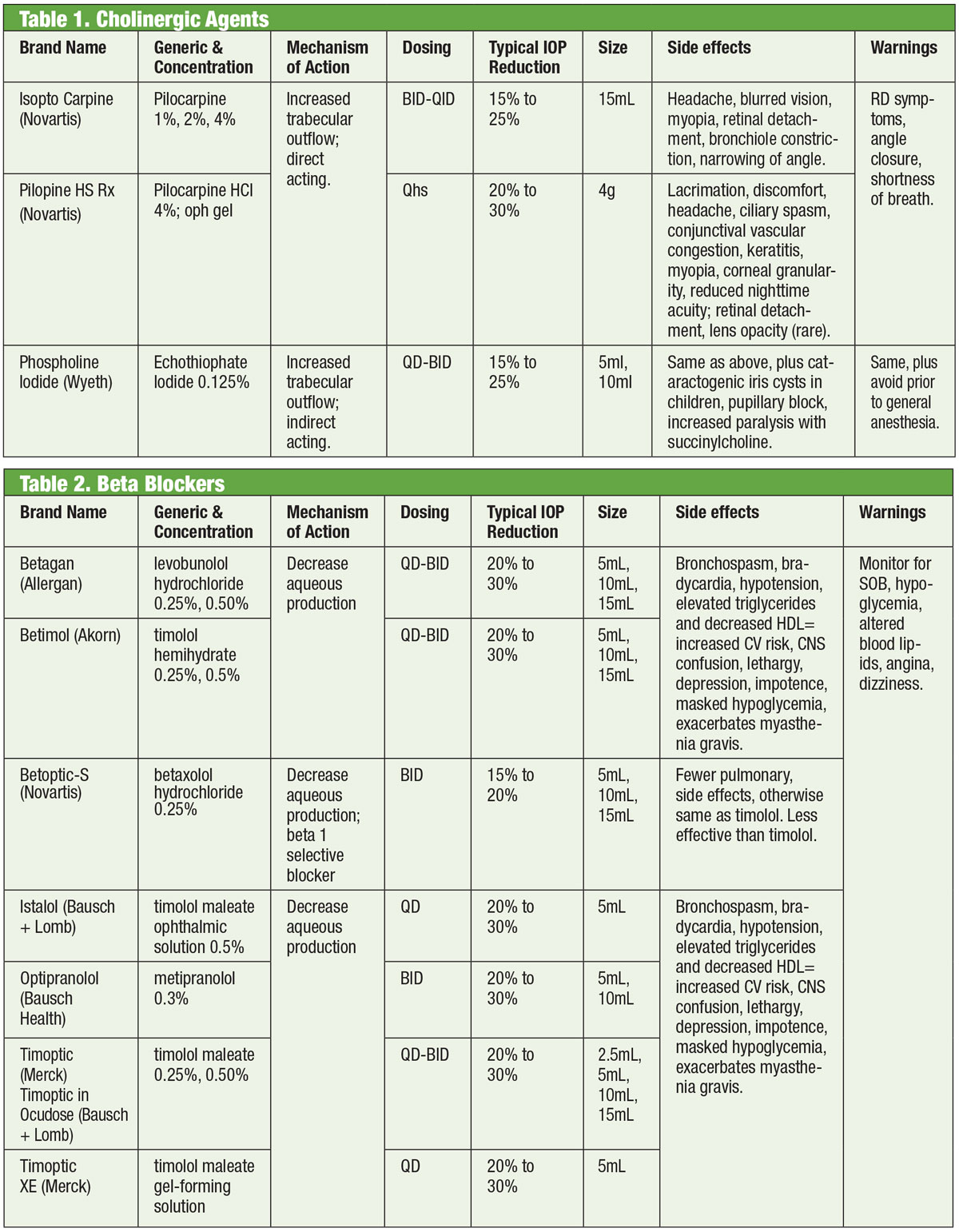
Tablas: Bruce Onofrey, OD, RPh. Haga clic en la imagen para ampliarla.
En general, sin embargo, debe evitarse el uso de β-bloqueantes en aquellos con bloqueo auriculoventricular, bradicardia sinusal y enfermedad pulmonar obstructiva.17
Inhibidores de la anhidrasa carbónica
Los investigadores han reconocido la capacidad de los inhibidores de la anhidrasa carbónica (IAC) orales para disminuir la PIO desde la década de 1950.18 Lo consiguen suprimiendo la producción acuosa.18 Sin embargo, los efectos secundarios sistémicos (como fatiga, trastornos gastrointestinales y parestesias) limitan su uso crónico en el glaucoma.18 Los IAC orales se siguen utilizando en los casos en los que los IAC tópicos causan hipersensibilidad o cuando se excluye el uso de gotas, así como en los casos de cierre agudo del ángulo.18 Los intentos de formular una variedad tópica tuvieron éxito con la introducción de la dorzolamida a mediados de la década de 1990 y, poco después, de la brinzolamida.19
Existen al menos siete isoenzimas diferentes de la anhidrasa carbónica (AC), siendo la AC-II de los procesos ciliares la que participa predominantemente en la producción acuosa.18 Tanto la dorzolamida como la brinzolamida son potentes inhibidores de esta isoenzima, pero presentan varias diferencias clínicamente relevantes. Por ejemplo, la dorzolamida tiene un pH de 5,6 mientras que la brinzolamida tiene un pH de 7,5. Además, la brinzolamida está disponible en forma de suspensión. Éstas son sólo algunas de las propiedades que pueden explicar los efectos secundarios individuales de los productos, que pueden incluir escozor en el caso de la dorzolamida y visión borrosa en el caso de la brinzolamida.19
Aunque los medicamentos están etiquetados por la FDA para una dosis TID, algunos profesionales optan por la administración BID. En el caso de la brinzolamida, los ensayos de fase III informan de reducciones de la PIO clínicamente equivalentes con regímenes BID o TID.20 Otros informan de que no hay diferencias estadísticamente significativas entre la dosificación BID o TID con la dorzolamida.18 Alternativamente, otros abogan por la dosificación TID para la monoterapia y la dosificación BID cuando se utiliza como terapia adjunta.21
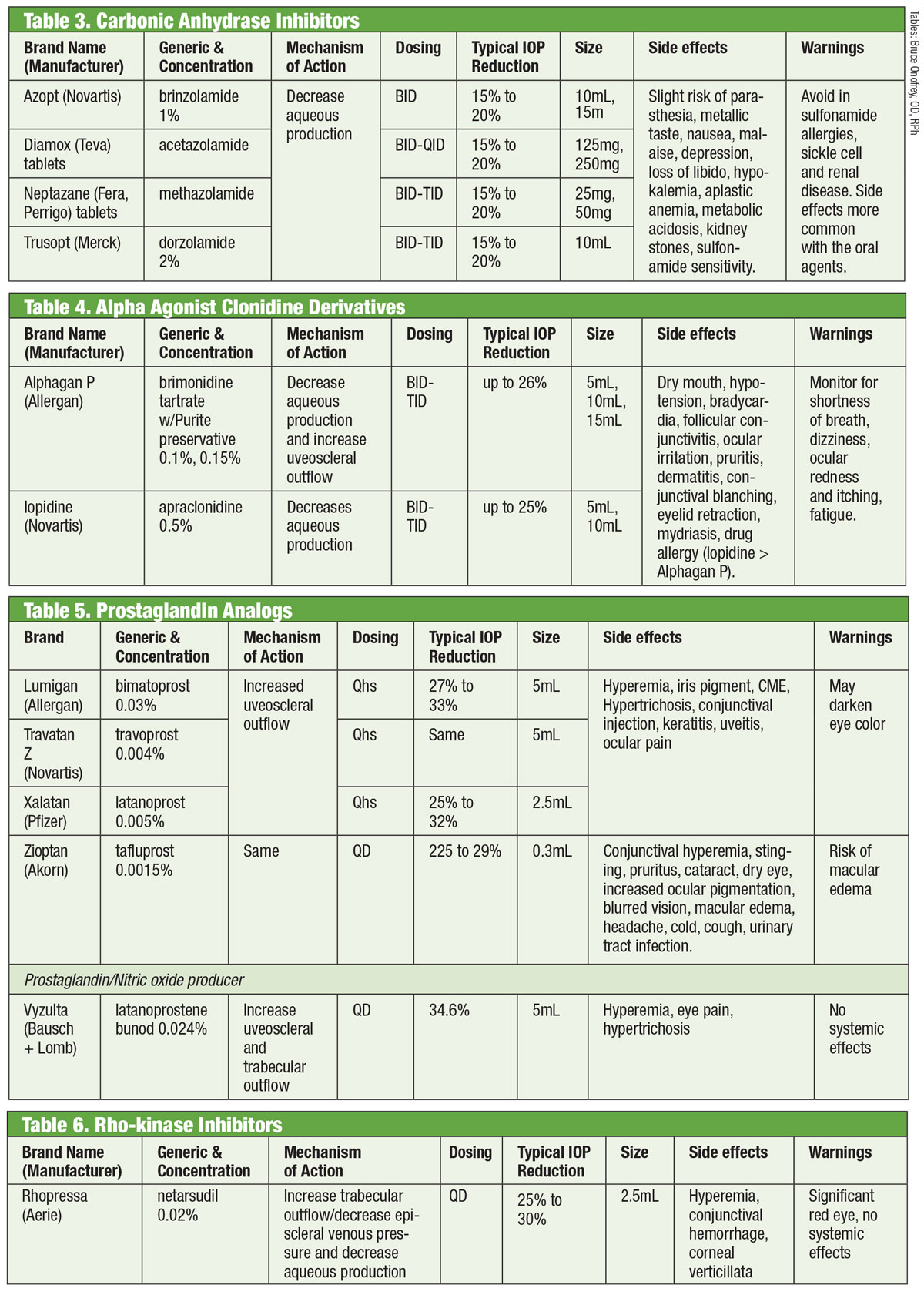
Tablas: Bruce Onofrey, OD, RPh. Haga clic en la imagen para ampliarla.
Agonistas alfa
La clonidina fue el primer agonista alfa (AA) eficaz para reducir la PIO. Sin embargo, incluso en forma tópica producía profundos efectos secundarios sistémicos de bradicardia, sedación e hipotensión.22 La sustitución del grupo amida de la apraclonidina disminuyó la penetración en la barrera hematoencefálica y, por tanto, los efectos secundarios. Lamentablemente, su eficacia disminuida con el tiempo y una mayor incidencia de alergia ocular la limitan a un uso a corto plazo.
Introducida en 1997, la brimonidina es un potente AA con una selectividad 32 veces mayor para los adrenorreceptores β2 que la apraclonidina.22 Disminuye la PIO a través de un mecanismo doble de disminución de la producción acuosa y de aumento del flujo uveoescleral.23 Al igual que su predecesor, presenta una notable tasa de alergia (hasta el 20%), que puede producirse hasta ocho meses después del inicio del tratamiento.22 Se han desarrollado tres formulaciones, cada una de ellas con una eficacia similar: 0,2% con cloruro de benzalconio (BAK); y 0,15% y 0,1% con el conservante Purite.24 Desde entonces, Allergan ha suspendido la formulación conservada con BAK.
The Straight Dope
La marihuana medicinal ha sido noticia últimamente, gracias a una serie de cambios legislativos en Estados Unidos. Aunque se ha investigado como método para reducir la PIO desde la década de 1970, los investigadores sólo han descubierto que es capaz de reducir la PIO durante breves períodos de tiempo. Esto, unido a su perfil de efectos secundarios, lo convierte en un mal candidato para el tratamiento. Sin embargo, la investigación afirma que puede tener un papel en «los pacientes con glaucoma en fase terminal a los que les ha fallado el tratamiento médico máximo y la cirugía o que son malos candidatos para la cirugía».
Sun X, Xu C, Chadha N,et al. Marihuana para el glaucoma: ¿una receta para el desastre o un tratamiento? Yale J Biol Med. 2015 Sep; 88(3): 265-9.
Aunque los efectos secundarios se correlacionan en su mayoría con el uso de prostaglandinas, la literatura muestra uveítis anterior inducida por brimonidina.25 La duración osciló entre siete días y cinco años con una media de casi 20 meses.
Análogos de las prostaglandinas
Proporcionan la reducción de la PIO más sólida de todas las gotas al mejorar el flujo acuoso uveoescleral. Los análogos de las prostaglandinas (PGA) se unen a los receptores del cuerpo ciliar e inducen la relajación del músculo liso, y alteran la matriz extracelular dentro del músculo ciliar para aumentar el flujo acuoso a través de las vías uveoesclerales.26 Si se administran una vez al día, normalmente a la hora de acostarse, los AGP reducen la PIO entre un 30% y un 35%; las opciones son latanoprost, bimatoprost, travoprost y tafluprost (suministrados en una dosis única, sin conservantes).26 El efecto secundario más común de los AGP es la hiperemia conjuntival, a menudo en las primeras semanas tras el inicio del tratamiento.26 También puede observarse irritación ocular, exacerbación de las condiciones inflamatorias existentes (edema macular, iritis), atrofia de la almohadilla de grasa periorbital, pigmentación de la piel periocular, las pestañas y el iris e hipertricosis.26
Una nueva variante en la categoría de los análogos de las prostaglandinas es el latanoprosteno bunod 0,024%. Este compuesto tiene un mecanismo doble: aumentar el flujo de salida uveoescleral y mejorar el flujo de salida de la malla trabecular a través del impacto del óxido nítrico.27 El ojo descompone el latanoprosteno bunod dos veces para producir los componentes activos ácido de latanoprost y óxido nítrico.28 Este último incide en una vía de señalización que relaja los componentes contráctiles del TM, lo que aumenta el flujo de salida.28 El impacto adicional reduce la PIO >1 mm Hg frente a latanoprost solo en múltiples puntos temporales, con una reducción total de la PIO que oscila entre 7,5 mm Hg y 9,1 mm Hg. Los efectos secundarios con latanoprosteno bunod fueron comparables a los de latanoprost solo, con posiblemente menos pigmentación periocular e hipertricosis, según los investigadores.28,29
Inhibidores de ROCK
En un ojo normal, la principal vía de drenaje del humor acuoso es la MT. La resistencia del humor acuoso a través de esta estructura aumenta en los pacientes con glaucoma, lo que eleva la PIO.30 Hasta hace poco, los medicamentos para el glaucoma no se dirigían a esta estructura. Eso cambió en 2017 con la introducción de Rhopressa (netarsudil 0,02%, Aerie), un inhibidor de la rho-cinasa (ROCK).
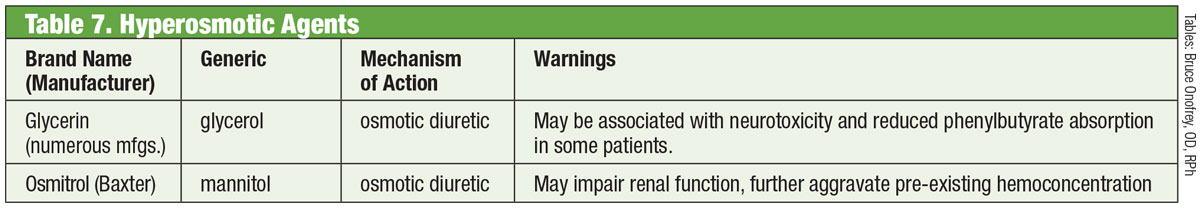
Tabla: Bruce Onofrey, OD, RPh. Haga clic en la imagen para ampliarla.
La Rho-cinasa se expresa ampliamente en muchos tejidos, incluido el TM, donde promueve el ensamblaje de las fibras de tensión de actina y regula la contracción celular.31 Los inhibidores de ROCK aumentan el flujo acuoso al disminuir la contracción celular impulsada por la actina y la miosina y reducir la producción de proteínas de la matriz extracelular.32 Rhopressa también tiene una acción inhibidora contra el transportador de norepinefrina (NET), por lo que es un inhibidor de ROCK/NET. El mecanismo NET puede ser el resultado de la reducción del flujo sanguíneo al cuerpo ciliar a través de la vasoconstricción inducida por la norepinefrina, lo que resulta en la disminución de la producción acuosa.33 Además, netarsudil también disminuye la presión venosa epiescleral (EVP), proporcionando así múltiples vías para la reducción de la PIO.32 El efecto secundario ocular más común es la hiperemia ocular (alrededor de la mitad de los pacientes tratados), que en su mayor parte es leve, transitoria y de resolución automática.32
De hecho, el propio rho desempeña un papel importante en el crecimiento y la orientación de los axones, así como en la regulación de la supervivencia y la muerte de las neuronas.34 Los investigadores descubrieron que, tras una lesión del nervio óptico, la aplicación tópica de netarsudil reduce la muerte de las células ganglionares de la retina y favorece la regeneración axonal.34
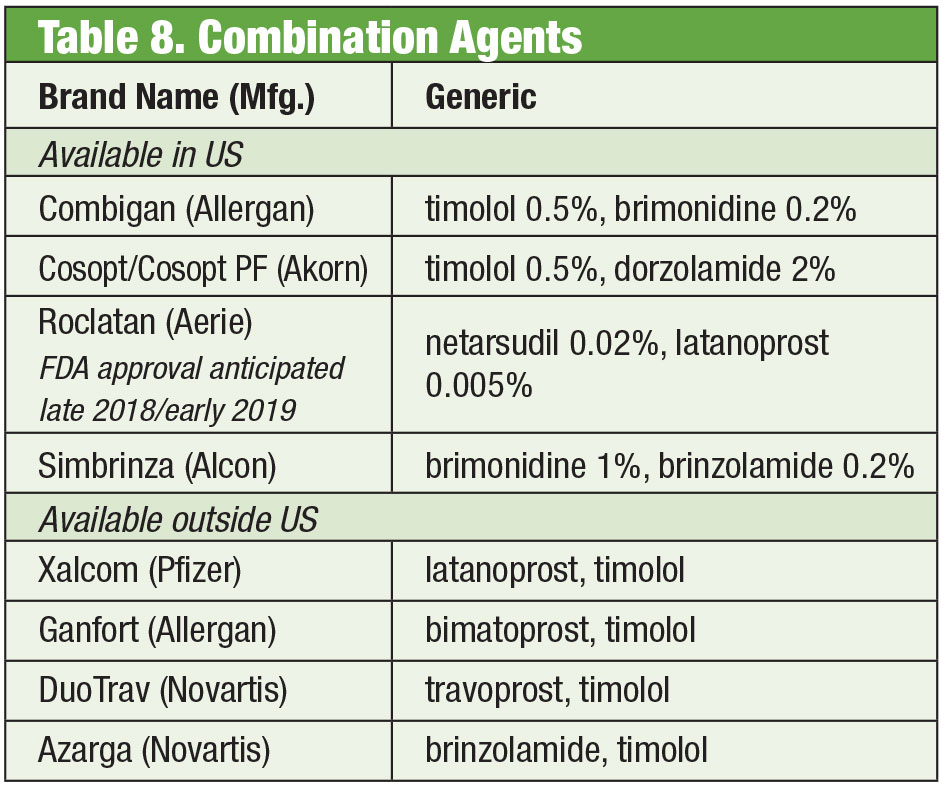
Combinación
A veces los pacientes necesitan más de lo que ofrecen los productos disponibles. La sensibilidad del paciente o la toxicidad de la superficie ocular por el uso crónico de conservantes puede llevar a la búsqueda de alternativas. Algunos medicamentos compuestos están disponibles sin conservantes. Si el cumplimiento es un problema, estas mezclas pueden contener hasta cuatro medicamentos en un solo frasco. Además, muchas combinaciones fijas se han utilizado eficazmente fuera de los Estados Unidos, pero actualmente no están aprobadas por la FDA; la elaboración de compuestos permite a los médicos estadounidenses acceder a esos regímenes. Si el coste es una limitación, la formulación puede ser una ventaja añadida. Aunque el producto compuesto a menudo no está cubierto por el plan de seguros del paciente, el precio de uno o dos productos combinados puede ser más rentable que el de múltiples opciones de un solo medicamento, incluso formulaciones genéricas. Dos farmacias de compuestos ofrecen múltiples variaciones preestablecidas: Simple Drops de Imprimis Pharmaceuticals y la línea de productos Omni de Ocular Science. También es posible una personalización adicional en cada una de ellas.
Aunque los agentes individuales están aprobados por la FDA, determinadas combinaciones pueden no estarlo. El profesional debe sopesar los riesgos y los beneficios de su cumplimiento.
Productos compuestos para el glaucoma:
Gotas Simples (Imprimis Pharmaceuticals)
Todas disponibles sin conservantes.
– Tim-Lat PF (timolol/latanoprost)
– Brim-Dor PF (brimonidina/dorzolamida)
– Tim-Brim-Dor PF (timolol/brimonidina/dorzolamida)
– Tim-Dor-Lat PF (timolol/dorzolamida/latanoprost)
– Tim-Brim-Dor-Lat PF (timolol/brinzolamida/dorzolamida/latanoprost)
– Dor-Tim (dorzolamida/timolol)
– Dorzolamida PF
– Latanoprost PF
Omni Drops (Ocular Science)
Contienen cloruro de benzalconio, pero en concentraciones más bajas (0.001%) que las formulaciones genéricas comunes (0,002%).
– Timolol/latanoprost
– Timolol/brimonidina/dorzolamida (fórmula AM)*
– Timolol/brimonidina/dorzolamida/latanoprost (fórmula PM)*
* Destinado a ser utilizado al unísono, con la versión AM que carece de la prostaglandina, que se suele dosificar sólo una vez al día.
Productos combinados fijos
A pesar de la eficacia de estos productos individuales, es frecuente que muchos pacientes con glaucoma requieran múltiples terapias para controlar su enfermedad.35 Cuando la terapia dual es necesaria, puede ser mejor ofrecer el mismo dispensador, promoviendo un mayor cumplimiento y reduciendo el impacto de la toxicidad en la superficie ocular.36 El timolol se combina con la brimonidina (en forma de Combigan, Allergan) y la dorzolamida (en forma de Cosopt, Akorn), ambas dosificadas dos veces al día, con una opción sin conservantes disponible para el producto timolol-dorzolamida. Otra combinación de dos veces al día, Simbrinza, combina brimonidina y dorzolamida. Las combinaciones fijas muestran una buena eficacia tanto como tratamiento primario como complemento de los AGP. Los efectos secundarios son comparables a los de los componentes individuales.
Adherencia/Percepción del paciente
Aunque la decisión de recomendar un tratamiento puede ser compleja y depende de muchos factores, una vez que el médico y el paciente acuerdan iniciar la terapia, deben reconocerse ciertos antecedentes y emplearse principios básicos.
Haga clic en la imagen para ampliarla.
La progresión del campo visual y la gravedad de la enfermedad están relacionadas con una mala adherencia.37 Según un estudio, los pacientes con enfermedades crónicas utilizan, por término medio, entre el 30% y el 70% de las dosis de medicación prescritas, y el 50% abandona la medicación en los primeros meses de tratamiento.38 La adherencia a la medicación para el glaucoma es similarmente pobre a la de otras enfermedades crónicas.38 En consecuencia, puede existir una brecha de eficacia-efectividad en la que, aunque se ha demostrado que los medicamentos tópicos son eficaces en grandes estudios clínicos, en la práctica pueden ser ineficaces debido al incumplimiento del paciente.39
Los principales factores que contribuyen a la mala adherencia en el glaucoma son, entre otros, el perfil de efectos secundarios de los medicamentos, el coste de la terapia, la educación del paciente y la relación médico-paciente.40 Además, la enfermedad puede ser asintomática hasta una fase tardía de su evolución, con una falta de conciencia de la pérdida del campo visual.41
Y ahora algo completamente diferente
Los medicamentos han sido la columna vertebral del tratamiento del glaucoma durante más de un siglo, y el desarrollo de nuevos fármacos continúa sin cesar. Pero algunos investigadores están buscando alternativas más allá del frasco. Unas gafas dotadas de una bobina electromagnética, unidas a una lente de contacto que contiene un rastro de oro, podrían algún día ayudar a reducir la PIO. Desarrollado por una empresa llamada Bionode, el combo está diseñado para generar una corriente eléctrica que fluye a través de los músculos ciliares para estimular la vía de drenaje natural y disminuir la PIO.
Academia Americana de Oftalmología. Las gafas podrían tratar algún día el glaucoma. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Consultado el 3 de julio de 2018.
Una barrera adicional para la adherencia es la dificultad con la instilación de las gotas y el programa de dosificación.42 De hecho, hasta el 80% de los pacientes contaminan sus gotas al tocarse la cara, hasta el 61% no se instilan exactamente una gota y, lo que es más grave, hasta el 37% se salta el ojo con la gota.43 El profesional nunca debe asumir que el paciente es competente con la instilación de las gotas. Antes de iniciar el tratamiento con gotas, hay que enseñar al paciente a instilarlas de forma adecuada y hacer que demuestre la instilación con éxito antes de salir de la consulta. Esto puede delegarse eficazmente en un técnico optométrico y reforzarse con un folleto educativo sobre la técnica (PDF imprimible en www.glaucoma.org/treatment/eyedrop-tips.php), así como con el uso de vídeos como el producido por la Glaucoma Research Foundation (www.glaucoma.org/treatment/putting-in-eye-drops.php).
Si el paciente tiene una dificultad significativa para instilar las gotas oculares, una ayuda mecánica para la dosificación puede mejorar la probabilidad de éxito. La adherencia al programa de dosificación correcto mejora con el uso de recordatorios automatizados basados en la telecomunicación, aplicaciones de recordatorio basadas en teléfonos inteligentes y tabletas.44,45 Se debe adoptar una combinación de educación en el consultorio, establecimiento de objetivos, régimen de gotas simplificado y tecnología para mejorar la adherencia.46 Abordar las barreras conocidas para la adherencia a la medicación es un primer paso necesario hacia el éxito.
Bajar la presión
La PIO es el único factor de riesgo glaucomatoso modificable que se conoce y su disminución ha demostrado indiscutiblemente que reduce el riesgo de progresión de la enfermedad.47,48 Bajar la PIO de forma eficaz se convierte, por tanto, en el objetivo del tratamiento de los pacientes con glaucoma. Una vez clasificada la enfermedad con precisión, se suele establecer un objetivo terapéutico. Los patrones de práctica preferidos en los Estados Unidos sugieren el uso de un rango de PIO objetivo que el clínico considere que reducirá prospectivamente el riesgo de ceguera de los pacientes a lo largo de su vida, minimizando al mismo tiempo la carga relacionada con el tratamiento.49-52
Aunque hay múltiples metodologías que pueden ayudar a determinar una PIO objetivo inicial (PIO umbral, calculada, de talla única), el método más sencillo y basado en la evidencia es reducir la PIO en un porcentaje a partir de la PIO diurna máxima basal en la que se está produciendo el daño al nervio óptico. La PIO es dinámica y presenta fluctuaciones a corto y largo plazo, lo que hace que la tonometría disponible actualmente no sea perfectamente reproducible. Por lo tanto, se recomienda que el clínico obtenga múltiples lecturas de la PIO en diferentes momentos del día antes de iniciar el tratamiento para intentar establecer un pico de PIO diurno en el que basar el rango objetivo.53-55 Sin embargo, si no se obtienen múltiples curvas de PIO de 24 horas, es poco probable que se llegue a captar un verdadero pico. En última instancia, el clínico deberá evaluar el éxito del tratamiento mediante la reducción de la tasa de progresión en las pruebas estructurales y funcionales.48,56,57
Las reducciones porcentuales de la PIO recomendadas oscilan entre el 20% y el 50%, dependiendo de la afección (es decir glaucoma, hipertensión ocular, glaucoma de tensión normal, glaucoma de alta tensión, glaucoma de ángulo cerrado), la gravedad de la enfermedad y la esperanza de vida.58-61
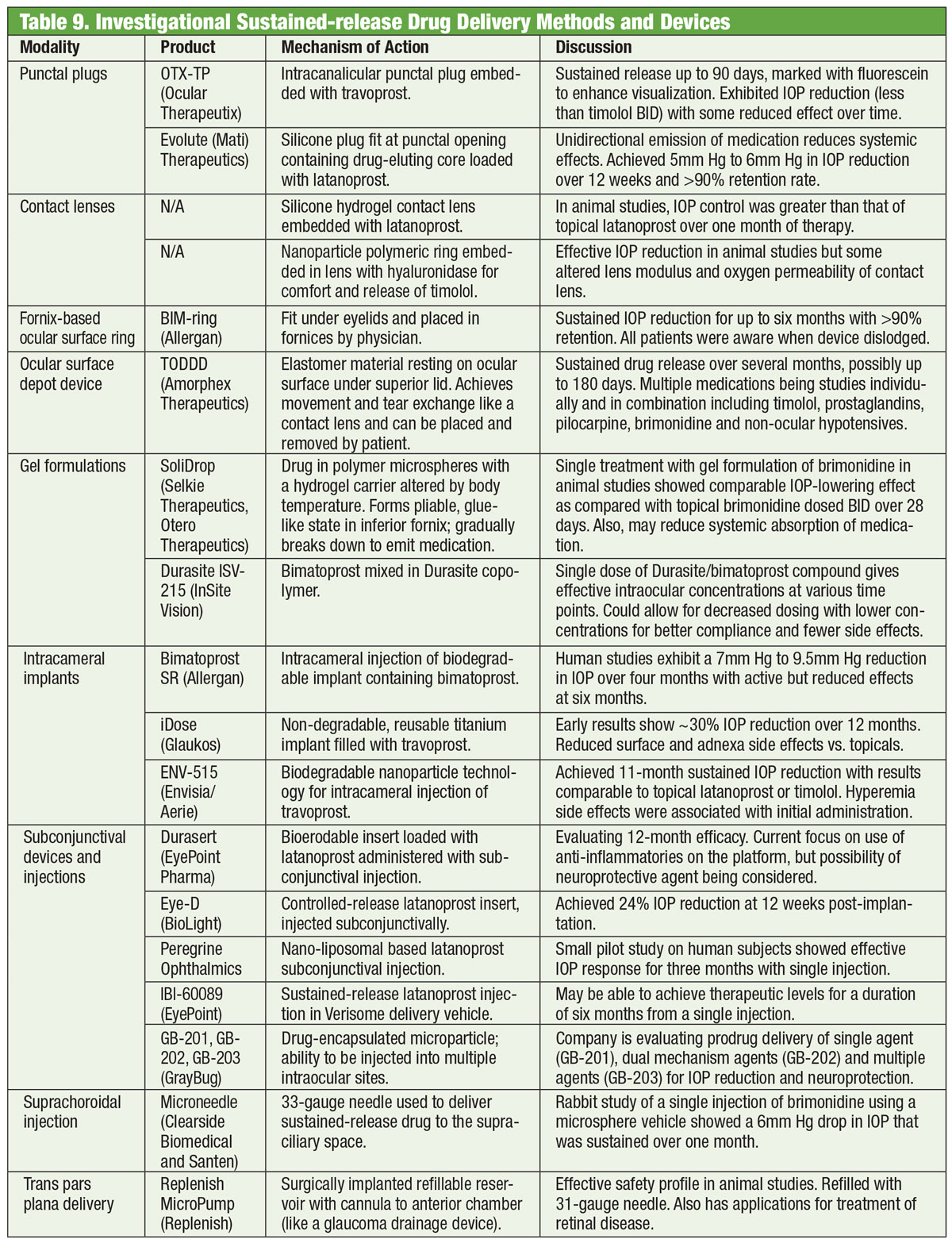
Tabla: Bruce Onofrey, OD, RPh. Haga clic en la imagen para ampliarla.
Cómo empezar
Los AGP están aprobados para el tratamiento de primera línea en Estados Unidos y son más eficaces para reducir la PIO, tienen un perfil de efectos secundarios relativamente limitado y se dosifican con menos frecuencia (una vez al día) que otras clases de medicamentos.62,63
Una vez seleccionado un agente específico, se debe volver a ver al paciente en un plazo no superior a cuatro semanas para calibrar la eficacia de la bajada, para prevenir cualquier acontecimiento adverso que pueda surgir, asegurar la adherencia del paciente y reforzar el valor del tratamiento.
En definitiva, una educación adecuada y un seguimiento vigilante con pruebas estructurales y funcionales ayudarán a minimizar la pérdida de visión.
El Dr. Dorkowski es el coordinador clínico del programa de residencias de ancianos/vida asistida de la SCO.
El Dr. Williamson es el supervisor de la residencia en el Memphis VA Medical Center.
El Dr. Rixon es adjunto en el VA de Memphis y es miembro de la Sociedad de Glaucoma Optométrico.
El Dr. Onofrey es autor de The Ocular Therapeutics Handbook.
1. Zimmerman TJ, William P. BogerIII. Los agentes bloqueantes beta-adrenérgicos y el tratamiento del glaucoma. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. A history of glaucoma pharmacology. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Efectos directos de los agentes muscarínicos sobre las vías de salida en los ojos humanos. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. The dose response of human intraocular pressure to pilocarpine. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. The mechanism of action of adrenergic drugs in glaucoma. Investig Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalyl epinephrine: a new pro-drug in the treatment of glaucoma. Ophthalmology. 1978;85(3):268-75.
7. Neufeld AH. Estudios experimentales sobre el mecanismo de acción del timolol. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. The mechanism of timolol in lowering intraocular pressure: In the normal eye. Arch Ophthalmol. 1978;96(11):2045-8.
9. Trope GE, Clark B. Beta adrenergic receptors in pigmented ciliary processes. Br J Ophthalmol. 1982;66:788-92.
10. Wax MB, Molinoff PB. Distribution and properties of beta-adrenergic receptors in human iris-ciliary body. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Walker AM, Epstein DL. Una comparación doblemente enmascarada de betaxolol frente a timolol en el tratamiento del glaucoma de ángulo abierto. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Betabloqueantes oftálmicos desde el timolol. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. Evaluación del timolol en el glaucoma crónico de ángulo abierto: Una vez al día vs dos veces al día. Arch Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. Effects of timolol, epinephrine, and acetazolamide on aqueous flow during sleep. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. Circadian intraocular pressure variation with beta-blockers. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. Efectos del tratamiento sistémico con betabloqueantes sobre la eficacia y seguridad de la brimonidina y el timolol tópicos. Grupos de estudio de brimonidina 1 y 2. Ophthalmology. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaucoma y enfermedades sistémicas. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. Pharmacological and ocular hypotensive properties of topical carbonic anhydrase inhibitors. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Topical drug delivery to the eye: dorzolamide. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamida en suspensión oftálmica: revisión de su farmacología y uso en el tratamiento del glaucoma de ángulo abierto y la hipertensión ocular. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. Comparación del efecto aditivo de reducción de la presión intraocular de latanoprost y dorzolamida cuando se añade a timolol en pacientes con glaucoma de ángulo abierto o hipertensión ocular: un estudio aleatorizado, abierto y multicéntrico en Grecia. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. Incidencia de la alergia a la brimonidina en pacientes previamente alérgicos a la apraclonidina. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. Effectiveness and safety of brimonidine as adjunctive therapy for patients with elevated intraocular pressure in a large, open-label community trial. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidine-purite 0.1% versus brimonidine-purite 0.15% dos veces al día en glaucoma o hipertensión ocular: un ensayo aleatorio de 12 meses. Curr Med Res Opin. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Brimonidine induced anterior uveitis. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Kaufman PL. Actualización del mecanismo de acción de las prostaglandinas tópicas para la reducción de la presión intraocular. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. Eficacia del latanoprosteno bunod 0,024% comparado con el timolol 0,5% en la disminución de la presión intraocular durante 24 horas. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprosteno bunod solución oftálmica al 0,024% para la disminución de la PIO en glaucoma e hipertensión ocular. Expert Opin Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. Comparación de latanoprosteno bunod 0,024% y timolol maleato 0,5% en glaucoma de ángulo abierto o hipertensión ocular: El estudio LUNAR. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. La malla trabecular: Una revisión básica de la forma y la función. J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-2838-02-0017. Consultado el 29 de junio de 2018.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. Descubrimiento del inhibidor de ROCK netarsudil para el tratamiento del glaucoma de ángulo abierto. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. Dos ensayos clínicos de fase 3 que comparan la seguridad y la eficacia de netarsudil con timolol en pacientes con presión intraocular elevada: rho kinase elevated iop treatment trial 1 and 2 (ROCKET-1 and ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. Descubrimiento y desarrollo preclínico de netarsudil, un nuevo agente hipotensor ocular para el tratamiento del glaucoma. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Wang Y, et al. La administración tópica de un inhibidor de roca/red promueve la supervivencia de las células ganglionares de la retina y la regeneración de los axones después de una lesión del nervio óptico. Exp Eye Res. 2017;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Patrones de terapia adyuvante en pacientes con glaucoma utilizando análogos de prostaglandina. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Combinaciones fijas. Glaucoma Today. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Scudeller L, et al. ¿Se correlacionan las tasas de adherencia y la progresión del campo visual glaucomatoso? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Using pharmacy claims data to study adherence to glaucoma medications: methodology and findings of the Glaucoma Adherence and Persistency Study (GAPS). Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Stamper R, et al. Effectiveness of intraocular pressure-lowering medication determined by washout. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. ¿Por qué la gente (todavía) se queda ciega de glaucoma? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. Una visión del glaucoma: ¿lo estamos viendo claramente? Eye. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. Las barreras más comunes para la adherencia a la medicación del glaucoma: Una encuesta transversal. Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Instilación de gotas y glaucoma. Curr Opin Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Recordatorios automatizados basados en la telecomunicación y adherencia con la dosificación de medicamentos para el glaucoma una vez al día: The automated dosing reminder study. JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. The Wills eye glaucoma app: Interés de los pacientes y sus cuidadores en una aplicación de glaucoma basada en un smartphone y en una tableta. J Glaucoma. 2016;25(9):e787-e791.
46. Joseph A, Pasquale LR. Atributos asociados con la adherencia a la terapia médica del glaucoma y sus efectos en los resultados del glaucoma: Una revisión basada en la evidencia y posibles estrategias para mejorar la adherencia. Semin Ophthalmol. 2017;32(1):86-90.
47. Clement CI, Bhartiya S, Shaarawy T. New perspectives on target intraocular pressure. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Personalización de la presión intraocular: Presión intraocular objetivo en el entorno de la monitorización de la presión intraocular de 24 horas. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. Presión objetivo en la terapia del glaucoma. J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. Cuidado del paciente con glaucoma de ángulo abierto. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Reducción temprana y agresiva de la presión intraocular, presión intraocular objetivo y un concepto novedoso para el cuidado del glaucoma. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr. BE, Rosenberg LF, Gedde SJ, et al. Primary open-angle glaucoma Preferred Practice Pattern guidelines. Ophthalmology. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. Los patrones de presión intraocular diurna no son repetibles a corto plazo en individuos sanos. Ophthalmology. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhDemail, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. Long-term reproducibility of diurnal intraocular pressure patterns in patients with glaucoma. Ophthalmology. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Variabilidad diaria de la presión intraocular en el glaucoma y la hipertensión ocular. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Utilidad clínica de la monitorización de la presión intraocular fuera del horario normal de consulta en pacientes con glaucoma. Arch Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Peak intraocular pressure and glaucomatous progression in primary open-angle glaucoma. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Reducción de la presión intraocular y progresión del glaucoma: Resultados del ensayo de glaucoma manifiesto temprano. Arch Ophthalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. El estudio de intervención en glaucoma avanzado (AGIS): La relación entre el control de la presión intraocular y el deterioro del campo visual. Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Progresión del campo visual en el estudio colaborativo de tratamiento inicial del glaucoma. El impacto del tratamiento y otros factores de referencia. Ophthalmology. 2009;116(2):200-207.e1.
62. Albert A. Latanoprost en el tratamiento del glaucoma. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. Impacto de la introducción del latanoprost genérico en la adherencia a la medicación del glaucoma. Ophthalmology. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. Una comparación aleatoria y controlada de latanoprosteno bunod y latanoprost 0,005% en el tratamiento de la hipertensión ocular y el glaucoma de ángulo abierto: El estudio VOYAGER. Br J Ophthalmol. 2015;99(6):738-45.