El cáncer es el resultado de la ruptura de los controles que regulan las células. Las causas de la ruptura siempre incluyen cambios en genes importantes. Estos cambios suelen ser el resultado de mutaciones, cambios en la secuencia de ADN de los cromosomas. Las mutaciones pueden ser cambios muy pequeños, que afectan sólo a unos pocos nucleótidos, o pueden ser muy grandes, dando lugar a cambios importantes en la estructura de los cromosomas.
Tanto las mutaciones pequeñas como las grandes pueden afectar al comportamiento de las células. Las combinaciones de mutaciones en genes importantes pueden conducir al desarrollo del cáncer. El material tratado en esta página describe la relación entre la mutación y el cáncer, los diferentes tipos de mutaciones y sus causas. También se puede encontrar más información sobre los temas de esta página en la mayoría de los libros de texto de introducción a la Biología, recomendamos Campbell Biology, 11ª edición.1
Temas de esta página:
- Mutación y cáncer
- Mutaciones heredadas y cáncer
- Tipos de mutación
- Mutaciones puntuales
- Translocaciones
- Amplificación de genes
- Inversiones, deleciones y duplicaciones
- Aneuploidía
- Cambios epigenéticos
- Causas de la mutación
- Resumen de la mutación
- Conocer el flujo: Mutación
Mutación y cáncer
Los comportamientos anormales que demuestran las células cancerosas son el resultado de una serie de mutaciones en genes reguladores clave. Las células se vuelven progresivamente más anormales a medida que se dañan más genes. A menudo, los genes que controlan la reparación del ADN se dañan a su vez, lo que hace que las células sean aún más susceptibles a niveles cada vez mayores de caos genético.
A continuación se muestra una animación que demuestra la relación entre los cromosomas, los genes y el ADN.
Se cree que la mayoría de los cánceres surgen de una única célula precursora mutante. A medida que esa célula se divide, las células «hijas» resultantes pueden adquirir diferentes mutaciones y comportamientos diferentes durante un período de tiempo. Aquellas células que adquieran una ventaja en la división o en la resistencia a la muerte celular tenderán a apoderarse de la población. De este modo, las células tumorales son capaces de adquirir una amplia gama de capacidades que normalmente no se ven en la versión sana del tipo celular representado. Los cambios de comportamiento observados en las células cancerosas son el tema central de la sección de Biología del Cáncer del sitio.
Las mutaciones en los genes reguladores clave (supresores de tumores y protooncogenes) alteran el comportamiento de las células y pueden conducir potencialmente al crecimiento desordenado que se observa en el cáncer.
Para casi todos los tipos de cáncer estudiados hasta la fecha, parece que la transición de una célula normal y sana a una célula cancerosa es una progresión por etapas que requiere muchos cambios genéticos que se suman para crear la célula cancerosa. Estas mutaciones se producen tanto en oncogenes como en supresores tumorales. Esta es una de las razones por las que el cáncer es mucho más frecuente en las personas mayores. Para generar una célula cancerosa, deben producirse una serie de mutaciones en la misma célula. Dado que la probabilidad de que cualquier gen mute es muy baja, es lógico que la posibilidad de que se produzcan varias mutaciones diferentes en la misma célula sea realmente muy improbable. Por esta razón, las células de un cuerpo de 70 años han tenido más tiempo para acumular los cambios necesarios para formar células cancerosas, pero las de un niño tienen muchas menos probabilidades de haber adquirido los cambios genéticos necesarios. Por supuesto, algunos niños padecen cáncer, pero es mucho más común en individuos de mayor edad. El siguiente gráfico muestra las tasas de cáncer de colon en Estados Unidos en función de la edad. El gráfico se obtuvo del Instituto Nacional del Cáncer. 2
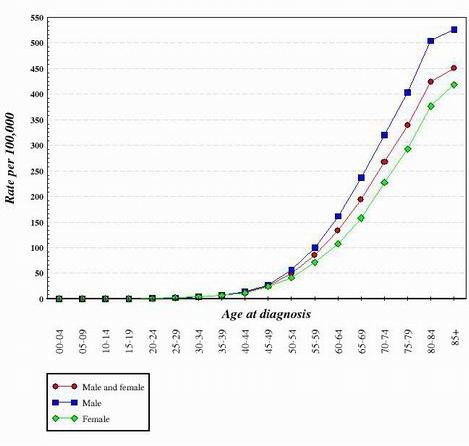
Al observar la forma de curvas como las mostradas anteriormente, se ha llegado a la conclusión de que se requieren varios cambios genéticos para crear células que se vuelvan cancerosas.
En el laboratorio, los investigadores han intentado crear células tumorales alterando o introduciendo proteínas reguladoras clave. Varios estudios han intentado definir el número mínimo de cambios genéticos necesarios para crear una célula cancerosa, con resultados intrigantes.3
En la naturaleza, las mutaciones pueden acumularse en las células a lo largo del tiempo y, si se muta el grupo «adecuado» de genes, puede producirse el cáncer. Un estudio de 2012 demostró que las células madre de la médula ósea de un individuo sano acumulan muchas mutaciones a medida que la persona envejece. Sólo unos pocos cambios más en los genes clave pueden causar cáncer. Los resultados implican que las células «normales» y las cancerosas pueden no ser tan diferentes en muchos casos.4
Mutaciones heredadas en el cáncer
Para complicar las cosas, está claro que los cambios necesarios para crear una célula cancerosa pueden lograrse de muchas maneras diferentes. Aunque todos los cánceres tienen que superar el mismo espectro de funciones reguladoras para crecer y progresar, los genes implicados pueden diferir. Además, el orden en que los genes se desregulan o se pierden también puede variar. Como ejemplo, los tumores de cáncer de colon de dos individuos diferentes pueden implicar conjuntos muy diferentes de supresores tumorales y oncogenes, aunque el resultado (cáncer) sea el mismo.
La gran heterogeneidad observada en el cáncer, incluso en los del mismo órgano, hace que el diagnóstico y el tratamiento sean complicados. Los avances actuales en la clasificación molecular de los tumores deberían permitir el diseño racional de protocolos de tratamiento basados en los genes realmente implicados en cada caso. Las nuevas pruebas de diagnóstico pueden implicar el cribado de cientos o miles de genes para crear un perfil personalizado del tumor en un individuo. Esta información debería permitir adaptar los tratamientos contra el cáncer a cada persona. Para obtener más información al respecto, consulte la sección Genómica/Proteómica.
Los cambios genéticos que conducen a un crecimiento celular no regulado pueden adquirirse de dos maneras diferentes. Es posible que la mutación se produzca gradualmente a lo largo de varios años, dando lugar al desarrollo de un caso «esporádico» de cáncer. Por otro lado, es posible heredar genes disfuncionales que conduzcan al desarrollo de una forma familiar de un determinado tipo de cáncer. Algunos ejemplos de cánceres con componentes hereditarios conocidos son:
- Cáncer de mama – La herencia de versiones mutantes de los genes BRCA1 y BRCA2 son factores de riesgo conocidos. Aunque muchos, si no la mayoría, de los individuos con cáncer de mama no tienen alteraciones detectables en estos genes, tener una forma mutante aumenta la probabilidad de desarrollar cáncer de mama.
- Cáncer de colon- Se sabe que los defectos en los genes de reparación del ADN, como el MSH2, predisponen a los individuos a padecer cáncer colorrectal hereditario sin poliposis (HNPCC).
- Retinoblastoma- Se sabe que los defectos en el gen supresor de tumores Rb causan este cáncer ocular y varios otros tipos de cáncer. Se puede encontrar más información sobre esta enfermedad en particular en la sección sobre Rb
Esta es una lista incompleta de los tipos de cáncer hereditarios conocidos, y es seguro que se identificarán más formas hereditarias de cáncer a medida que se aclare la genética de varios tipos de cáncer.
Puede encontrarse más información sobre este tema en los capítulos 2 y 4 de The Biology of Cancer, de Robert A. Weinberg.
Tipos de mutación
El proceso por el que se fabrican las proteínas, la traducción, se basa en la «lectura» del ARNm que se produjo mediante el proceso de transcripción. Cualquier cambio en el ADN que codifica un gen conducirá a una alteración del ARNm producido. A su vez, el ARNm alterado puede conducir a la producción de una proteína que ya no funciona correctamente. Incluso el cambio de un solo nucleótido a lo largo del ADN de un gen puede conducir a una proteína completamente no funcional.
Hay varias formas diferentes en las que se puede alterar el ADN. La siguiente sección describe los diferentes tipos de cambios genéticos con más detalle.
Mutaciones puntuales
Las alteraciones genéticas pueden clasificarse en dos categorías generales. La primera categoría comprende los cambios que alteran sólo uno o unos pocos nucleótidos a lo largo de una cadena de ADN. Este tipo de cambios se denominan mutaciones puntuales.
Cuando los ribosomas leen una molécula de ARN mensajero, cada tres nucleótidos se interpretan como un aminoácido. Estos códigos de tres letras se llaman codones. Para hacer una analogía con una frase en inglés: «The fat cat ate the rat» contendría 6 codones. Los cambios causados por la mutación pueden dar lugar a cosas como ‘El murciélago gordo se comió a la rata’ o ‘El fa’ o ‘El gordo oca tat her at…’ El impacto en la proteína depende de dónde se produzca el cambio y del tipo de cambio.
Los codones de tres letras leídos por los ribosomas pueden ser cambiados por mutación de una de estas tres maneras:
Mutaciones sin sentido
El nuevo codón hace que la proteína termine prematuramente, produciendo una proteína acortada y que a menudo no funciona correctamente o no funciona en absoluto.
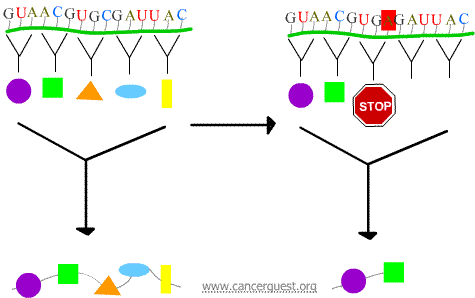
Mutaciones sin sentido
El nuevo codón hace que se inserte un aminoácido incorrecto en la proteína. Los efectos sobre la función de la proteína dependen de lo que se inserte en lugar del aminoácido normal.

Mutaciones de cambio de marco
La pérdida o ganancia de 1 o 2 nucleótidos hace que el codón afectado y todos los codones que le siguen sean mal leídos. Esto conduce a un producto proteico muy diferente y a menudo no funcional.
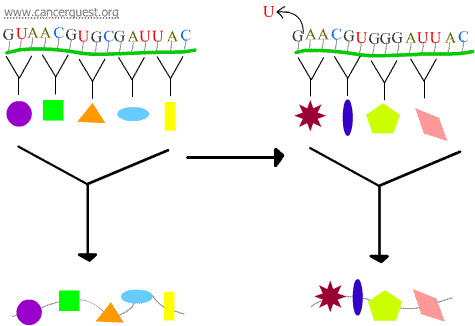
Errores de transcripción
Algunos daños en el ADN dan lugar a un nucleótido modificado o a un pequeño grupo de nucleótidos que no pueden ser «leídos» por la ARN polimerasa. Cuando el complejo de la ARN polimerasa llega a estos puntos, a veces se salta el daño añadiendo nucleótidos en un esfuerzo por seguir adelante, aunque signifique poner lo incorrecto. Este proceso se conoce como mutagénesis transcripcional y puede desempeñar un papel importante en el desarrollo del cáncer.5
Translocaciones
Otra categoría de mutaciones implica alteraciones de cantidades mayores de ADN, a menudo a nivel del cromosoma. Se denominan translocaciones e implican la rotura y el movimiento de fragmentos cromosómicos. A menudo, las roturas en dos cromosomas diferentes permiten la formación de dos cromosomas «nuevos», con nuevas combinaciones de genes.
Aunque podría parecer que esto no causaría muchos problemas, ya que todos los genes siguen estando presentes, el proceso puede conducir a un crecimiento celular desregulado de varias maneras
1. Los genes pueden no transcribirse y traducirse adecuadamente en su nueva ubicación.
2. El movimiento de un gen puede conducir a un aumento o a una disminución de su nivel de transcripción.
3. La rotura y reagrupación también puede producirse dentro de un gen (como se muestra en verde arriba), lo que conduce a su inactivación.
Para algunos tipos de cáncer, las translocaciones particulares son muy comunes y pueden incluso utilizarse en el diagnóstico de la enfermedad. Las translocaciones son comunes en las leucemias y los linfomas y se han identificado con menos frecuencia en los cánceres de tejidos sólidos. Un ejemplo sería el intercambio entre los cromosomas 9 y 22 que se observa en más del 90% de los pacientes con leucemia mielógena crónica (LMC). El intercambio conduce a la formación de una forma acortada del cromosoma 22 denominada cromosoma Filadelfia (por el lugar donde se descubrió). Esta translocación conduce a la formación de un oncogén a partir del protooncogén abl.67
Otros cánceres que se asocian a menudo (o siempre) con translocaciones particulares son el linfoma de Burkitt, los linfomas de células B y varios tipos de leucemia.
Amplificación de genes
En este proceso tan inusual, el proceso normal de replicación del ADN se ve gravemente afectado. El resultado es que en lugar de hacer una sola copia de una región de un cromosoma, se producen muchas copias. Esto lleva a la producción de muchas copias de los genes que se encuentran en esa región del cromosoma. A veces, se producen tantas copias de la región amplificada que pueden llegar a formar sus propios pseudocromosomas pequeños llamados cromosomas de doble minuto.
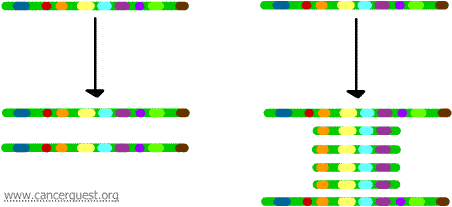
Los genes de cada una de las copias pueden transcribirse y traducirse, lo que lleva a una sobreproducción del ARNm y de la proteína correspondiente a los genes amplificados, como se muestra a continuación. Las líneas garabateadas representan el ARNm que se produce a través de la transcripción de cada copia del gen.
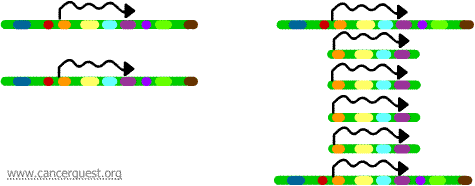
Aunque este proceso no se observa en las células normales, ocurre con bastante frecuencia en las células cancerosas. Si se incluye un oncogén en la región amplificada, la sobreexpresión resultante de ese gen puede conducir a un crecimiento celular desregulado. Ejemplos de ello son la amplificación del oncogén myc en una amplia gama de tumores y la amplificación del oncogén ErbB-2 o HER-2/neu en los cánceres de mama y ovario. En el caso del oncogén HER-2/neu, los tratamientos clínicos se han diseñado para dirigirse a las células que sobreexpresan el producto proteico.
La amplificación del gen también contribuye a uno de los mayores problemas en el tratamiento del cáncer: la resistencia a los fármacos. Los tumores resistentes a los fármacos pueden seguir creciendo y extendiéndose incluso en presencia de fármacos de quimioterapia. Un gen comúnmente implicado es el llamado MDR, por sus siglas en inglés de resistencia a múltiples fármacos. El producto proteico de este gen actúa como una bomba situada en la membrana de las células. Es capaz de expulsar selectivamente las moléculas de la célula, incluidos los fármacos de quimioterapia. Esta expulsión hace que los fármacos sean ineficaces.
Esto se trata con más detalle en la sección de Resistencia a los medicamentos. La amplificación de diferentes genes puede hacer que otros fármacos de quimioterapia sean ineficaces.
Inversiones, duplicaciones y deleciones
Inversiones
En estas alteraciones, se liberan segmentos de ADN de un cromosoma y se vuelven a insertar en la orientación opuesta. Como en los ejemplos anteriores, esta reordenación puede dar lugar a una expresión génica anormal, ya sea por la activación de un oncogén o por la desactivación de un gen supresor de tumores.
Duplicaciones/Deleciones
A través de errores de replicación, un gen o grupo de genes puede copiarse más de una vez dentro de un cromosoma. Esto se diferencia de la amplificación de genes en que los genes no se replican fuera del cromosoma y sólo se copian una vez más, no cientos o miles de veces. Los genes también pueden perderse debido a un fallo en el proceso de replicación o a otros daños genéticos.

Aneuploidía
La neuploidía es el cambio genético que implica la pérdida o ganancia de cromosomas enteros. Debido a problemas en el proceso de división celular, los cromosomas replicados pueden no separarse en las células hijas con precisión. Esto puede dar lugar a células que tienen demasiados cromosomas o muy pocos. Un ejemplo de una condición aneuploide bastante común que no está relacionada con el cáncer es el síndrome de Down, en el que hay una copia extra del cromosoma 21 en todas las células del individuo afectado.
En la animación de abajo, se hacen copias de dos cromosomas pero cuando la célula se divide los cromosomas no se distribuyen uniformemente a las dos células que se forman (células hijas). El resultado es que una de las células tiene demasiados cromosomas y otra no tiene los suficientes.
Las células cancerosas son muy a menudo aneuploides. Los seres humanos tienen normalmente 46 cromosomas en sus células, pero las células cancerosas suelen tener muchos más, a veces más de 100. La presencia de los cromosomas adicionales hace que las células sean inestables y altera gravemente los controles de la división celular. Actualmente se debate si todos los cánceres son aneuploides o no. Independientemente de que sea así, está claro que la aneuploidía es una característica común de las células cancerosas.
Cambios epigenéticos
Además de las alteraciones reales en la secuencia del ADN, la expresión de los genes puede verse alterada por cambios en el ADN y la cromatina que no modifican la secuencia. Dado que estos cambios no alteran la secuencia del ADN en los genes, se denominan cambios epigenéticos. A continuación se describen dos tipos de cambios epigenéticos.
Metilación
En esta alteración, algunos nucleótidos del ADN se modifican mediante la adición de un grupo metilo (-CH3) a la base. La metilación del ADN se asocia a la inactivación de esa región concreta del ADN. Se han observado patrones anormales de metilación del ADN en las células cancerosas. Al igual que los cambios descritos, la metilación altera la expresión de los genes afectados.
Acetilación
En este cambio epigenético, las proteínas histonas alrededor de las cuales se enrolla el ADN se modifican por la adición de grupos acetilo (-CH3CHO). Esta alteración conduce a un aflojamiento de la interacción ADN:histona y se asocia a un aumento de la expresión génica. La modificación de los procesos de adición y eliminación de grupos acetilo al ADN es un área activa de investigación en el tratamiento del cáncer.
Más información sobre los cambios epigenéticos y los tratamientos del cáncer.
Causas de la mutación
Como hemos visto, las células cancerosas se crean a partir de células precursoras normales mediante una acumulación de daños genéticos. Los mecanismos por los que se inducen los cambios son variados. En un sentido amplio, los agentes de cambio genético (mutación) se encuadran principalmente en las categorías que se describen a continuación y que se analizan en profundidad en la siguiente sección.
Mutaciones espontáneas
Mutaciones espontáneas: Las bases (A, T, G, C) del ADN se alteran o se pierden debido a errores de replicación no reparados o a acontecimientos moleculares aleatorios. Por ejemplo, la pérdida de un grupo amino de la citosina, una base normal que se encuentra en el ADN, conduce a la producción de uracilo, una base que no se encuentra normalmente en el ADN. Si este cambio no se detecta e invierte, puede producirse una mutación. En ocasiones, puede perderse una base entera como resultado de la ruptura del enlace entre la columna vertebral del ADN y la base. Esto da lugar a una brecha en la doble hélice del ADN que, si no se repara, puede dar lugar a una mutación la próxima vez que se copie el ADN (es decir, durante la replicación).
Mutaciones inducidas
Mutaciones inducidas: Las mutaciones pueden ser inducidas al exponer a los organismos (o a las células) a una variedad de tratamientos. Algunos de los más comunes son:
Radiación- Uno de los primeros mutágenos conocidos, la radiación es un potente inductor de mutaciones. Diferentes tipos de radiación causan diferentes tipos de cambios genéticos. La radiación ultravioleta (UV) provoca mutaciones puntuales. Los rayos X pueden causar roturas en la doble hélice del ADN y provocar translocaciones, inversiones y otros tipos de daños cromosómicos. La exposición a los rayos UV de la luz solar se ha relacionado con el cáncer de piel. Hay que tener en cuenta que las propiedades dañinas para el ADN de la radiación se han utilizado en diferentes tratamientos contra el cáncer basados en la radiación.
A continuación se muestra un tipo de mutación que es causada por la radiación ultravioleta. En este ejemplo, el bombardeo de la doble hélice del ADN por los rayos UV hace que dos bases se unan. Esto altera la estructura del ADN y puede provocar cambios permanentes si no se repara.
Otro tipo de radiación es la energía emitida por elementos radiactivos de origen natural (como el radón y el uranio) o por fuentes artificiales como las que se encuentran (y crean) en los reactores nucleares. Las radiaciones de este tipo vienen en diferentes tipos y pueden causar diferentes tipos de daños a las células y tejidos. La radiación puede dañar directamente el ADN o puede provocar la formación de sustancias químicas (es decir, especies reactivas de oxígeno o ROS) que luego pueden dañar el ADN u otros componentes celulares.
La exposición a la radiación procedente de materiales radiactivos está bien documentada. Los análisis de los supervivientes de las bombas atómicas lanzadas sobre Japón durante la Segunda Guerra Mundial mostraron grandes aumentos de leucemias poco después de la exposición y luego aumentos de otros tipos de cáncer durante las décadas siguientes.8
También se han liberado accidentalmente cantidades peligrosas de materiales radiactivos desde las centrales nucleares. La exposición a la radiación debida a la liberación accidental de materiales radiactivos del reactor nuclear de Chernóbil se ha asociado a un aumento del cáncer de tiroides y de otros tipos de cáncer maligno.9
Las máquinas de imagen médica (como las máquinas de rayos X y los escáneres de TC) también exponen a los pacientes a la radiación. Se cree que las cantidades utilizadas para una sola prueba no causan cantidades significativas de cáncer, pero el impacto a largo plazo de muchas pruebas durante un período de años no está claro.10 Asimismo, se cree que la exposición de los pasajeros de los aviones a los escáneres de cuerpo entero en los aeropuertos no supone un riesgo de cáncer.11 Los pasajeros que vuelan en aviones también están expuestos a la radiación del espacio, pero a un nivel bajo y no se cree que suponga un riesgo de cáncer, ni siquiera para los miembros de la tripulación de vuelo.1112
Mutágenos químicos- Se sabe que muchas sustancias químicas diferentes causan mutaciones. Estas sustancias químicas ejercen su efecto uniéndose al ADN o a los bloques de construcción del ADN e interfiriendo en los procesos de replicación o transcripción. Algunos ejemplos de potentes mutágenos son el benzo-a-pireno, una sustancia química que se encuentra en el humo de los cigarrillos, y la aflatoxina, un mutágeno que se encuentra con mayor frecuencia en productos agrícolas almacenados de forma inadecuada.
Inflamación crónica- La inflamación crónica puede provocar daños en el ADN debido a la producción de sustancias químicas mutagénicas por parte de las células del sistema inmunitario. Un ejemplo sería la inflamación a largo plazo causada por la infección del virus de la hepatitis. Más información sobre los virus y el cáncer.
Radicales de oxígeno- Durante la captación de energía de los alimentos, que se produce en nuestras mitocondrias, se pueden generar sustancias químicas muy reactivas capaces de dañar las membranas celulares y el propio ADN. Estos intermediarios reactivos del oxígeno (ROI) también pueden ser generados por la exposición de las células a la radiación, como se muestra a continuación.
La actividad mutagénica de la ROI está asociada al desarrollo del cáncer, así como a las actividades de varios tratamientos anticancerígenos, incluyendo la radiación y la quimioterapia. 131415
División celular anormal
Durante la mitosis, es posible que el proceso de división celular falle al dividir los cromosomas replicados con precisión en dos células hijas. Un error de este tipo conducirá a la producción de células aneuploides. Las células carecerán o habrán ganado un número significativo de genes. Este raro proceso puede crear células más propensas a la división celular desordenada. Como se ha dicho anteriormente, un gran porcentaje de los cánceres aislados en humanos son aneuploides.
Si una célula tiene una mutación en un gen cuyo producto proteico es responsable de «controlar» el proceso de división, las cosas pueden descontrolarse rápidamente y las células hijas de cada división pueden ser cada vez más anormales.
Los virus como mutágenos
Se cree que los virus son responsables de un porcentaje significativo de casos de cáncer. Los virus pueden causar cáncer de diversas maneras y es probable que la forma en que actúa cada tipo de virus sea ligeramente diferente. Algunos virus (incluidos muchos retrovirus) pueden causar mutaciones insertando sus genes en el genoma de la célula infectada. El ADN insertado puede destruir o alterar la actividad de los genes afectados.161718
Los virus también pueden causar mutaciones de forma indirecta. Por ejemplo: Una infección por el virus de la hepatitis puede durar muchos años. Durante ese tiempo, el sistema de defensa del organismo intenta deshacerse del virus produciendo sustancias químicas tóxicas. Estas sustancias químicas pueden dañar las células «secundarias», por lo demás sanas, enviándolas por el camino que conduce al cáncer. Hay muchas otras formas en las que los virus pueden causar cáncer.1920
Debido a la importancia de los virus en el desarrollo de muchos cánceres, hemos creado una sección dedicada a los virus y el cáncer.
Los transposones como mutágenos
Los transposones son secuencias cortas de ADN que tienen la capacidad de desplazarse de un lugar del ADN a otro. Los transposones codifican una enzima, la transposasa, que actúa para empalmar el transposón en nuevas ubicaciones en un genoma (véase el esquema, abajo a la izquierda, de un transposón) Los transposones fueron descubiertos por Barbara McClintock y ganó un premio Nobel por su trabajo.2122 El genoma humano contiene muchas copias inactivadas de transposones que han perdido su capacidad de moverse o «saltar» a nuevas ubicaciones. Alrededor del 50% del genoma humano está compuesto por transposones «muertos».23
El movimiento de los transposones activos puede dar lugar a mutaciones, alterando la actividad de los genes. Un ejemplo visible del movimiento de transposones (llamado transposición), es la coloración de los granos en el maíz indio (ver abajo a la derecha). Se cree que los transposones que están activos en los seres humanos están implicados en las enfermedades humanas, incluido el cáncer.242526


Resumen de las mutaciones
Cambio genético (mutación) Introducción
- Los comportamientos anormales que demuestran las células cancerosas son el resultado de una serie de mutaciones en genes reguladores clave (es decir, genes de reparación del ADN).
- Se cree que la mayoría de los cánceres surgen de una única célula precursora que adquiere suficientes mutaciones para convertirse en una célula cancerosa.
Mutaciones del ADN
- Los cambios genéticos pueden ser pequeños, afectando sólo a uno o unos pocos nucleótidos (mutaciones puntuales) o pueden ser bastante grandes, alterando la estructura de un cromosoma o cromosomas.
- Mutaciones puntuales
- La traducción es la producción de una proteína mediante enzimas que «leen» tres «palabras» de nucleótidos (codones) a lo largo de un ARN mensajero (ARNm).
- Incluso el cambio de un solo nucleótido a lo largo del ADN de un gen puede dar lugar a una proteína completamente no funcional. Las mutaciones se agrupan según los cambios que crean en el producto proteico resultante del gen afectado.
- Mutaciones sin sentido – El nuevo codón (mutante) hace que la síntesis de la proteína se detenga prematuramente.
- Mutaciones sin sentido – El codón alterado da lugar a la inserción de un aminoácido incorrecto en la proteína.
- Mutaciones de cambio de marco – La pérdida o ganancia de 1 o 2 nucleótidos en un ARNm hace que los codones se lean mal. Con frecuencia da lugar a proteínas acortadas y no funcionales.
- Cambios a nivel cromosómico
- Translocaciones – Rotura y (a veces) intercambio de fragmentos cromosómicos.
- Amplificación de genes – La replicación anormal crea múltiples copias de una región de un cromosoma. En última instancia, esto conduce a la sobreproducción de las proteínas correspondientes.
- Inversiones – Los segmentos de ADN se liberan de un cromosoma y luego se vuelven a insertar en la orientación opuesta.
- Duplicaciones/Deleciones – Un gen o grupo de genes puede perderse por completo o copiarse más de una vez dentro de un cromosoma.
- Aneuploidía – Cambio genético que implica la pérdida o ganancia de cromosomas enteros.
- Las mutaciones espontáneas pueden producirse debido a un ADN no reparado o a eventos moleculares aleatorios.
- La neuploidía es muy común en las células cancerosas.
Cambios epigenéticos
- La expresión del gen puede ser alterada por cambios en el ADN y la cromatina que no cambian la secuencia genética. Los ejemplos incluyen la metilación del ADN y la acetilación de las histonas.
- Metilación – Algunos nucleótidos del ADN se modifican mediante la adición de un grupo metilo que se asocia con la inactivación de esa región del ADN
- Acetilación – La adición de grupos acetilo afloja el ADN y aumenta la expresión génica.
Mutaciones inducidas
- Las mutaciones pueden ser inducidas por la exposición de organismos (o células) a una variedad de tratamientos:
- Radiación – Los rayos UV causan mutaciones puntuales y los rayos X causan múltiples formas de daño.
- Mutágenos químicos – Pueden unirse al ADN o a los bloques de construcción del ADN e interferir en los procesos de replicación o transcripción.
- Inflamación crónica – Daño en el ADN debido a la producción de sustancias químicas mutagénicas por parte de las células del sistema inmunitario
- Radicales de oxígeno – Resultan de la producción de energía de una célula y pueden dañar el ADN.
Otros cambios genéticos
- La división celular aberrante que da lugar a una división incorrecta de los cromosomas puede conducir a la aneuploidía.
- Los virus pueden causar daños genéticos de varias maneras diferentes y están asociados con una amplia gama de cánceres.
Mutación y cáncer
- Parece que la transición de una célula normal y sana a una célula cancerosa es una progresión gradual.
- El desarrollo del cáncer requiere cambios genéticos en varios oncogenes y supresores tumorales diferentes.
- Todos los cánceres tienen que superar el mismo espectro de funciones reguladoras para crecer y progresar, pero los genes implicados pueden diferir.
- La heterogeneidad del cáncer complica el diagnóstico y el tratamiento.
- Es posible heredar genes disfuncionales que conduzcan al desarrollo de una forma familiar de un tipo de cáncer concreto.
Conoce el flujo: mutación
Conoce el flujo es un juego interactivo para que pongas a prueba tus conocimientos. Para jugar:
- Arrastra las opciones adecuadas de la columna de la derecha y colócalas en orden en las casillas de la izquierda. Tenga en cuenta que sólo utilizará cinco de las seis opciones para completar el juego.
- Cuando termine, haga clic en ‘Comprobar’ para ver cuántas ha acertado.
- Para las respuestas incorrectas, haga clic en ‘Descripción’ para revisar la información sobre los procesos.
- Para volver a intentarlo, elija ‘Reiniciar’ y empiece de nuevo.
-
1
-
2
-
3
-
4
-
5
-
Aprende másUna célula está en proceso de síntesis de ADN
-
Aprende másSe hacen muchas copias de una región de un cromosoma
-
Aprender másTranscripción de genes amplificados
-
Aprender másTraducción de genes amplificados
-
Aprender másLa sobreproducción de una proteína clave ¡proteína conduce al crecimiento de un tumor resistente a los fármacos
-
Aprenda másSe produce la duplicación
Vuelve a jugar
- 1. Urry, L. A., Cain, M. L., Wasserman, S. A., Minorsky, P. V., & Reece, J. B. (2017). Biología Campbell (11ª ed.). Pearson.
- 2. Surveillance, Epidemioloy, and End Results (SEER) representado por National Cancer Institute
- 3. Hahn WC, Counter CM, Lundberg AS, Beijerbergen RL, Brooks MW, Weinberg RA. «Creación de células tumorales humanas con elementos genéticos definidos». Nature 400: 464-468
- 4. Welch JS, Ley TJ, Link DC, Westervelt P, Walter MJ, Graubert TA, DiPersio JF, Ding L, Mardis ER, Wilson RK et al. El origen y la evolución de las mutaciones en la leucemia mieloide aguda. Cell, 20 de julio de 2012
- 5. Brégeon D, Doetsch PW. Mutagénesis transcripcional: causas e implicación en el desarrollo tumoral. Nat Rev Cancer. 2011 Mar;11(3):218-27.
- 6. Nowell PC, Hungerford DA. «Estudios cromosómicos en leucocitos humanos normales y leucémicos». J Natl Cancer Inst (1960). 25: 85-100.
- 7. Rowley JD. «Una nueva anormalidad cromosómica consistente en la leucemia mielógena crónica identificada por fluorescencia de quinacrina y tinción de Giemsa». Nature (1973). 243: 290-293.
- 8. Ozasa K, Shimizu Y, Sakata R, Sugiyama H, Grant EJ, Soda M, Kasagi F, Suyama A. RISK OF CANCER AND NON-CANCER DISEASES IN THE ATOMIC BOMB SURVIVORS. Radiat Prot Dosimetry. 2011 Apr 18.
- 9. Cardis E, Hatch M. The Chernobyl accident–an epidemiological perspective. Clin Oncol (R Coll Radiol). 2011;23(4):251-260. doi:10.1016/j.clon.2011.01.510 Mar 9.
- 10. Fazel R, Krumholz HM, Wang Y, Ross JS, Chen J, Ting HH, Shah ND, Nasir K, Einstein AJ, Nallamothu BK. Exposure to low-dose ionizing radiation from medical imaging procedures. N Engl J Med. 2009 Aug 27;361(9):849-57.
- 11. a. b. Mehta P, Smith-Bindman R. Airport Full-Body Screening: ¿Cuál es el riesgo? Arch Intern Med. 2011 Mar 28.
- 12. Bagshaw M. Cosmic radiation in commercial aviation. Travel Med Infect Dis. 2008 May;6(3):125-7. Epub 2007 Nov 26.
- 13. Kang DH. «Estrés oxidativo, daño del ADN y cáncer de mama». AACN Clin Issues. (2002). 13:540-549
- 14. Athar M. «Oxidative stress and experimental carcinogenesis». Indian J. Exp. Biol. (2002). 40:656-667
- 15. Marnett LJ. «Radicales de oxígeno, peroxidación de lípidos y daño del ADN». (2002)181-182:219-222
- 16. Nair V. Retrovirus-induced oncogenesis and safety of retroviral vectors. Curr Opin Mol Ther. 2008 Oct;10(5):431-8.
- 17. Brady G, Macarthur GJ, Farrell PJ. Epstein-Barr virus and Burkitt lymphoma. Postgrad Med J. 2008 Jul;84(993):372-7.
- 18. Ruprecht K, Mayer J, Sauter M, Roemer K, Mueller-Lantzsch N. Endogenous retroviruses and cancer. Cell Mol Life Sci. 2008 Nov;65(21):3366-82.
- 19. Lupberger J, Hildt E. Hepatitis B virus-induced oncogenesis. World J Gastroenterol. 2007 Jan 7;13(1):74-81.
- 20. Castello G, Scala S, Palmieri G, Curley SA, Izzo F. HCV-related hepatocellular carcinoma: De la inflamación crónica al cáncer. Clin Immunol. 2010 Mar;134(3):237-50. Epub 2009 Nov 11.
- 21. McClintock B. The origin and behavior of mutable loci in maize. Proc Natl Acad Sci U S A. 1950 Jun;36(6):344-55.
- 22. McClintock, Barbara Nobel Prize lecture
- 23. Burns KH, Boeke JD. Tectónica del transposón humano. Cell. 2012 May 11;149(4):740-52.
- 24. Kozeretska IA, Demydov SV, Ostapchenko LI. Elementos genéticos móviles y cáncer. De las mutaciones a la terapia génica. Exp Oncol. 2011 Dec;33(4):198-205.
- 25. Solyom S, Kazazian HH Jr. Elementos móviles en el genoma humano: implicaciones para la enfermedad. Genome Med. 2012 Feb 24;4(2):12.
- 26. Iskow RC, McCabe MT, Mills RE, Torene S, Pittard WS, Neuwald AF, Van Meir EG, Vertino PM, Devine SE. Natural mutagenesis of human genomes by endogenous retrotransposons. Cell. 2010 Jun 25;141(7):1253-61.