US Pharm. 2009;34(2):25-27.
Doença cardiovascular (DCV), a principal causa de morte em todo o mundo, envolve mecanismos que ainda não foram totalmente compreendidos. Enquanto os lipídios plasmáticos são biologicamente necessários para a síntese celular-membrana e produção hormonal e são uma fonte de ácidos graxos livres, a dislipidemia tem sido há muito ligada ao aumento da incidência de DCV, acidente vascular cerebral e doença arterial periférica.1
Estrattificação de risco tradicional
A abordagem atual do tratamento para dislipidemia é especificada no National Cholesterol Education Program Adult Treatment Panel (ATP) III.2 No ATP III, os fatores de risco e a estratificação de risco subseqüente são derivados do cálculo do que é conhecido como Framingham risk score (FRS), que tem sido usado por décadas para prever o risco de DCV. O ATP III fornece recomendações para estratificação de risco de acordo com múltiplos fatores de risco, diabetes e síndrome metabólica. Fatores de risco para doença coronariana (DC) incluem hipertensão (pressão arterial ≥140/90 ou uso de anti-hipertensivo); histórico familiar (parente de primeiro grau com DC ); idade (masculino, ≥45 anos; feminino, ≥55 anos); nível de lipoproteína de alta densidade (HDL) superior a 40 mg/dL; e tabagismo. Um nível de HDL superior a 50 mg/dL é identificado como sendo cardioprotetor e, portanto, é considerado um fator de risco “negativo”. Além de listar fatores de risco específicos de CHD, ATP III identifica os equivalentes de risco de CHD (condições que conferem um risco semelhante para um evento de CHD). Equivalentes de risco para cardiopatias cardiovasculares incluem doença arterial carotídea, aneurisma da aorta abdominal, doença arterial periférica, diabetes mellitus, ou um risco de enfarte do miocárdio (IM) de pelo menos 20% (ou seja, FRS ≥20%).1,2
ATP III especifica lipoproteína de baixa densidade (LDL) como alvo primário para o tratamento do colesterol. Atingir os níveis alvo de triglicérides (TG) e HDL é geralmente considerado um objetivo secundário. As metas de colesterol para a população em geral são dadas na TABELA 1.2
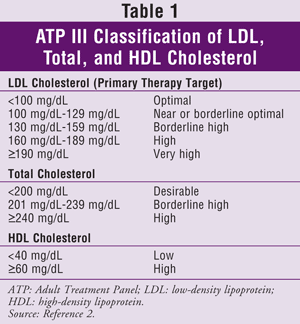
>
Foi publicada uma atualização do ATP III em 2004.3 Esta versão inclui uma recomendação para uma redução de 30% a 40% do LDL básico em pacientes considerados de risco moderado ou alto para CHD e diretrizes sob as quais um paciente é considerado de risco muito alto. Os pacientes de risco muito alto podem incluir aqueles com DCV estabelecida mais um ou mais dos seguintes: múltiplos fatores de risco principais (por exemplo, diabetes); fatores de risco graves e pouco controlados (por exemplo, tabagismo, hipertensão descontrolada); múltiplos componentes da síndrome metabólica (TABELA 2); ou síndrome coronariana aguda.

A atualização do ATP III também sugere que medicação para redução de lipídios e uma meta LDL inferior a 100 mg/dL devem ser considerados para certos pacientes.3 Estes pacientes devem ter um risco de DCV de 10 anos de 10% a 20% e um nível LDL entre 100 mg/dL e 130 mg/dL. Eles também devem ser de idade avançada e ter fatores de risco severos; TG nível 200 mg/dL ou maior, não-HDL nível 160 mg/dL ou maior, e HDL nível 40 mg/dL ou menor; síndrome metabólica; ou fatores de risco emergentes como proteína C-reativa de alta sensibilidade (hs-CRP) (<3 mg/dL) ou cálcio coronário maior que o percentil 75 para a idade e sexo de uma pessoa.
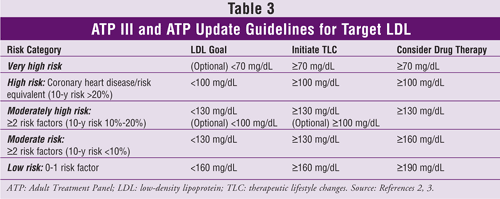
Níveis-alvo de LDL, recomendações para mudanças no estilo de vida terapêutico e informações sobre iniciação de medicamentos para redução do colesterol (com base no número de fatores de risco de DCV ou equivalentes) de ATP III e sua atualização são dadas na tabela 3.2,3
Nontraditional Risk Markers
Previsão tradicional do risco de DCV depende muito da FRS. Há limitações a essa abordagem, entretanto, já que a FRS tem sido observada para superestimar o risco em populações de baixo risco e subestimar o risco em populações de alto risco.4 De fato, morte súbita e IM não-fatal sem sintomas prévios ocorrem em até 25% dos pacientes com DCV.5 Como foi dito anteriormente, a atualização do ATP III recomenda a consideração de tratamento lipídico mais agressivo em pacientes com fatores de risco emergentes.3 Na última década, a pesquisa tem se concentrado no papel desempenhado por fatores de risco não tradicionais na fisiopatologia da DCV. Fibrinogênio, hs-CRP, cálcio coronário e análise de subfração de lipoproteínas têm sido os sujeitos de muitas pesquisas.
Embora vários marcadores de inflamação tenham sido associados à DCV, apenas aqueles que podem ser medidos facilmente são de valor prático.6 Um desses marcadores inflamatórios é o hs-CRP.7 O hs-CRP elevado tem sido associado a um risco aumentado de DCV, acidente vascular cerebral e doença vascular periférica em pacientes com e sem aterosclerose conhecida. Os níveis de hs-CRP têm sido divididos em tertis. Estes tertis (<1,0 mg/L, 1 mg/L-3 mg/L, e >3 mg/L) correspondem, respectivamente, a uma taxa de resposta arterial sistêmica de baixo, moderado e alto risco.8
O estudo clínico mais recente e importante examinando a utilidade da PCR na previsão do risco cardiovascular é o estudo JUPITER.9 Este estudo incluiu especificamente pacientes saudáveis com colesterol normal (LDL <130 mg/dL) e um nível elevado de PCR (>2 mg/dL). Estes pacientes foram tratados com rosuvastatina 20 mg ou placebo para avaliar o desfecho composto de IM subsequente ou AVC não fatal e o risco composto de IM, AVC e morte por causas cardiovasculares. O estudo foi interrompido após 1,9 anos de seguimento porque o tratamento com rosuvastatina reduziu o desfecho composto em 44% em relação ao placebo. Este tem sido um estudo marcante porque demonstra que pacientes sem outros fatores de risco cardiovascular além de PCR elevada obtiveram um benefício significativo com a terapia com rosuvastatina; entretanto, a relação custo-efetividade do rastreamento de indivíduos saudáveis para PCR elevada e a expansão da prescrição de estatinas em tais casos é desconhecida.
As estatinas beta, outros agentes lipídicos (como niacina, fibratos e ezetimibe), assim como tiazolidinadiones e raloxifeno, demonstraram reduzir os níveis de PCR. Atualmente, recomenda-se considerar os níveis de hs-CRP no processo de tomada de decisão do tratamento para pacientes com risco de DCV predito por FRS de 10% a 20% nos próximos 10 anos, e evitar a medida rotineira de hs-CRP na população geral adulta.7,8,10
Fibrinogênio também tem sido estudado como um preditor não tradicional de risco de DCV. No estudo CARDIA (Coronary Artery Risk Development in Young Adults), o nível elevado de fibrinogênio em indivíduos de 25 a 37 anos de idade foi associado a um risco aumentado de DCV subclínica na década subseqüente de vida de um paciente.10 O fibrinogênio desempenha um papel importante na agregação plaquetária e na formação de fibrina, sendo ambos componentes-chave da aterosclerose e do desenvolvimento de trombos.1,11 Os pacientes do estudo CARDIA que apresentavam níveis elevados de fibrinogênio foram considerados como tendo aumentado a espessura da íntima carotídea e a calcificação coronária-artéria (CAC) na década subseqüente. Neste momento, entretanto, a medida rotineira dos níveis de fibrinogênio não é recomendada.10
CAC desenvolve-se em artérias coronárias ateroscleróticas e está praticamente ausente em uma parede vascular normal. Escores mais altos de CAC estão associados com aumento da especificidade, mas diminuição da sensibilidade, para predição de risco cardiovascular. É importante notar, entretanto, que embora escores CAC elevados se correlacionem com um risco aumentado de DCV, eventos cardiovasculares ainda podem ocorrer em um paciente com um escore CAC de zero. O valor prognóstico da medida da CAC tem sido muito debatido na última década. Desde 2000, tem havido evidências crescentes de que a CAC pode ser independentemente preditiva do resultado cardiovascular, além dos tradicionais fatores de risco. Em 2007, o American College of Cardiology Foundation/American Heart Association Writing Committee publicou um documento de consenso sobre o uso do CAC na avaliação global do risco cardiovascular.12 O consenso do comitê foi desencorajar a triagem do CAC não-selecionado, por ser de valor clínico limitado para pacientes de baixo risco para CC (FRS <1%/ano). Assim como com hs-CR e fibrinogênio, a medida de rotina do CAC não é recomendada; entretanto, os escores de CAC podem ser uma ferramenta útil para modificar a previsão de risco e potencialmente alterar a terapia para pacientes assintomáticos de risco intermediário adequadamente selecionados.
Lipoproteína(a), ou Lp(a), é identificada nas diretrizes ATP III como um fator de risco emergente de DCV.2 Os lipídios são transportados por todo o corpo como complexos lipídicos e protéicos conhecidos como lipoproteínas. As lipoproteínas variam em tamanho e densidade e são designadas como LDL, HDL, e lipoproteínas de muito baixa densidade (VLDL). Os constituintes proteicos destes complexos são referidos como apolipoproteínas. Lp(a), uma forma modificada de LDL, consiste de uma apoproteína(a), ou apo(a), molécula ligada à apolipoproteína B, ou apo(b), fracção da partícula LDL tradicional. É semelhante à LDL, tanto em composição quanto em densidade. Acredita-se que como o componente apo(a) da Lp(a) é estruturalmente similar ao plasminogênio, ele pode competir com o plasminogênio no organismo e assim inibir a fibrinólise. Além disso, especula-se que a Lp(a) promove o acúmulo de colesterol, desenvolvimento de células espumosas e propagação de placas ateroscleróticas.1 Tanto a niacina quanto o estrogênio têm demonstrado reduzir efetivamente a Lp(a); entretanto, nenhuma estatina efetivamente o faz.13,14 Níveis elevados de Lp(a) têm sido associados a um risco aumentado de DCV em algumas, mas não em todas, as populações estudadas.15 Atualmente, não há evidências de que a monitorização ou redução dos níveis de Lp(a) seja clinicamente útil, e a medida de rotina não é recomendada.16
Apolipoproteína(b) é o principal componente proteico não só do LDL, mas também do LDL de densidade intermediária e do VLDL. Para a predição de risco cardiovascular, a medida dos níveis de apo(b) e não-HDL tem sido proposta recentemente para ser superior à medida do colesterol LDL.17 Em uma análise post-hoc do Treating to New Targets e estudos IDEAL, verificou-se que o colesterol não-HDL (o produto da subtração do colesterol HDL da medida do colesterol total) e apo(b) estavam mais estreitamente associados aos resultados cardiovasculares do que o colesterol LDL.18,19 especula-se que futuras diretrizes podem favorecer o colesterol não-HDL ou apo(b) em vez do colesterol LDL como alvo primário do tratamento; atualmente, entretanto, o LDL continua sendo o alvo primário do controle do colesterol.
Hiperhomocysteinemia tem sido independentemente ligada a um risco aumentado de DCV, embora não esteja tão fortemente associada quanto a FRS, e o mecanismo causal exato é desconhecido.20 Defeitos nas vias do folato e da B12 podem resultar em níveis elevados de homocisteína, assim como dietas deficientes em folato ou vitaminas B6 e B12 e medicamentos que interferem no metabolismo ou absorção dessas vitaminas.1 Falhas renais e hepáticas também podem elevar os níveis de homocisteína. Acredita-se que a hiper-homocysteinemia seja bastante incomum. A população idosa pode estar em risco aumentado para esta condição, devido à deficiência de folato na dieta. A medida dos níveis de homocisteína deve ser realizada quando o paciente se encontra em jejum, com níveis elevados, o que leva a uma avaliação da etiologia.
Finalmente, a análise de subfração de lipoproteína é outra ferramenta potencial para uma maior estratificação do risco cardiovascular. Sabe-se que a medida do LDL compreende um espectro de partículas LDL que vão desde as pequenas e densas até as mais leves e flutuantes. As partículas LDL pequenas e densas são observadas para conferir um maior risco cardiovascular.21 À medida que as LDL aumentam, as subfrações LDL pequenas e densas aumentam. Da mesma forma, as medidas do LDL total consistem em um espectro de partículas que variam em tamanho e densidade. Moléculas menores e mais densas de HDL conferem menos efeito cardioprotetor. À medida que os níveis de HDL diminuem, há um aumento acentuado de pequenas partículas de HDL. Com base nesses achados, foi sugerido que subfrações LDL elevadas, LDL pequenas elevadas, HDL baixas e HDL baixas e grandes são preditivas para a DCV. As diretrizes ATP III reconhecem que pequenas partículas LDL foram identificadas como um componente da aterogênese e que as medidas de subfrações HDL podem contribuir para a avaliação do risco de DCV. De acordo com as diretrizes, entretanto, a capacidade das subfrações LDL de prever a DCV independentemente de outros fatores de risco não está bem definida. Além disso, o ATP III aponta que a utilidade clínica da medição da subfração HDL não foi estabelecida. Devido a isso e ao fato de ainda não terem sido estabelecidos cortes significativos e reprodutíveis para tamanho, densidade e número de partículas, a medida da subfração de lipoproteínas não é utilizada no tratamento rotineiro da hiperlipidemia ou na estratificação de risco. Pode ser útil, entretanto, como coadjuvante da estratificação de risco tradicional para determinar a agressividade do tratamento em um paciente de risco intermediário.
Conclusão
Embora as diretrizes de tratamento baseadas em ATP III, que dependem fortemente da FRS, continuem sendo o núcleo das recomendações de tratamento em DCV, indicadores não tradicionais de DCV estão surgindo como coadjuvantes para fornecer estratificação de risco mais refinada e auxiliar na identificação de pacientes com doença subclínica precoce que podem precisar de tratamento mais precoce e agressivo.
O papel preciso dos marcadores de risco de DCV não tradicionais na determinação do risco cardiovascular futuro de uma pessoa, diretrizes para os níveis-alvo e recomendações específicas sobre quais populações devem ter esses marcadores medidos rotineiramente ainda não foram delineados. Nenhum dos marcadores não tradicionais de DCV é recomendado atualmente para triagem de rotina; entretanto, em pacientes para os quais a decisão de iniciar terapia (especialmente medicação) não é clara, a mensuração desses fatores de risco pode ser útil. Nessas situações, a medida de fatores de risco não tradicionais, além das ferramentas tradicionais de previsão de risco de DCV, pode conferir um benefício significativo.
1. Talbert RL. Hiperlipidemia. In: DiPiro JT, Talbert RL, Yee GC, et al, eds. Farmacoterapia: A Pathophysiologic Approach. 7ª ed. Nova York, NY: McGraw Hill Medical; 2008:385-407.
2. National Heart Lung and Blood Institute. Terceiro relatório do Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). www.nhlbi.nih.gov/guidelines/cholesterol/. Acessado em 1 de novembro de 2008.
3. Grundy SM, Cleeman JI, Merz CN, et al. Implicações de ensaios clínicos recentes para o National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulação. 2004;110:227-239.
4. Brindle P, Beswick A, Fahey T, Ebrahim S. A precisão e o impacto da avaliação de risco na prevenção primária da doença cardiovascular: uma revisão sistemática. O coração. 2006;92:1752-1759.
5. Myerburg RJ, Kessler KM, Castellanos A. Sudden cardiac death: epidemiology, transient risk, and intervention assessment. Ann Intern Med. 1993;119:1187-1197.
6. de Ferranti SD, Rifai N. C-reactive protein: um marcador sérico não tradicional de risco cardiovascular. Cardiovasc Pathol. 2007;16:14-21.
7. Koenig W, Sund M, Frölich M, et al. C-reactive protein, a sensitive marker of inflammation, predicts future risk of coronary heart disease in initially healthy middle-age men: results from the MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburg Cohort Study, 1984 to 1992. Circulação. 1999;99:237-242.
8. Pearson TA, Mensah GA, Alexander RW, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: a statement for health-care professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulação. 2003;107:499-511.
9. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin para prevenir eventos vasculares em homens e mulheres com proteína C reativa elevada. N Engl J Med. 2008;359:2195-2207.
10. Comitê de Doenças Cardiovasculares e Metabólicas. Avaliação do risco de doenças cardiovasculares com fatores de risco não tradicionais: as últimas evidências. CMDManagement Insights Informat Cardiovasc Metabol Dis. 2008;13(2):1-3,6.
11. Mora S, Rifai N, Buring JE, Ridker PM. Valor aditivo do fibrinogênio imunoensaio medido e níveis de proteína C reativa de alta sensibilidade para previsão de eventos cardiovasculares incidentes. Circulação. 2006;114:381-387.
12. Greenland B, Bonow RO, Brundage BH, et al. ACCF/AHA 2007 Clinical Expert Consensus Document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain. Um relatório da American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography). J Am Coll Cardiol. 2007;49:378-402.
13. Angelin B. Therapy for lowering lipoprotein (a) levels. Curr Opinião Lipidol. 1997;8:337-341.
14. Brown BG, Zhao XQ, Chait A, et al. Simvastatina e niacina, vitaminas antioxidantes, ou a combinação para a prevenção de doenças coronárias. N Engl J Med. 2001;345:1583-1592.
15. Moliterno D, Jokinen EV, Miserez AR, et al. Nenhuma associação entre as concentrações de lipoproteínas plasmáticas(a) e a presença ou ausência de aterosclerose coronária em afro-americanos. Arterioscler Thromb Vasc Biol. 1995;15:850-855.
16. Bennet A, Di Angelantonio E, Erqou S, et al. Lipoprotein(a) levels and risk of future coronary heart disease: large-scale prospective data. Arch Intern Med. 2008;168:598-608.
17. Kastelein JJ, van der Steeg WA, Holme I, et al. Lipídeos, apolipoproteínas, e suas proporções em relação aos eventos cardiovasculares com tratamento com estatina. Circulação. 2008;117:3002-3009.
18. LaRosa JC, Grundy SM, Waters DD, et al. Abaixamento intensivo de lipídios com atorvastatina em pacientes com doença coronária estável. N Engl J Med. 2005;352:1425-1435.
19. Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin para prevenção secundária após infarto do miocárdio: o estudo IDEAL: um ensaio controlado randomizado. JAMA. 2005;294:2437-2445.
20. Wald DS, Law M, Morris JK. Homocisteína e doença cardiovascular: evidências sobre causalidade a partir de uma meta-análise. BMJ. 2002;325:1202-1206.
21. Rizzo M, Berneis K. Low-density lipoprotein size and cardiovascular risk assessment. QJM.2006;99:1-14.