US Pharm. 2009;34(2):25-27.
Boala cardiovasculară (CVD), principala cauză de deces la nivel mondial, implică mecanisme care nu au fost încă pe deplin înțelese. Deși lipidele plasmatice sunt necesare din punct de vedere biologic pentru sinteza membranelor celulare și producția de hormoni și reprezintă o sursă de acizi grași liberi, dislipidemia a fost asociată de mult timp cu o incidență crescută a bolilor cardiovasculare, a accidentelor vasculare cerebrale și a bolilor arteriale periferice1.
Stratificarea tradițională a riscului
Abordarea actuală a tratamentului pentru dislipidemie este specificată în National Cholesterol Education Program Adult Treatment Panel (ATP) III.2 În ATP III, factorii de risc și stratificarea ulterioară a riscului sunt derivate prin calcularea a ceea ce este cunoscut sub numele de scor de risc Framingham (FRS), care a fost utilizat timp de decenii pentru a prezice riscul de boli cardiovasculare. ATP III oferă recomandări pentru stratificarea riscului în funcție de factori de risc multipli, diabet și sindrom metabolic. Factorii de risc pentru boala coronariană (CHD) includ hipertensiunea arterială (tensiune arterială ≥140/90 sau utilizarea de antihipertensive); istoricul familial (rudă de gradul întâi cu CHD ); vârsta (bărbați, ≥45 de ani; femei, ≥55 de ani); nivel de lipoproteine cu densitate mare (HDL) care depășește 40 mg/dL; și fumatul. Un nivel de HDL care depășește 50 mg/dL este identificat ca fiind cardioprotector și, prin urmare, este considerat un factor de risc „negativ”. În plus față de enumerarea factorilor de risc CHD specifici, ATP III identifică echivalenți de risc CHD (condiții care conferă un risc similar pentru un eveniment CHD). Echivalentele de risc CHD includ boala arterelor carotide, anevrismul aortic abdominal, boala arterială periferică, diabetul zaharat sau un risc de infarct miocardic (IM) pe 10 ani de cel puțin 20% (adică FRS ≥20%).1,2
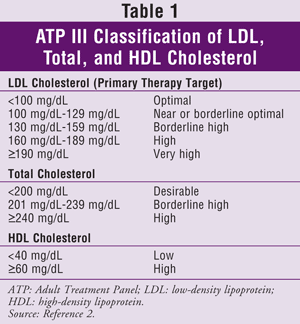
ATP III specifică lipoproteinele cu densitate scăzută (LDL) ca țintă principală pentru tratamentul colesterolului. Atingerea nivelurilor țintă de trigliceride (TG) și HDL este în general considerată un obiectiv secundar. Obiectivele de colesterol pentru populația generală sunt prezentate în TABELUL 1.2
O actualizare a ATP III a fost publicată în 2004.3 Această versiune include o recomandare pentru o reducere de 30% până la 40% față de valoarea inițială a LDL la pacienții considerați ca având un risc moderat sau ridicat de boli coronariene, precum și liniile directoare conform cărora un pacient este considerat ca având un risc foarte ridicat. Pacienții cu risc foarte ridicat îi pot include pe cei cu boli cardiovasculare stabilite plus unul sau mai multe dintre următoarele: factori de risc majori multipli (de ex., diabet); factori de risc severi și slab controlați (de ex, fumat, hipertensiune arterială necontrolată); componente multiple ale sindromului metabolic (TABELUL 2); sau sindromul coronarian acut.

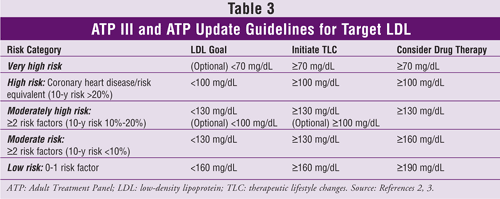
Updatarea ATP III sugerează, de asemenea, ca pentru anumiți pacienți să se ia în considerare medicația hipolipemiantă și un obiectiv LDL mai mic de 100 mg/dL.3 Acești pacienți ar trebui să aibă un risc de boală coronariană în 10 ani de 10% până la 20% și un nivel LDL între 100 mg/dL și 130 mg/dL. De asemenea, aceștia ar trebui să aibă o vârstă înaintată și să aibă factori de risc severi; un nivel de TG de 200 mg/dL sau mai mare, un nivel de non-HDL de 160 mg/dL sau mai mare și un nivel de HDL de 40 mg/dL sau mai mic; sindrom metabolic; sau factori de risc emergenți, cum ar fi proteina C reactivă cu sensibilitate ridicată (hs-CRP) (<3 mg/dL) sau calciu coronarian mai mare decât percentila 75 pentru vârsta și sexul unei persoane.
Nivelurile țintă de LDL, recomandările pentru modificări terapeutice ale stilului de viață și informațiile privind inițierea medicamentelor hipocolesterolemiante (pe baza numărului de factori de risc de boală coronariană sau echivalenți) din ATP III și actualizarea sa sunt prezentate în TABELUL 3.2,3
Markerii de risc netradiționali
Predicția tradițională a riscului de boală coronariană se bazează în mare măsură pe FRS. Cu toate acestea, există limitări ale acestei abordări, deoarece s-a observat că FRS supraestimează riscul în populațiile cu risc scăzut și subestimează riscul în populațiile cu risc ridicat.4 De fapt, moartea subită și infarctul miocardic netradițional fără simptome anterioare apar la până la 25% dintre pacienții cu boli coronariene.5 După cum s-a afirmat anterior, actualizarea ATP III recomandă luarea în considerare a unui tratament lipidic mai agresiv la pacienții cu factori de risc emergenți.3 În ultimul deceniu, cercetările s-au concentrat asupra rolului pe care factorii de risc netradiționali îl joacă în fiziopatologia bolilor cardiovasculare. Fibrinogenul, hs-CRP, calciul coronarian și analiza subfracției lipoproteice au fost subiectele multor cercetări.
Deși mai mulți markeri ai inflamației au fost asociați cu MCV, numai cei care pot fi măsurați cu ușurință au o valoare practică.6 Un astfel de marker inflamator este hs-CRP.7 hs-CRP crescută a fost asociată cu un risc crescut de MCV, accident vascular cerebral și boală vasculară periferică la pacienții cu și fără ateroscleroză cunoscută. Nivelurile de hs-CRP au fost împărțite în terți. Aceste tertile (<1,0 mg/L, 1 mg/L-3 mg/L și >3 mg/L) corespund, respectiv, cu FRS de risc scăzut, moderat și ridicat.8
Cel mai recent studiu clinic major care examinează utilitatea CRP în predicția riscului cardiovascular este studiul JUPITER.9 Acest studiu a inclus în mod specific pacienți sănătoși cu colesterol normal (LDL <130 mg/dL) și un nivel ridicat de CRP (>2 mg/dL). Acești pacienți au fost tratați cu rosuvastatină 20 mg sau placebo pentru a evalua criteriul final compus de IM ulterior sau de accident vascular cerebral nefatal și riscul compus de IM, accident vascular cerebral și deces din cauze cardiovasculare. Studiul a fost întrerupt după 1,9 ani de urmărire, deoarece s-a constatat că tratamentul cu rosuvastatină a redus punctul final compozit cu 44% comparativ cu placebo. Acesta a fost un studiu de referință, deoarece demonstrează că pacienții fără alți factori de risc cardiovascular în afară de CRP ridicată au obținut un beneficiu semnificativ de pe urma tratamentului cu rosuvastatină; cu toate acestea, nu se cunoaște raportul cost-eficiență al depistării persoanelor sănătoase pentru CRP ridicată și al extinderii prescrierii de statine în astfel de cazuri.
În afară de statine, s-a demonstrat că alți agenți de scădere a lipidelor (cum ar fi niacina, fibrații și ezetimibe), precum și tiazolidinedionele și raloxifenul, reduc nivelul CRP. În prezent, se recomandă să se ia în considerare nivelurile de hs-CRP în procesul de luare a deciziilor de tratament pentru pacienții cu un risc de MCV estimat de FRS de 10% până la 20% în următorii 10 ani și să se evite măsurarea de rutină a hs-CRP în populația adultă generală.7,8,10
Fibrinogenul a fost, de asemenea, studiat ca un predictor netradițional al riscului de MCV. În cadrul studiului Coronary Artery Risk Development in Young Adults (CARDIA), un nivel ridicat de fibrinogen la subiecții cu vârste cuprinse între 25 și 37 de ani a fost asociat cu un risc crescut de boli cardiovasculare subclinice în următorul deceniu de viață al pacientului.10 Fibrinogenul joacă un rol important în agregarea plachetară și în formarea fibrinei, ambele fiind componente cheie ale aterosclerozei și ale dezvoltării trombilor.1,11 S-a constatat că pacienții din studiul CARDIA care aveau niveluri ridicate de fibrinogen prezentau o grosime intimă carotidiană și o calcifiere coronariană (CAC) crescută în deceniul următor. În acest moment, totuși, măsurarea de rutină a nivelurilor de fibrinogen nu este recomandată.10
CAC se dezvoltă în arterele coronare aterosclerotice și este practic absentă într-un perete vascular normal. Scorurile CAC mai mari sunt asociate cu o specificitate crescută, dar cu o sensibilitate scăzută, pentru predicția riscului cardiovascular. Cu toate acestea, este important de remarcat faptul că, deși scorurile CAC ridicate se corelează cu un risc crescut de boli cardiovasculare, evenimentele cardiovasculare pot apărea în continuare la un pacient cu un scor CAC de zero. Valoarea prognostică a măsurării CAC a fost mult dezbătută în ultimul deceniu. Începând cu anul 2000, au apărut tot mai multe dovezi că CAC poate fi un factor predictiv independent al rezultatelor cardiovasculare, în plus față de factorii de risc tradiționali. În 2007, American College of Cardiology Foundation/American Heart Association Writing Committee a publicat un document de consens cu privire la utilizarea CAC în evaluarea globală a riscului cardiovascular.12 Consensul comitetului a fost de a descuraja screeningul CAC neselectat, deoarece are o valoare clinică limitată pentru pacienții cu risc scăzut de CHD (FRS <1%/an). Ca și în cazul hs-CR și al fibrinogenului, măsurarea de rutină a CAC nu este recomandată; cu toate acestea, scorurile CAC pot fi un instrument util pentru modificarea predicției riscului și, eventual, pentru modificarea terapiei la pacienții asimptomatici, cu risc intermediar, selectați în mod corespunzător.
Lipoproteina(a), sau Lp(a), este identificată în ghidurile ATP III ca fiind un factor de risc CVD emergent.2 Lipidele sunt transportate în tot corpul sub formă de complexe lipidice și proteice cunoscute sub numele de lipoproteine. Lipoproteinele variază în funcție de dimensiune și densitate și sunt desemnate în consecință ca fiind LDL, HDL și lipoproteine cu densitate foarte mică (VLDL). Constituenții proteici din aceste complexe sunt denumiți apolipoproteine. Lp(a), o formă modificată de LDL, este formată dintr-o moleculă de apoproteină(a), sau apo(a), legată de apolipoproteina B, sau apo(b), din particula LDL tradițională. Este similară cu LDL atât în ceea ce privește compoziția, cât și densitatea. Se crede că, din moment ce componenta apo(a) a Lp(a) este structural asemănătoare cu plasminogenul, aceasta poate concura cu plasminogenul din organism și, astfel, poate inhiba fibrinoliza. În plus, se presupune că Lp(a) favorizează acumularea colesterolului, dezvoltarea celulelor spumoase și propagarea plăcilor aterosclerotice.1 S-a demonstrat că atât niacina, cât și estrogenul reduc în mod eficient Lp(a); cu toate acestea, nicio statină nu face acest lucru în mod eficient.13,14 Nivelurile ridicate de Lp(a) au fost asociate cu un risc crescut de boli cardiovasculare la unele, dar nu la toate populațiile studiate.15 În prezent, nu există dovezi că monitorizarea sau reducerea nivelurilor de Lp(a) este utilă din punct de vedere clinic, iar măsurarea de rutină nu este recomandată.16
Apolipoproteina(b) este componenta proteică majoră nu numai a LDL, ci și a LDL de densitate intermediară și VLDL. Pentru predicția riscului cardiovascular, s-a propus recent că măsurarea nivelurilor de apo(b) și de colesterol non-HDL este superioară măsurării colesterolului LDL.17 Într-o analiză post-hoc a studiilor Treating to New Targets și IDEAL, s-a constatat că colesterolul non-HDL (produsul scăderii colesterolului HDL din măsurarea colesterolului total) și apo(b) au fost mai strâns asociate cu rezultatele cardiovasculare decât colesterolul LDL.18,19 Se speculează că viitoarele ghiduri ar putea favoriza colesterolul non-HDL sau apo(b) mai degrabă decât colesterolul LDL ca țintă principală de tratament; în prezent, totuși, LDL rămâne ținta principală a gestionării colesterolului.
Hiperhomocisteinemia a fost asociată în mod independent cu un risc crescut de boli cardiovasculare, deși nu este la fel de puternic asociată ca FRS, iar mecanismul cauzal exact este necunoscut.20 Defectele în căile folatului și B12 pot duce la niveluri ridicate de homocisteină, la fel ca și dietele deficitare în folat sau în vitaminele B6 și B12 și medicamentele care interferează cu metabolismul sau absorbția acestor vitamine.1 Insuficiența renală și hepatică pot, de asemenea, să ridice nivelul homocisteinei. Se crede că hiperhomocisteinemia este destul de puțin frecventă. Populația vârstnică poate prezenta un risc crescut pentru această afecțiune, din cauza deficienței de folat din alimentație. Măsurarea nivelurilor de homocisteină trebuie efectuată atunci când pacientul se află în stare de repaus alimentar, nivelurile ridicate determinând o evaluare a etiologiei.
În cele din urmă, analiza subfracției lipoproteice este un alt instrument potențial pentru stratificarea suplimentară a riscului cardiovascular. Se știe că măsurarea LDL cuprinde un spectru de particule LDL care variază de la cele mici și dense la cele mai ușoare și mai plutitoare. S-a observat că particulele LDL mici și dense conferă un risc cardiovascular mai mare.21 Pe măsură ce LDL crește, subfracțiunile LDL mici și dense cresc. De asemenea, măsurătorile de HDL total constau dintr-un spectru de particule care variază în mărime și densitate. Moleculele HDL mai mici și mai dense conferă un efect cardioprotector mai puțin important. Pe măsură ce nivelul HDL scade, există o creștere marcantă a particulelor HDL mici. Pe baza acestor constatări, s-a sugerat că un nivel ridicat de LDL, subfracțiuni LDL mici ridicate, un nivel scăzut de HDL și subfracțiuni HDL mici și mari sunt predictive pentru MCV. Liniile directoare ATP III recunosc faptul că particulele LDL mici au fost identificate ca fiind o componentă a aterogenezei și că măsurătorile subfracțiilor HDL pot contribui la evaluarea riscului de MCV. Cu toate acestea, conform liniilor directoare, capacitatea subfracțiilor LDL de a prezice MCV independent de alți factori de risc nu este bine definită. În plus, ATP III subliniază că utilitatea clinică a măsurării subfracțiilor HDL nu a fost stabilită. Din această cauză și din cauza faptului că nu au fost încă stabilite cutoffs semnificative și reproductibile pentru dimensiunea, densitatea și numărul de particule, măsurarea subfracțiilor lipoproteice nu este utilizată în managementul de rutină al tratamentului hiperlipidemiei sau în stratificarea riscului. Cu toate acestea, poate fi utilă ca adjuvant la stratificarea tradițională a riscului pentru a determina agresivitatea tratamentului la un pacient cu risc intermediar.
Concluzie
Deși ghidurile de tratament bazate pe ATP III, care se bazează în mare măsură pe FRS, rămân nucleul recomandărilor de tratament în MCV, indicatorii netradiționali ai MCV apar ca adjuncți pentru a oferi o stratificare mai rafinată a riscului și pentru a ajuta la identificarea pacienților cu boală subclinică timpurie care pot avea nevoie de un tratament mai devreme și mai agresiv.
Rolul precis al markerilor netradiționali de risc de MCV în determinarea riscului cardiovascular viitor al unei persoane, liniile directoare pentru nivelurile țintă și recomandările specifice cu privire la populațiile cărora ar trebui să li se măsoare de rutină acești markeri nu au fost încă delimitate. Niciunul dintre markerii MCV netradiționali nu este recomandat în prezent pentru screeningul de rutină; cu toate acestea, la pacienții pentru care decizia de inițiere a unei terapii (în special medicamentoase) este neclară, măsurarea acestor factori de risc poate fi utilă. În astfel de situații, măsurarea factorilor de risc netradiționali în plus față de instrumentele tradiționale de predicție a riscului de MCV poate conferi un beneficiu semnificativ.
1. Talbert RL. Hiperlipidemia. În: A: DiPiro JT, Talbert RL, Yee GC, et al, eds. Pharmacotherapy: A Pathophysiologic Approach (O abordare fiziopatologică). Ed. a 7-a. New York, NY: McGraw Hill Medical; 2008:385-407.
2. National Heart Lung and Blood Institute. Al treilea raport al Grupului de experți privind detectarea, evaluarea și tratamentul colesterolului ridicat în sânge la adulți (Adult Treatment Panel III). www.nhlbi.nih.gov/guidelines/cholesterol/. Accesat la 1 noiembrie 2008.
3. Grundy SM, Cleeman JI, Merz CN, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation. 2004;110:227-239.
4. Brindle P, Beswick A, Fahey T, Ebrahim S. The accuracy and impact of risk assessment in the primary prevention of cardiovascular disease: a systematic review. Heart. 2006;92:1752-1759.
5. Myerburg RJ, Kessler KM, Castellanos A. Moartea cardiacă subită: epidemiologie, risc tranzitoriu și evaluarea intervenției. Ann Intern Med. 1993;119:1187-1197.
6. de Ferranti SD, Rifai N. Proteina C-reactivă: un marker seric netradițional al riscului cardiovascular. Cardiovasc Pathol. 2007;16:14-21.
7. Koenig W, Sund M, Frölich M, et al. Proteina C-reactivă, un marker sensibil al inflamației, prezice riscul viitor de boală coronariană la bărbații de vârstă mijlocie inițial sănătoși: rezultatele studiului de cohortă MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburg Cohort Study, 1984 – 1992. Circulation. 1999;99:237-242.
8. Pearson TA, Mensah GA, Alexander RW, et al. Markers of inflammation and cardiovascular disease: application to clinical and public health practice: a statement for health-care professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003;107:499-511.
9. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatina pentru prevenirea evenimentelor vasculare la bărbații și femeile cu proteină C-reactivă ridicată. N Engl J Med. 2008;359:2195-2207.
10. Comitetul pentru boli cardiovasculare și metabolice. Evaluarea riscului de boli cardiovasculare cu ajutorul factorilor de risc netradiționali: cele mai recente dovezi. CMDManagement Insights Informat Cardiovasc Metabol Dis. 2008;13(2):1-3,6.
11. Mora S, Rifai N, Buring JE, Ridker PM. Valoarea aditivă a nivelurilor de fibrinogen măsurate prin imunoanaliză și de proteină C reactivă de înaltă sensibilitate pentru predicția evenimentelor cardiovasculare incidente. Circulation. 2006;114:381-387.
12. Greenland B, Bonow RO, Brundage BH, et al. ACCF/AHA 2007 Clinical Expert Consensus Document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain. A report of the American College of Cardiology Foundation Clinical Expert Consensus Task Force (ACCF/AHA Writing Committee to Update the 2000 Expert Consensus Document on Electron Beam Computed Tomography). J Am Coll Cardiol. 2007;49:378-402.
13. Angelin B. Terapia de scădere a nivelului lipoproteinei (a). Curr Opin Lipidol. 1997;8:337-341.
14. Brown BG, Zhao XQ, Chait A, et al. Simvastatina și niacina, vitaminele antioxidante, sau combinația pentru prevenirea bolii coronariene. N Engl J Med. 2001;345:1583-1592.
15. Moliterno D, Jokinen EV, Miserez AR, et al. Nici o asociere între concentrațiile plasmatice de lipoproteină(a) și prezența sau absența aterosclerozei coronariene la afro-americani. Arterioscler Thromb Vasc Biol. 1995;15:850-855.
16. Bennet A, Di Angelantonio E, Erqou S, et al. Nivelurile de lipoproteină(a) și riscul de boală coronariană viitoare: date prospective pe scară largă. Arch Intern Med. 2008;168:598-608.
17. Kastelein JJ, van der Steeg WA, Holme I, et al. Lipidele, apolipoproteinele și raporturile lor în legătură cu evenimentele cardiovasculare cu tratamentul cu statine. Circulation. 2008;117:3002-3009.
18. LaRosa JC, Grundy SM, Waters DD, et al. Scăderea intensivă a lipidelor cu atorvastatină la pacienții cu boală coronariană stabilă. N Engl J Med. 2005;352:1425-1435.
19. Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs. simvastatin în doză obișnuită pentru prevenirea secundară după infarctul miocardic: studiul IDEAL: un studiu controlat randomizat. JAMA. 2005;294:2437-2445.
20. Wald DS, Law M, Morris JK. Homocisteina și bolile cardiovasculare: dovezi privind cauzalitatea dintr-o meta-analiză. BMJ. 2002;325:1202-1206.
21. Rizzo M, Berneis K. Dimensiunea lipoproteinelor cu densitate scăzută și evaluarea riscului cardiovascular. QJM.2006;99:1-14.