Celler innehåller mycket vatten. En av vattnets roller är att lösa upp olika material. Det finns till exempel många olika joniska föreningar (salter) i cellerna. Jonerna används för att upprätthålla cellpotentialen och är viktiga vid cellsignalering och muskelkontraktion.
Hur kan man avgöra om en förening är jonisk eller kovalent?
Det finns inget enkelt svar på den här frågan. Många bindningar ligger någonstans mitt emellan. I en polär kovalent bindning delas ett elektronpar mellan två atomer för att uppfylla deras oktat, men elektronerna ligger närmare den ena änden av bindningen än den andra. Det finns mer negativ laddning mot den ena änden av bindningen, och det lämnar mer positiv laddning i den andra änden.
Om vi tittar på elektronegativitetsvärdena för olika atomer kan vi avgöra hur jämnt ett elektronpar i en bindning delas. Elektronegativiteten ökar mot det övre högra hörnet av det periodiska systemet på grund av en kombination av kärnladdning och avskärmningsfaktorer. Atomer i det övre högra hörnet av det periodiska systemet har en större dragningskraft på sina delade bindningselektroner, medan atomer i det nedre vänstra hörnet har en svagare dragningskraft på elektronerna i kovalenta bindningar.
I en kol-syre-bindning skulle fler elektroner dras till syret eftersom det befinner sig till höger om kolet i sin rad i det periodiska systemet. Föreningar som , dimetyleter, CH3OCH3, är lite polära. Formaldehyd, CH2O, är ännu mer polar. Elektroner i pi-bindningar hålls lösare än elektroner i sigma-bindningar, av kvantmekaniska skäl. Det gör att syret lättare kan dra elektronerna till sig i en pi-bindning än i en sigma-bindning.

Inte alla polariteter är lätta att bestämma genom att kasta en blick på det periodiska systemet. Dipolens riktning i en bindning mellan bor och väte skulle vara svår att förutsäga utan att slå upp elektronegativitetsvärdena, eftersom bor ligger längre till höger men väte högre upp. Det visar sig att väte är något negativt.
En bindning är jonisk om elektronegativitetsskillnaden mellan atomerna är tillräckligt stor för att den ena atomen skulle kunna dra en elektron helt bort från den andra. Den situationen är vanlig i föreningar som kombinerar grundämnen från den vänstra kanten av det periodiska systemet (natrium, kalium, kalcium osv.) med grundämnen i det yttersta övre högra hörnet av det periodiska systemet (oftast syre, fluor, klor). Natriumklorid är en jonisk förening.
Många bindningar kan vara kovalenta i en situation och joniska i en annan. Till exempel är väteklorid, HCl, en gas där väte och klor är kovalent bundna, men om HCl bubblar in i vatten joniseras den helt och hållet och ger H+ och Cl- i en saltsyrelösning. Även i gasformigt HCl är laddningen inte jämnt fördelad. Kloret är delvis negativt och väte är delvis positivt.
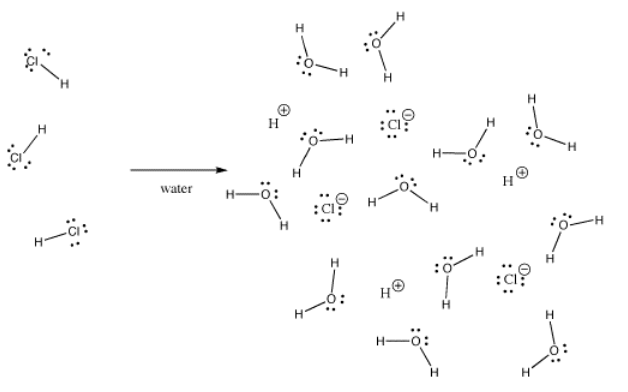
Kaliumhydroxid, KOH, innehåller en bindning som är kovalent (O-H) och en som är jonisk (K-O). Vätgas är knepigt eftersom det finns både högst upp i det periodiska systemet och på vänster sida. Det är precis tillräckligt elektropositivt för att bilda joniska bindningar i vissa fall. Det är precis elektronpositivt nog för att bilda kovalenta bindningar i andra fall.
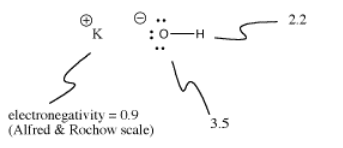
I KOH är K-O-bindningen jonisk eftersom skillnaden i elektronegativitet mellan kalium och syre är stor. Skillnaden i elektronegativitet mellan syre och väte är inte liten. En O-H-bindning kan ibland jonisera, men inte i alla fall.
Ibland beror joniseringen på vad som annars händer i en molekyl. Eftersom K-O-bindningen i kaliumhydroxid är jonisk är det inte särskilt troligt att O-H-bindningen joniserar. Det finns redan en negativ laddning på syre. Laddningsseparation kostar energi, så det är svårare att sätta en andra negativ laddning på syret genom att jonisera O-H-bindningen också. Ofta är första joniseringar i molekyler mycket lättare än andra joniseringar.
Övningsuppgift \(\PageIndex{1}\)
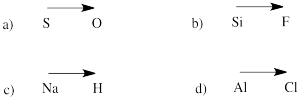
Förutsäg polaritetsriktningen i en bindning mellan atomerna i följande par:
a) svavel-oxygen b) kisel-fluor
c) väte-natrium d) klor-aluminium
Svar
Då det är så vanligt att ett grundämne från den yttersta vänstra delen av det periodiska systemet förekommer som katjon, och att grundämnen på den yttersta högra sidan bär negativ laddning, kan vi ofta anta att en förening som innehåller ett exemplar av var och en av dem kommer att ha minst en jonisk bindning.
Övningsuppgift \(\PageIndex{2}\)
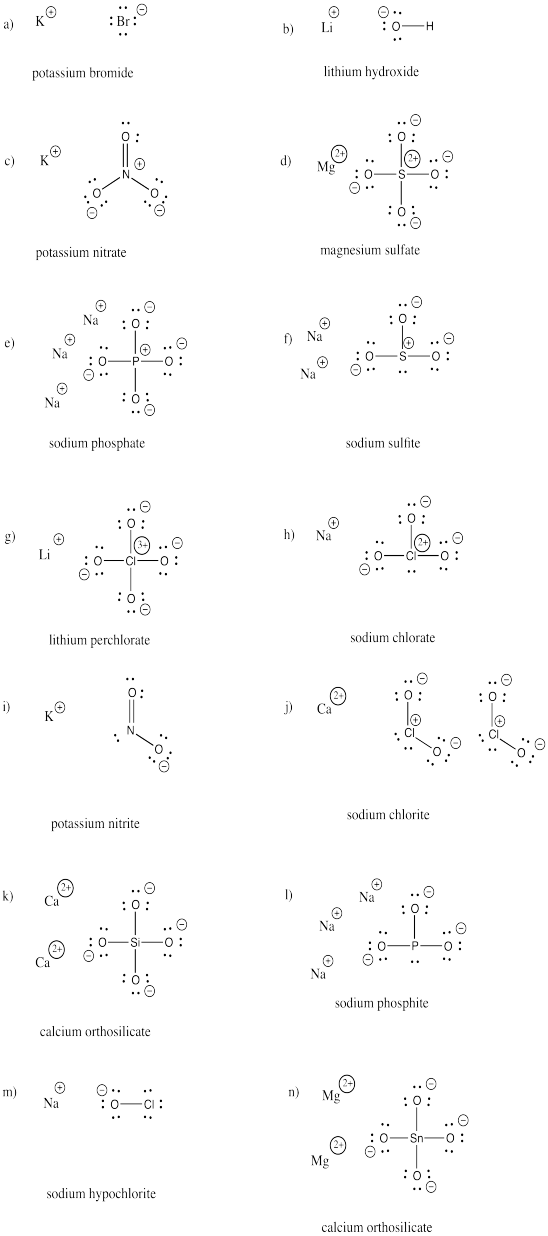
Rita strukturerna för följande föreningar. Var och en innehåller minst en anjon och en katjon.
a) KBr b) LiOH c) KNO3 d) MgSO4 e) Na3PO4 f) Na2SO3
g) LiClO4 h) NaClO3 i) KNO2 j) Ca(ClO2)2 k) Ca2SiO4 l) Na3PO3
m) NaOCl n) Mg2SnO4
Svar
Övning \(\PageIndex{3}\)
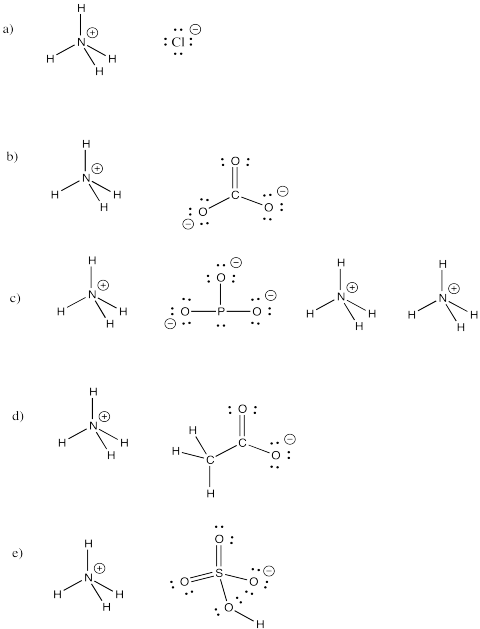
Ammoniumjon, NH4+, är en vanlig molekylär jon. Rita strukturer för följande föreningar som innehåller denna jon.
a) NH4Cl b) (NH4)2CO3 c) (NH4)3PO3 d) NH4CH3CO2 e) NH4HSO4
Svar
Övningsuppgift \(\PageIndex{4}\)
Många anjoner har namn som säger något om deras struktur.
| prefix- eller -suffix |
gemensam betydelse |
exempel på namn | exempel på formel |
| -ide | atom finns som anjon | klorid | Cl – |
| -ate | atom finns som oxyanjon; vanligtvis en vanlig form | klorat | ClO3- |
| -ite | atom förekommer som en oxyanjon, men med färre oxygener (eller lägre ”oxidationstillstånd”) än en annan vanlig form | klorit | ClO2- |
| per- | atom finns som en oxyanjon, men med ännu fler oxygener än ”-ate”-formen | perklorat | ClO4- |
| hypo- | atom finns som en oxyanjon, men med ännu färre oxygener än ”-it”-formen | hypoklorit | ClO- |
Föreslå namn för följande anjoner med hjälp av tabellen:
a) Br- b) O2- c) F- d) CO32- (vanlig oxanjon) e) NO3- (vanlig oxanjon) f) NO2-
g) S2- h) SO42- (vanlig oxanjon) i) SO32- j) SO52- k) C4- l) N3- m) As3-
n) PO43- (vanlig oxanjon) o) PO33- p) I- q) IO3- (vanlig oxyanjon) r) IO4-
Svar a)
bromid
Svar b)
oxid
Svar c)
fluorid
Svar d)
karbonat
Svar e)
nitrat
Svar f)
nitrit
Svar g)
sulfid
Svar h)
sulfat
Svar i)
sulfit
Svar j)
persulfat
Svar k)
karbid
Svar l)
nitrid
Svar m)
arsenid
Svar n)
fosfat
Svar o)
fosfit
Svar p)
jodid
Svar q)
jodat
Svar r)
periodat
Attribution
Chris P Schaller, Ph.D., (College of Saint Benedict / Saint John’s University)