Atomemissionsspektrum
Elektronerna i en atom tenderar att vara arrangerade på ett sådant sätt att atomens energi är så låg som möjligt. En atoms grundtillstånd är atomens lägsta energitillstånd. När dessa atomer får energi absorberar elektronerna energin och förflyttar sig till en högre energinivå. Dessa energinivåer för elektronerna i atomer är kvantiserade, vilket återigen innebär att elektronen måste förflytta sig från en energinivå till en annan i diskreta steg, snarare än kontinuerligt. Ett exciterat tillstånd hos en atom är ett tillstånd där dess potentiella energi är högre än grundtillståndet. En atom i det exciterade tillståndet är inte stabil. När den återgår till grundtillståndet släpper den den energi som den tidigare hade fått i form av elektromagnetisk strålning.
Hur får atomer då energi överhuvudtaget? Ett sätt är att låta en elektrisk ström passera genom ett inneslutet prov av en gas vid lågt tryck. Eftersom elektronernas energinivåer är unika för varje grundämne kommer varje gasurladdningsrör att lysa med en distinkt färg beroende på gasens identitet (se nedan).

”Neon”-skyltar är välkända exempel på gasurladdningsrör. Det är dock endast skyltar som lyser med den röd-orange färg som syns i figuren som faktiskt är fyllda med neon. Skyltar med andra färger innehåller olika gaser eller gasblandningar.
Vetenskapsmän studerade den utmärkande rosa färgen hos den gasurladdning som skapas av vätgas. När en smal stråle av detta ljus betraktades genom ett prisma separerades ljuset i fyra linjer med mycket specifika våglängder (och frekvenser eftersom \(\lambda\) och \(\nu\) är omvänt relaterade). Ett atomemissionsspektrum är det mönster av linjer som bildas när ljus passerar genom ett prisma för att separera det i de olika frekvenser av ljus som det innehåller. Figuren nedan visar det atomära emissionsspektrumet för väte.
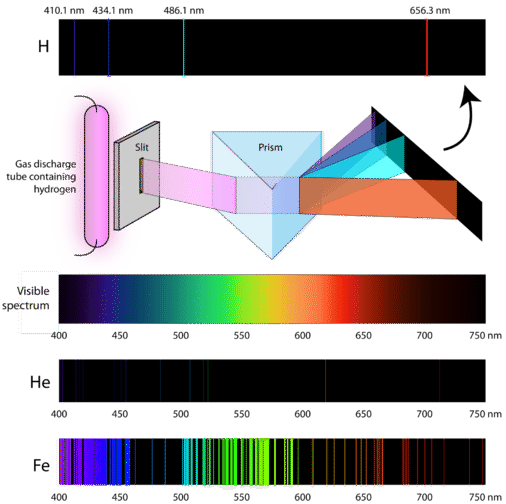
Den klassiska teorin kunde inte förklara existensen av atomära emissionsspektrum, även kallade linjeemissionsspektrum. Enligt den klassiska fysiken skulle en atom i grundtillstånd kunna absorbera vilken mängd energi som helst i stället för bara diskreta mängder. När atomerna slappnar av tillbaka till ett lägre energitillstånd skulle på samma sätt vilken mängd energi som helst kunna frigöras. Detta skulle resultera i vad som kallas ett kontinuerligt spektrum, där alla våglängder och frekvenser finns representerade. Vitt ljus sett genom ett prisma och en regnbåge är exempel på kontinuerliga spektrum. Atomära emissionsspektra var mer bevis för ljusets kvantiserade natur och ledde till en ny modell av atomen baserad på kvantteori.