Periodiska trender
Först kommer vi att fokusera på enskilda atomer och fundera på trender som är förknippade med ett grundämnes position i det periodiska systemet. Vi kommer att använda de enkla organiska föreningarna etan, metylamin och etanol som våra första modeller, men begreppen gäller i lika hög grad för mer komplexa biomolekyler med samma funktionaliteter, till exempel sidokedjorna i aminosyrorna alanin (alkan), lysin (amin) och serin (alkohol).
Horisontell periodisk trend i surhet och basiskhet:
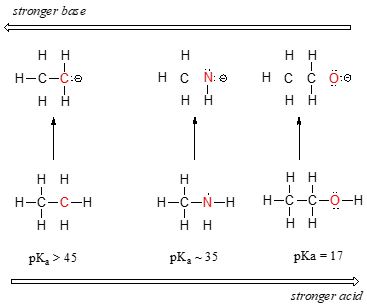
Vi kan se en tydlig trend i surhet när vi rör oss från vänster till höger längs den andra raden i det periodiska systemet från kol till kväve till syre. Nyckeln till att förstå denna trend är att betrakta den hypotetiska konjugerade basen i varje fall: ju stabilare (svagare) den konjugerade basen är, desto starkare är syran. Titta på var den negativa laddningen hamnar i varje konjugerad bas. I etans konjugerade bas bärs den negativa laddningen av en kolatom, medan den negativa laddningen i metylamins och etanolens konjugerade bas ligger på ett kväve respektive ett syre. Kom ihåg från avsnitt 2.4A att elektronegativiteten också ökar när vi rör oss från vänster till höger längs en rad i det periodiska systemet, vilket innebär att syre är den mest elektronegativa av de tre atomerna och kol den minst elektronegativa.
Notis
Desto mer elektronegativ en atom är, desto bättre kan den bära en negativ laddning. Svagare baser har negativa laddningar på mer elektronegativa atomer; starkare baser har negativa laddningar på mindre elektronegativa atomer.
Därmed är metoxidanjonen den mest stabila (lägst energi, minst basisk) av de tre konjugerade baserna, och etylkarbanjonanjonen är den minst stabila (högst energi, mest basisk). Omvänt är etanol den starkaste syran och etan den svagaste syran.
När vi rör oss vertikalt inom en given kolumn i det periodiska systemet kan vi återigen observera en tydlig periodisk trend i surhet. Detta illustreras bäst med halosyrorna och halogeniderna: basiskheten, liksom elektronegativiteten, ökar när vi rör oss uppåt i kolumnen.
Vertikal periodisk trend i surhet och basiskhet:

omvänt ökar surheten i halosyrorna när vi rör oss nedåt i kolumnen.
För att förstå denna trend ska vi återigen betrakta stabiliteten hos de konjugerade baserna. Eftersom fluor är det mest elektronegativa halogenelementet kan vi förvänta oss att fluorid också är den minst basiska halogenjonen. Men i själva verket är det den minst stabila, och den mest basiska! Det visar sig att när man rör sig vertikalt i det periodiska systemet trumfar atomens storlek dess elektronegativitet när det gäller basiskhet. Atomradien för jod är ungefär dubbelt så stor som för fluor, så i en jodidjon sprids den negativa laddningen ut över en betydligt större volym:

Detta illustrerar ett grundläggande begrepp inom den organiska kemin:
Elektrostatiska laddningar, oavsett om de är positiva eller negativa, är mer stabila när de ”sprids ut” över ett större område.
Vi kommer att se denna idé uttryckas om och om igen under hela vår studie av organisk reaktivitet, i många olika sammanhang. För tillfället tillämpar vi begreppet endast på atomradiusens inflytande på basstyrkan. Eftersom fluorid är den minst stabila (mest basiska) av de halogenidkonjugerade baserna är HF den minst sura av halogensyrorna, endast något starkare än en karboxylsyra. HI, med en \(pK_a\) på cirka -9, är nästan lika stark som svavelsyra.
Mer viktigt för studiet av biologisk organisk kemi är att denna trend säger oss att tioler är surare än alkoholer. \(pK_a\) för tiolgruppen på cysteinens sidokedja är till exempel cirka 8,3, medan \(pK_a\) för alkoholgruppen på serinsidokedjan är i storleksordningen 17.
Håller du begreppet ”drivkraft” som introducerades i avsnitt 6.2? Kom ihåg att drivkraften för en reaktion vanligtvis baseras på två faktorer: relativ laddningsstabilitet och relativ total bindningsenergi. Låt oss se hur detta gäller för en enkel syra-basreaktion mellan saltsyra och fluoridjon:
\
Vi vet att HCl (\(pK_a\) -7) är en starkare syra än HF (\(pK_a\) 3.2), så jämvikten för reaktionen ligger på produktsidan: reaktionen är exergonisk och en ”drivkraft” driver reaktanten till produkten.
Vad förklarar denna drivkraft? Tänk först på laddningsfaktorn: som vi just lärt oss är kloridjonen (på produktsidan) stabilare än fluoridjonen (på reaktantsidan). Detta förklarar delvis drivkraften som går från reaktant till produkt i denna reaktion: vi går från en mindre stabil jon till en mer stabil jon.
Hur är det med den totala bindningsenergin, den andra faktorn i drivkraften? Om du konsulterar en tabell över bindningsenergier kommer du att se att H-F-bindningen på produktsidan är mer energirik (starkare) än H-Cl-bindningen på reaktantsidan: 570 kJ/mol mot 432 kJ/mol, respektive). Detta bidrar också till drivkraften: vi rör oss från en svagare (mindre stabil) bindning till en starkare (stabilare) bindning.