När du har fastställt att kärnan existerar kan du nu ta upp experimentella bevis för dess storlek, med utgångspunkt i Rutherford-experimentet.
Sammanfattning av lektionen
- Diskussion och exempel från arbetet: Kärnans storlek (15 minuter)
- Diskussion: Atomstorlek och kärnans storlek (10 minuter)
- Studentfrågor: Krafter och närmsta närmande (30 minuter)
- Diskussion: Krafter och närmsta närmande (30 minuter)
- Diskussion: Atomnummer och kärnans laddning (5 minuter)
- Diskussion: Diskussion: Den övre gränsen för kärnans storlek (30 minuter)
- Diskussion: Kärnans laddning och laddning (30 minuter)
- Diskussion: En gåta för en framtida lektion (5 minuter)
Diskussion och exempel: Kärnans storlek
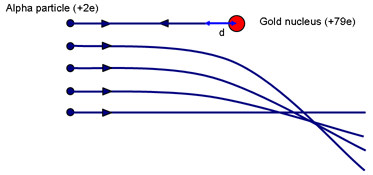
Du kan få en uppfattning om kärnans möjliga storlek genom att tänka på Rutherfords experiment. Fråga: Vilken påverkansparameter kommer att resultera i att en partikel kommer närmast kärnan? (En frontalkollision med p = 0.)
Principen om energins bevarande används för att beräkna avståndet för närmsta närmande som ett mått på kärnans storlek. Att förstå beräkningen som följer beror på om eleverna har behandlat elektrisk potential och fält. Alternativt fungerar det som en bra repetition.
Episod 522-1: Alfapartikelspridning – närmsta avstånd (Word, 29 KB)
Episod 522-2: Närmsta avstånd (Word, 107 KB)
När α:et tillfälligt sätts i vila (efter att ha klättrat så långt det kan uppför den elektrostatiska kullen) kommer arbete att ha utförts mot den repulsiva kraften från kärnan. α:s rörelseenergi lagras i fältet runt kärnan. När hastigheten är noll är nu all energi lagrad i fältet.
Om α stannar momentant när den befinner sig på ett avstånd d från (centrum för) kärnan med laddningen Ze är energin i fältet:
Eα = 14πε0 2e Zed
Detta är lika med α-partikelns ursprungliga kinetiska energi. Rutherford använde en α-källa som han fick av Madame Curie. α-energin var ~ 7,7 MeV.
För guld är Z = 79. Lösningen ger d ~ 3 × 10-14 m. Jämför detta med guldatomernas diameter ~ 3 × 10-10 m. En atomkärna är alltså minst 10 000 gånger mindre än en atom. Det är viktigt att betona att denna beräkning ger en övre gräns för storleken på guldkärnan; vi kan inte säga att alfapartikeln rör vid kärnan; ett energirikare α skulle kunna komma ännu närmare.
En atom är mestadels tom (vilket är anledningen till att de flesta as gick rakt igenom – eventuella elektroner skulle knappast hindra det relativt massiva α med hög hastighet).
Diskussion: Atom- och kärnstorlek
Beordra eleverna att föreslå en skalenlig modell av atomkärnan. Till exempel: Om en atomkärna var 1 mm i diameter skulle en atom vara 10 000 gånger större eller 10 m i diameter. Välj en lämplig plats för en 1 mm stor atomkärna (ett litet kullager eller en kula av Blu-tac). Gå 5 m (fem stora steg) fram till atomens kant där elektronerna finns. Observera att läroboksdiagrammen av en atom med en atomkärna inte är ritade i skala.
Förstärk en korrekt bild genom att låta en elev ställa sig upp som en atomkärna, uppskatta sin omkrets (40 cm?) och fråga var en annan elev skulle ha ställt sig för att vara vid atomens kant. 104 × 40 cm = 4000 m}, så radien för denna atom är 2 km! Kontrollera med en lokal karta för att hitta en namngiven plats som eleverna känner igen och som ligger 2 km bort.
Fortsatt förstärkning: I ett fast ämne där atomerna är tätt packade är avståndet mellan intilliggande atomkärnor ~ storleken på en atom, dvs. motsvarande två elever som står 4 km ifrån varandra!
Det är alltså ganska otroligt att någon överhuvudtaget träffar en atomkärna. Båda är ungefär lika stora. Tvärsnittsarea som presenteras av en atomkärna ~radius2, så ~1 × 10-28 m2}.
Fråga: Hur skulle du förvänta dig att antalet reflekterade som beror på tjockleken på metallfolien som innehåller målkärnorna? (Föreställ dig guldatomerna i lager, chansen för en avböjning ökar med tjockleken, men absorption på vägen in eller ut ur den allt tjockare folien kommer så småningom att förhindra en ytterligare ökning av antalet reflekterade och detekterade.
Det är till stor hjälp om eleverna kan komma ihåg följande storleksordningar:
Atomkärnans radie ~ 10 -14m
Atomens radie ~ 10 -10m
Elärarfrågor: Krafter och närmsta närmande
Episod 522-3: Rutherfordspridning: Krafternas riktning (Word, 82 KB)
Episod 522-4: Rutherfordspridning: Energi och närmsta närmande (Word, 83 KB)
Diskussion: Rutherford använde sina data för att hitta laddningen hos guldkärnan. Ytterligare experiment för att hitta laddningen hos Cu-, Ag- och Pt-folier gav:
| Atomnummer | Ett spridningsförsök | |
| Cu | 29 | 29.3 × e |
| Ag | 47 | 46.3 × e |
| PT | 78 | 77,4 × e |
Den elektriska laddningen på en atomkärna ges alltså av atomnumret × e, dvs. Z e. Med ett undantag (väte, H-1) är Z alltid mindre än atommassetalet. Vad förklarar då skillnaden? Atomen måste vara elektriskt neutral. Rutherford föreslog neutronen.
Diskussion: Rutherfords analys ger en övre gräns för kärnans storlek (d ~ 1 α partikelenergi). Den storlek man mäter beror på energin hos den α-partikel man använder. Vi behöver alltså ett annat tillvägagångssätt för att hitta storleken på en guldkärna. Kan du komma på en bättre partikel för att undersöka storleken på en atomkärna? (Neutronen – eftersom den är oladdad kommer den närmare.)
En annan teknik är djup inelastisk spridning av elektroner. Hänvisa tillbaka om du redan har behandlat partiklarnas vågnatur (de Broglie-vågor λ = hp), eller så kan detta ämne läggas in här om så önskas. Elektrondiffraktionsapparaten har en grundläggande likhet med en partikelspridning. Elektronerna skjuts mot en tunn film – i det här fallet av grafit.
Rutherford hade turen att de Broglie-våglängden för α-partiklarna (som han inte kände till) var ganska liten, och att coulomb-avstötningen stannar upp när man kommer för nära – annars skulle diffraktionseffekter ha förvirrat data! (Prova beräkningen om du redan har behandlat λ = hp.)
Episod 506-2: Tolkning av elektrondiffraktionsmönster (Word, 30 KB)
Episod 522-5: Deep inelastic scattering (Word, 56 KB)
Episode 522-6: Elektroner mäter kärnornas storlek (Word, 42 KB)
Diskussion: En gåta för en framtida lektion
Det finns ett grundläggande problem med Rutherfords modell. Fråga din klass: Hur kan en atom med en central kärna vara stabil – varför kollapsar den inte? Enligt den klassiska elektrodynamiken borde elektronerna avge strålning när de kretsar runt och spiralera inåt.
(Det är bra att lämna en klass med en gåta för en framtida lektion.)