24th Annual Glaucoma Report
Följ länkarna nedan för att läsa andra artiklar från den årliga uppdateringen om glaukom:
Glaucoma Care with Laser Precision
MIGS Madness: An Atlas of Options
Comanaging Invasive Glaucoma Surgeries
Glaucoma: Lifestyles of the Antioxidant Rich and Famous (Earn 2 CE Credits)
Experter har ännu inte nått konsensus om en universellt accepterad etiologi för glaukom. De är dock överens om detta: att sänka det intraokulära trycket (IOP) är den enda modifierbara riskfaktorn för att bromsa utvecklingen. Topisk läkemedelsbehandling är det traditionella förstahandsalternativet, och alternativen är rikare än någonsin.
Denna artikel, del tre i vår serie Take Charge of Glaucoma Series, utforskar de många mediciner som OD:s kan använda, med råd om när de ska använda vilken terapi för vilka patienter.
Från början Autonomics
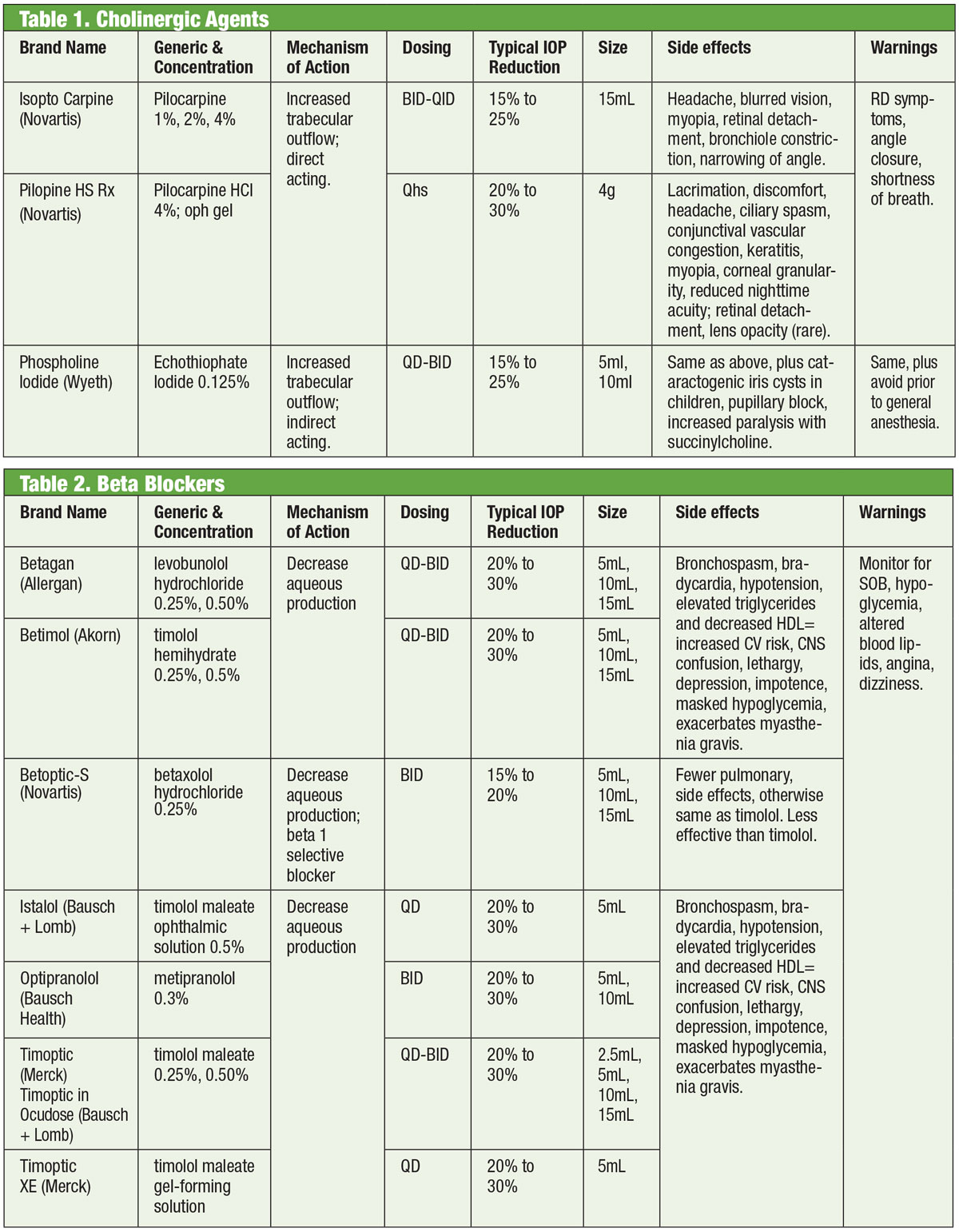
Läkemedel som verkar på det autonoma nervsystemet (dvs, kolinergika och adrenergika) har utgjort en grund för glaukombehandling sedan 1800-talet.1,2 Kolinergika inducerar miosis, vilket sträcker ut och stimulerar det trabekulära meshwork (TM) för att öka vattenutflödet dit och till Schlemm’s kanal.3 Medlemmar av denna klass inkluderar pilokarpin, karbachol, fysostigmin, neostigmin och ecothiophate. Av dessa är det bara pilo som fortfarande används rutinmässigt. Behandlingen uppvisar ett dosrelaterat svar med en minskning av IOP på cirka 20 % när den förskrivs QID.4
Take Charge of Glaucoma
Följ länkarna nedan för att läsa andra artiklar från vår fyrdelade glaukomserie:
Del ett: Glaucoma: Del två: Förbered din diagnostiska verktygslåda
Del fyra: Glaukom: En korståg i primärvården
Del fyra: En ny diagnostisk verktygslåda
: Play a Part in Postoperative Glaucoma Care
Tyvärr är kolinerga läkemedel effektiva, men användningen av kolinerga läkemedel är begränsad på grund av dess okulära och systemiska biverkningar. Dessa inkluderar ciliarmuskelspasm (med tillhörande huvudvärk och inducerad myopi), mios, hornhinnetoxicitet, rodnad, uveit, möjlig kataraktbildning, andningsdepression och gastrointestinal ohälsa. Vidare har nyare läkemedel större IOP-sänkande effekt, vilket gör att kolinerga läkemedel är reserverade för specifika fall där den miotiska effekten kan ha en extra fördel, t.ex. akut vinkelstängning.
Adrenerga agonister påverkar å andra sidan alfa- eller beta-adrenerga receptorer (eller båda om de är icke-selektiva). Epinefrin, det primära icke-selektiva medlet, minskar IOP genom att först minska produktionen av kammarvatten och sedan öka utflödet genom TM.5 Tyvärr har det begränsad tillämpning på grund av betydande systemiska biverkningar. Dipivefrin, en prodrug av epinefrin som utvecklades på 1970-talet, gör det möjligt att använda mycket lägre koncentrationer av modersubstansen, med färre systemiska effekter.6 Icke-selektiva adrenergika ser minimal användning idag utom i fall där andra läkemedel kan vara kontraindicerade.
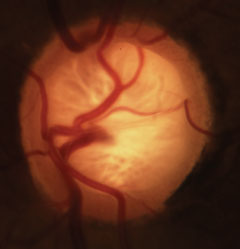
Glaukomatös kupning med karakteristisk förlust av neuroretinala randen, lamina och förändring av vaskulaturen. Klicka på bilden för att förstora den.
Beta-blockerare
Adrenerga antagonister, eller beta (β)-blockerare, hämmar kammarvattenproduktionen och utgör den standard med vilken nya läkemedel jämförs. Specifikt minskar β-blockerare ultrafiltrering, vilket begränsar tillgången på kammarvattensubstrat som är tillgängligt för överföring till bakre kammaren.1,7,8 Dessa läkemedel kan vara icke-selektiva, vilket innebär att de hämmar båda isoformerna av de β-adrenerga receptorerna (β1 och β2), eller kardioselektiva, som har mycket större affinitet för β1-receptorn. β2 är ögats dominerande adrenoreceptor, så icke-selektiva medel kommer att ha större effekt på IOP-kontrollen.9,10
Topiska β-blockerare inkluderar timolol, levobunolol, metipranolol, carteolol och betaxolol. Endast betaxolol är kardioselektiv – vilket gör den användbar vid vissa kontraindikationer, men den kan vara mindre effektiv när det gäller att minska IOP.11 β-blockerare minskar IOP med 20-30 % och kan doseras två gånger dagligen. De kan också doseras en gång dagligen, särskilt vid användning av gelbildande lösningar på grund av deras ökade okulära kontakttid.12,13 Adrenerga antagonister kan ha mindre effekt under sömnen, så man bör vara försiktig när β-blockerare doseras nära sänggåendet, särskilt om de förskrivs som ett engångsschema dagligen.14,15 Om patienterna tar systemiska β-blockerare minskar den okulära hypotensiva effekten av topiska β-blockerare, och andra klasser av topiska läkemedel kan övervägas.16
Och även om denna medicineringsklass för det mesta bör undvikas vid lung- eller hjärtsjukdomar kan det i utvalda fall vara rimligt att överväga behandling med betablockerare. Detta bör dock göras med samtycke från lämplig specialist (kardiologi eller lungmedicin).
Tabeller: Bruce Onofrey, OD, RPh. Klicka på bilden för att förstora den.
Generellt sett bör dock användning av β-blockerare undvikas hos personer med atrioventrikulärt block, sinusbradykardi och obstruktiv lungsjukdom.17
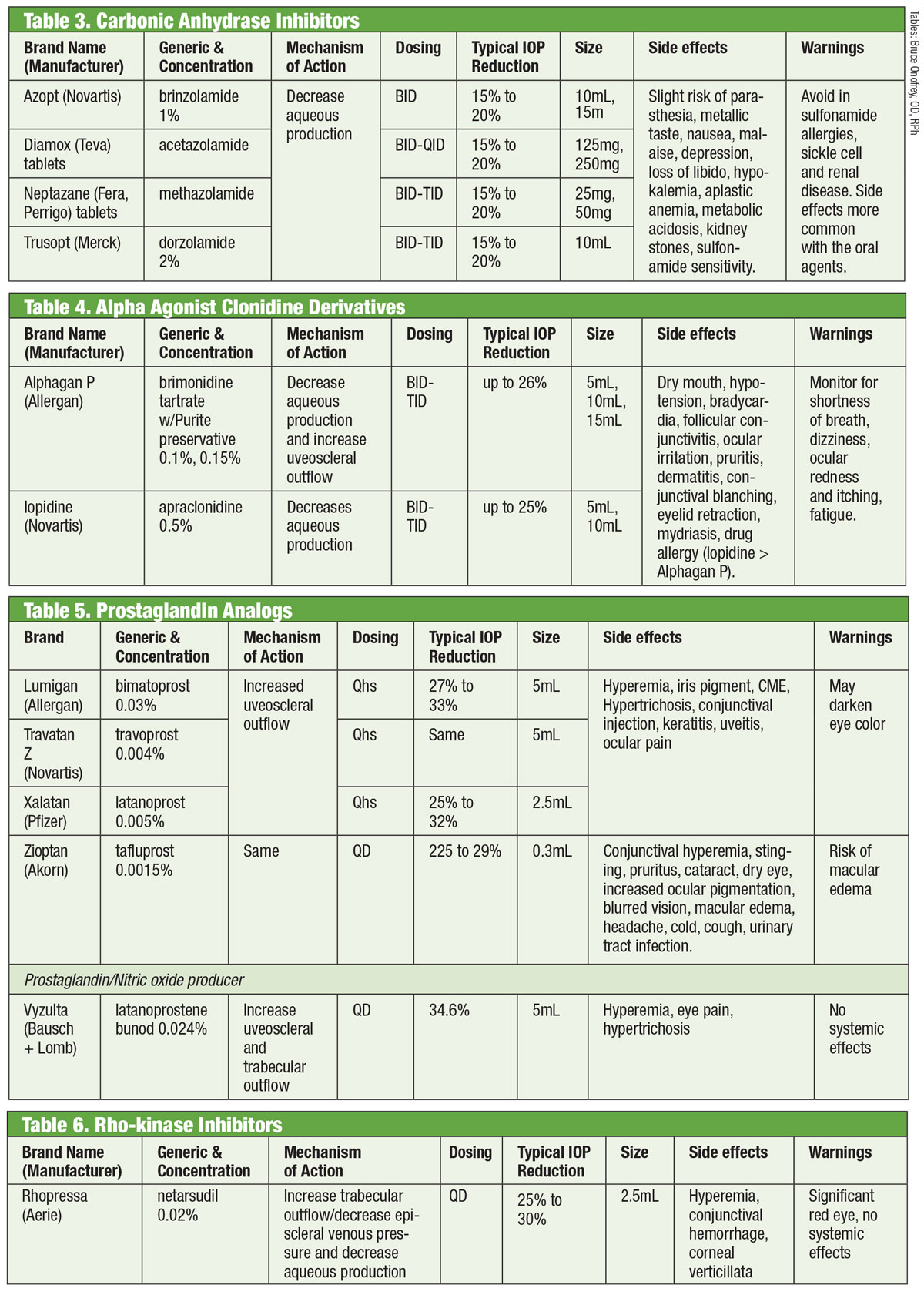
Karbonanhydrashämmare
Forskare har erkänt förmågan hos orala karbonanhydrashämmare (CAI) att sänka IOP sedan 1950-talet.18 De åstadkommer detta genom att undertrycka produktionen av vatten.18 Systemiska biverkningar (t.ex. trötthet, gastrointestinala störningar och parestesi) begränsar dock deras kroniska användning vid glaukom.18 Orala CAI används fortfarande i de fall då topiska CAI orsakar överkänslighet eller när användningen av droppar är utesluten, samt vid akut vinkelstängning.18 Försök att formulera en topisk variant lyckades med introduktionen av dorzolamid i mitten av 1990-talet och, kort därefter, brinzolamid.19
Det finns minst sju olika isoenzymer av karbonanhydras (CA), där CA-II i ciliärprocesserna främst är involverad i vattenproduktionen.18 Både dorzolamid och brinzolamid är potenta hämmare av detta isoenzym, men de har flera kliniskt relevanta skillnader. Dorzolamid har till exempel ett pH på 5,6 medan brinzolamid har ett pH på 7,5. Dessutom finns brinzolamid som suspension. Detta är bara några av de egenskaper som kan förklara produkternas individuella biverkningar, som kan innefatta stickande i fallet dorzolamid och suddig syn i fallet brinzolamid.19
Tyvärr är läkemedlen FDA-märkta för TID-dosering, men vissa behandlare väljer BID-administrering. För brinzolamid rapporterar fas III-studier kliniskt likvärdiga IOP-sänkningar med antingen BID- eller TID-regimer.20 Andra rapporterar inga statistiskt signifikanta skillnader mellan BID- eller TID-dosering med dorzolamid.18 Alternativt förespråkar andra TID-dosering för monoterapi och BID-dosering när det används som tilläggsbehandling.21
Tabeller: Bruce Onofrey, OD, RPh. Klicka på bilden för att förstora.
Alpha-agonister
Clonidin var den tidigaste alfa-agonisten (AA) som var effektiv för att sänka IOP. Även i aktuell form gav den dock upphov till djupgående systemiska biverkningar i form av bradykardi, sedering och hypotoni.22 Apraklonidins amidgruppsubstitution minskade penetreringen av blod-hjärnbarriären och därmed biverkningarna. Tyvärr begränsar dess minskade effekt med tiden och en ökad förekomst av okulär allergi det till kortvarig användning.
Brimonidin, som introducerades 1997, är en potent AA med 32 gånger större selektivitet för β2-adrenoreceptorer än apraklonidin.22 Den sänker IOP genom en dubbel mekanism som minskar produktionen av kammarvatten och ökar det uveosklerala utflödet.23 Liksom sin föregångare har den en anmärkningsvärd allergifrekvens (upp till 20 %), som kan inträffa upp till åtta månader efter behandlingsstart.22 Tre formuleringar har utvecklats, var och en med liknande effekt: 0,2 % med bensalkoniumklorid (BAK) samt 0,15 % och 0,1 % med konserveringsmedlet Purite.24 Allergan har sedan dess avbrutit den BAK-konserverade formuleringen.
The Straight Dope
Medicinsk marijuana har varit en stor nyhet på senare tid, tack vare ett antal lagändringar i USA. Även om det har undersökts som en metod för att sänka IOP sedan 1970-talet har utredare endast funnit att det kan sänka IOP under korta perioder. Detta, tillsammans med dess ganska kraftiga biverkningsprofil, gör den till en dålig kandidat för behandling. Forskningen säger dock att det kan ha en roll att spela för ”glaukompatienter i slutskedet som har misslyckats med maximal medicinsk behandling och kirurgi eller som är dåliga kirurgiska kandidater.”
Sun X, Xu C, Chadha N,et al. Marijuana for glaucoma: a recipe for disaster or treatment? Yale J Biol Med. 2015 Sep; 88(3): 265-9.
Tyvärr korrelerar biverkningarna oftast med prostaglandinanvändning, men litteraturen visar brimonidininducerad främre uveit.25 Varaktigheten varierade från sju dagar till fem år med ett medelvärde på nästan 20 månader.
Prostaglandinanaloger
Dessa ger den mest robusta IOP-sänkningen av alla droppar genom att öka det uveosklerala vattenutflödet. Prostaglandinanaloger (PGA) binder till receptorer i ciliarkroppen och inducerar relaxation av glatt muskulatur och förändrar den extracellulära matrisen i ciliarmuskeln för att öka vattenutflödet genom uveosklerala vägar.26 PGAs doseras en gång per dag, vanligen vid sänggåendet, och ger en IOP-sänkning på 30-35 %; alternativen inkluderar latanoprost, bimatoprost, travoprost och tafluprost (levereras i en singeldos, konserveringsmedelsfritt alternativ).26 Den vanligaste biverkningen av PGAs är konjunktival hyperemi, ofta under de första veckorna efter behandlingsstart.26 Okulär irritation, exacerbation av befintliga inflammatoriska tillstånd (makulaödem, irit), atrofi av periorbitala fettkuddar, pigmentering av periokulär hud, ögonfransar och iris samt hypertrikos kan också ses.26
En ny variant i kategorin prostaglandinanaloger är latanoprosten bunod 0,024 %. Denna förening har en dubbel mekanism: ökar det uveosklerala utflödet och förbättrar utflödet från trabekelverket genom påverkan av kväveoxid.27 Ögat bryter ner latanoprosten bunod två gånger för att ge de aktiva komponenterna latanoprostsyra och kväveoxid.28 Den sistnämnda påverkar en signalväg som slappnar av kontraktila komponenter i TM, vilket ökar utflödet.28 Den ytterligare effekten sänker IOP >1 mm Hg jämfört med enbart latanoprost över flera tidpunkter, med en total IOP-sänkning som varierar från 7,5 mm Hg till 9,1 mm Hg. Biverkningar med latanoprosten bunod var jämförbara med dem av enbart latanoprost, med möjligen mindre periokulär pigmentering och hypertrikos, enligt undersökarna.28,29
ROCK-hämmare
I ett normalt öga är den huvudsakliga dräneringsvägen för kammarvätskan TM. Motståndet mot kammarvattnet genom denna struktur ökar hos patienter med glaukom, vilket höjer IOP.30 Fram till nyligen har glaukomläkemedel inte lyckats rikta sig mot denna struktur. Detta ändrades 2017 med introduktionen av Rhopressa (netarsudil 0,02 %, Aerie), en rho-kinashämmare (ROCK).
Tabell: Klicka på bilden för att förstora.
Rho-kinas uttrycks i stor utsträckning i många vävnader, inklusive TM, där det främjar sammansättningen av aktinstressfibrer och reglerar cellkontraktion.31 ROCK-hämmare ökar vattenutflödet genom att minska den aktin- och myosindrivna cellkontraktionen och minska produktionen av extracellulärt matrisprotein.32 Rhopressa har också en hämmande verkan mot noradrenalinstransportören (NET), vilket gör det till en ROCK/NET-hämmare. NET-mekanismen kan vara ett resultat av minskat blodflöde till ciliarkroppen genom noradrenalininducerad vasokonstriktion, vilket resulterar i minskad vattenproduktion.33 Dessutom minskar netarsudil även det episklerala venösa trycket (EVP), vilket ger flera vägar till IOP-sänkning.32 Den vanligaste okulära biverkningen är okulär hyperemi (ungefär hälften av de behandlade patienterna), som för det mesta är mild, övergående och självupplösande.32
Och det är värt att notera att rho i sig självt spelar en viktig roll i axontillväxt och styrning, liksom i regleringen av neuronernas överlevnad och död.34 Forskare fann att efter en skada på synnerven minskade topisk applicering av netarsudil den retinala gangliecellsdöden och främjade axonregenerering.34
Geting in the Mix
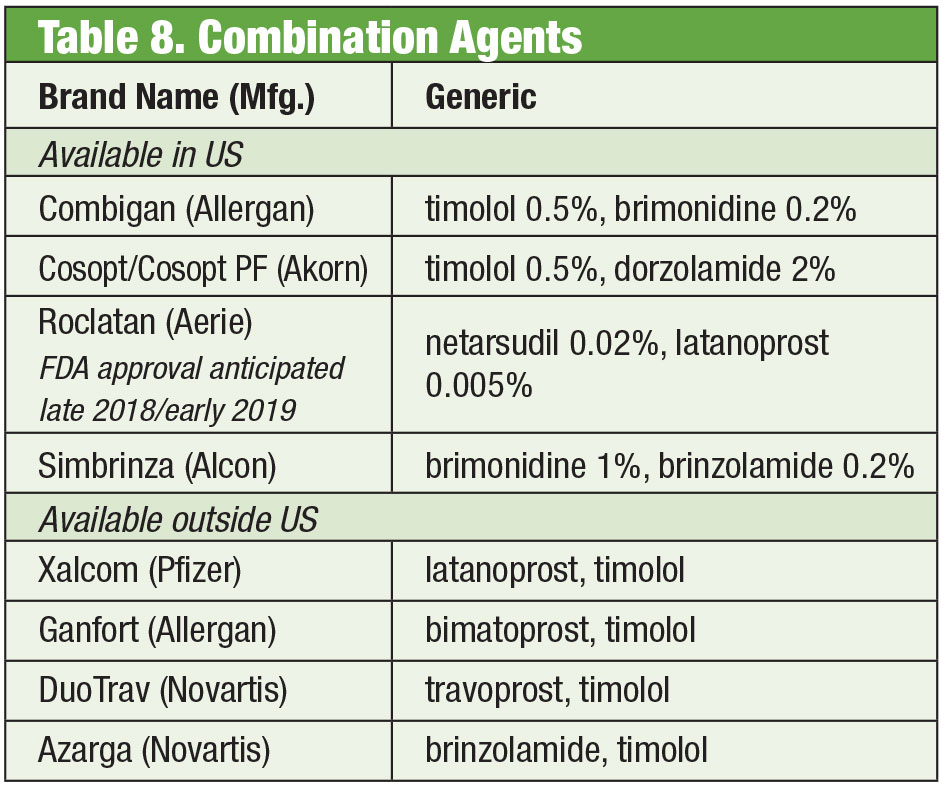
Ibland behöver patienter mer än vad produkter som finns på hyllan erbjuder. Patientens känslighet eller toxicitet på ögonytan till följd av kronisk användning av konserveringsmedel kan leda till att man söker efter alternativ. Vissa sammansatta läkemedel finns tillgängliga utan konserveringsmedel. Om följsamhet är ett problem kan dessa blandningar innehålla upp till fyra läkemedel i en enda flaska. Dessutom har många fasta kombinationer använts effektivt utanför USA, men är för närvarande inte godkända av FDA; sammansättningar ger amerikanska läkare tillgång till dessa regimer. Om kostnaden är en begränsning kan sammansättning vara en extra fördel. Även om den sammansatta produkten ofta inte täcks av patientens försäkring, kan priset för en eller två kombinationsprodukter vara mer kostnadseffektivt än priset för flera alternativ med enstaka läkemedel, även generiska formuleringar. Två sammansatta apotek erbjuder flera förinställda variationer: Simple Drops från Imprimis Pharmaceuticals och Omni prodcut line från Ocular Science. Ytterligare anpassningar är också möjliga från var och en av dem.
Och även om de enskilda medlen är FDA-godkända, är vissa kombinationer kanske inte det. Det är upp till behandlaren att väga riskerna och fördelarna med att följa reglerna.
Sammansatta glaukomprodukter:
Simple Drops (Imprimis Pharmaceuticals)
Alla tillgängliga är fria från konserveringsmedel.
– Tim-Lat PF (timolol/latanoprost)
– Brim-Dor PF (brimonidin/dorzolamid)
– Tim-Brim-Dor PF (timolol/brimonidin/dorzolamid)
– Tim-Dor-Lat PF (timolol/dorzolamid/latanoprost)
– Tim-Brim-Dor-Lat PF (timolol/brinzolamid/dorzolamid/latanoprost)
– Dor-Tim (dorzolamid/timolol)
– Dorzolamid PF
– Latanoprost PF
Omni Drops (Ocular Science)
Innehåller bensalkoniumklorid, men i lägre koncentrationer (0.001 %) än vanliga generiska formuleringar (0,002 %).
– Timolol/latanoprost
– Timolol/brimonidin/dorzolamid (AM-formel)*
– Timolol/brimonidin/dorzolamid/latanoprost (PM-formel)*
* Avsedda att användas tillsammans, där AM-versionen saknar prostaglandinet, som vanligen doseras endast en gång per dag.
Fixerade kombinationsprodukter
Trots effektiviteten hos dessa enskilda produkter är det vanligt att många glaukompatienter behöver flera behandlingar för att kontrollera sitt tillstånd35 . När dubbelbehandling är nödvändig kan det vara bäst att erbjuda samma dispenser, vilket främjar ökad följsamhet och minskar påverkan på ögonytan från toxicitet.36 Timolol är tillsammans med brimonidin (som Combigan, Allergan) och dorzolamid (som Cosopt, Akorn), båda doserade två gånger per dag, med ett konserveringsmedelsfritt alternativ tillgängligt för timolol-dorzolamidprodukten. En annan kombination två gånger dagligen – Simbrinza – kombinerar brimonidin och dorzolamid. De fasta kombinationerna visar god effekt både som primärbehandling och som tillägg till PGA. Biverkningarna är jämförbara med de enskilda komponenterna.
Tillhörighet/Patientuppfattning
Och även om beslutet att rekommendera behandling kan vara komplext och beror på många faktorer, så måste man, när läkaren och patienten väl är överens om att påbörja behandlingen, erkänna vissa bakgrundsfakta och använda sig av grundläggande principer.
Klicka på bilden för att förstora den.
Visusfältsprogression och sjukdomens svårighetsgrad är kopplade till dålig följsamhet.37 Patienter med kroniska medicinska tillstånd använder i genomsnitt 30 till 70 % av sina föreskrivna läkemedelsdoser, och 50 % avbryter sin medicinering inom de första månaderna av behandlingen, enligt en studie.38 Följsamheten till glaukommedicinering är lika dålig som för andra kroniska tillstånd.38 Följaktligen kan det finnas ett gap mellan effektivitet och ändamålsenlighet där, även om det har bevisats att topiska läkemedel är effektiva i stora kliniska studier, de i praktiken kan vara ineffektiva på grund av att patienterna inte följer reglerna.39
De viktigaste faktorerna som bidrar till dålig följsamhet vid glaukom är bl.a. läkemedlens biverkningsprofil, behandlingens kostnad, patientutbildning och relationen mellan läkare och patient.40 Dessutom kan sjukdomen vara asymtomatisk förrän sent i förloppet, med bristande medvetenhet om synfältsförlust.41
Och nu till något helt annat
Läkemedel har varit ryggraden i behandlingen av glaukom i mer än ett sekel, och utvecklingen av nya läkemedel fortsätter med oförminskad styrka. Men vissa forskare letar efter alternativ bortom flaskan. Glasögon som är inbäddade i en elektromagnetisk spole, i kombination med en kontaktlins som innehåller ett spår av guld, kan en dag hjälpa till att sänka IOP. Kombinationen har utvecklats av ett företag som heter Bionode och är utformad för att generera en elektrisk ström som strömmar genom ciliarmusklerna för att stimulera den naturliga dräneringsvägen och sänka IOP.
American Academy of Ophthalmology. Glasögon kan en dag behandla glaukom. www.aao.org/eye-health/news/eyeglasses-for-glaucoma-treatment. Accessed July 3, 2018.
Ett ytterligare hinder för följsamhet är svårigheter med droppinstillation och doseringsschema.42 Faktum är att upp till 80 % av patienterna kontaminerar dropparna genom att röra vid ansiktet, upp till 61 % instillerar inte exakt en droppe och, vilket är mest kritiskt, upp till 37 % missar ögat med droppen.43 Behandlaren bör aldrig anta att patienten är kunnig med droppinstillation. Innan du inleder droppbehandlingen bör du lära patienten hur han/hon ska instifta dropparna på rätt sätt och låta honom/hon demonstrera instillationen innan han/hon lämnar mottagningen. Detta kan effektivt delegeras till en optikertekniker och förstärkas med ett utbildningsmaterial om tekniken (utskrivbar PDF-film på www.glaucoma.org/treatment/eyedrop-tips.php) och med hjälp av videor, t.ex. den som producerats av Glaucoma Research Foundation (www.glaucoma.org/treatment/putting-in-eye-drops.php).
Om patienten har betydande svårigheter att instifta ögondroppar kan ett mekaniskt doseringshjälpmedel öka sannolikheten för att lyckas. Följsamheten till rätt doseringsschema förbättras med hjälp av automatiserade telekommunikationsbaserade påminnelser, påminnelseappar för smartphones och surfplattor.44,45 En kombination av utbildning på kontoret, målsättning, förenklad droppregim och teknik bör anammas för att förbättra följsamheten.46 Att ta itu med kända hinder för följsamhet till medicineringen är ett nödvändigt första steg mot framgång.
Sänka trycket
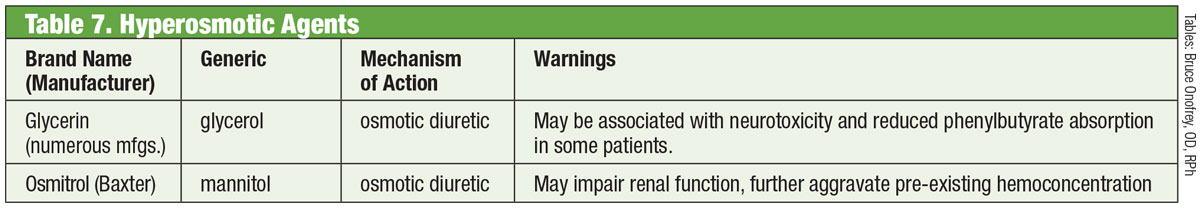
IOP är den enda kända modifierbara riskfaktorn för glaukom och att sänka trycket har onekligen visat sig minska risken för sjukdomsprogression.47,48 Att sänka IOP på ett effektivt sätt blir därför målet när man behandlar patienter med glaukom. Efter att sjukdomen har klassificerats korrekt sätts vanligtvis ett terapeutiskt mål upp. I USA föreslås att man använder ett IOP-målintervall som klinikern anser kommer att minska patientens livstidsrisk för blindhet och samtidigt minimera den behandlingsrelaterade bördan.49-52
Och även om flera metoder kan hjälpa till att fastställa ett första IOP-mål (tröskel IOP, beräknat, en storlek passar alla) är den enklaste och mest evidensbaserade metoden att sänka IOP med en viss procentsats från baslinjens högsta dygns IOP vid vilken skada på synnerven uppstår. IOP är dynamiskt och uppvisar kortsiktiga och långsiktiga fluktuationer, vilket gör att den nuvarande tonometrin inte är helt reproducerbar. Det rekommenderas därför att klinikern får flera IOP-avläsningar vid olika tider på dygnet innan behandlingen inleds för att försöka fastställa en dygnstopp för IOP som kan ligga till grund för målintervallet.53-55 Det är dock osannolikt att en verklig topp någonsin kommer att kunna fastställas om man inte får flera IOP-kurvor för dygnet runt. I slutändan måste klinikern bedöma hur framgångsrik behandlingen är genom att minska progressionstakten vid strukturella och funktionella tester.48,56,57
De rekommenderade procentuella målminskningarna av IOP varierar mellan 20 % och 50 % beroende på tillståndet (t.ex, misstänkt glaukom, okulär hypertension, normalspänningsglaukom, högspänningsglaukom, glaukom med vinkelstängning) grundläggande sjukdomens svårighetsgrad och förväntad livslängd.58-61
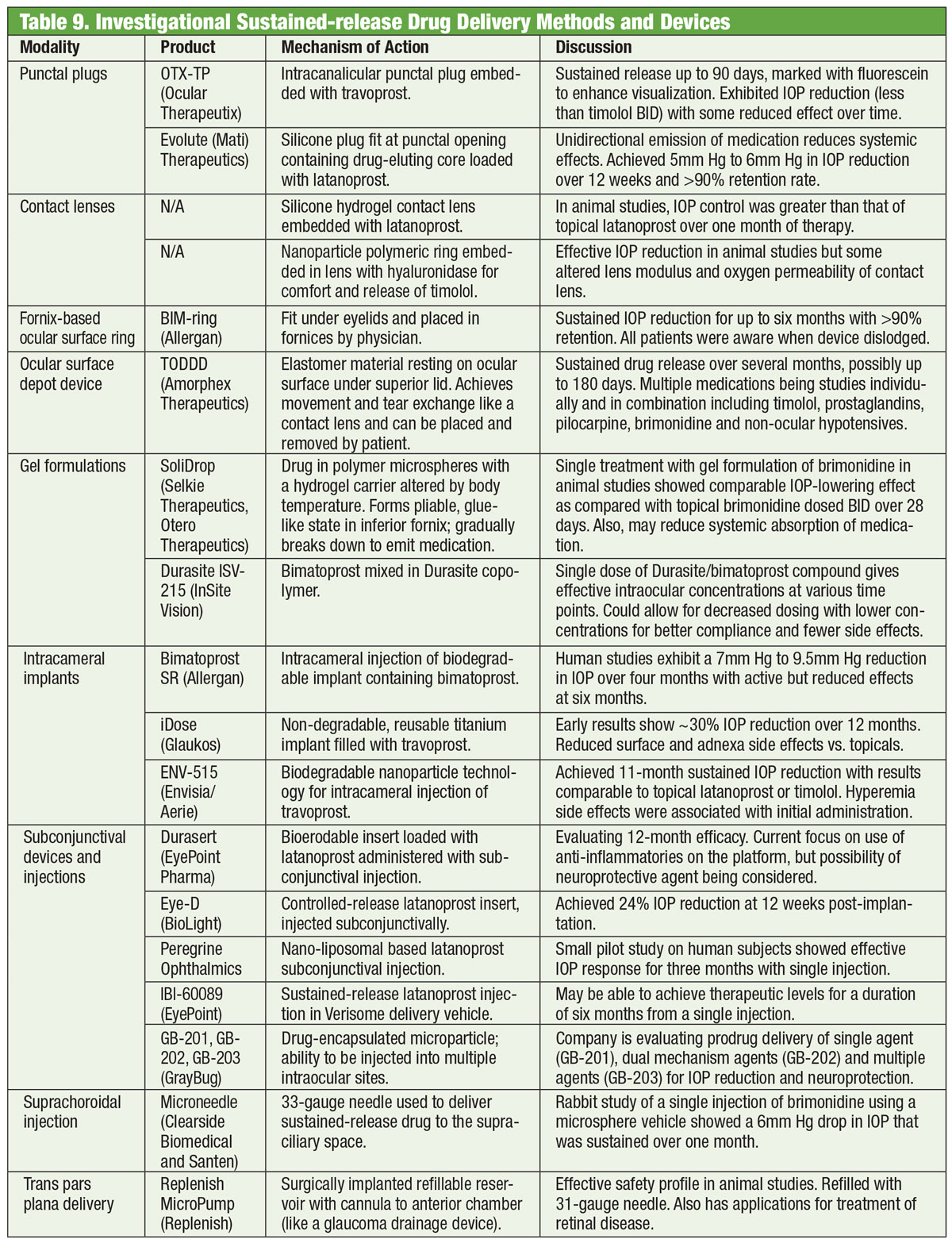
Tabell: Bruce Onofrey, OD, RPh. Klicka på bilden för att förstora.
För att komma igång
PGA:er är godkända som förstahandsbehandling i USA och är effektivare när det gäller att sänka IOP, har en relativt begränsad biverkningsprofil och doseras mindre ofta (en gång dagligen) än andra läkemedelsklasser.62,63
När ett specifikt medel väljs bör patienten ses igen inom högst fyra veckor för att mäta droppens effektivitet, för att avvärja eventuella biverkningar som kan uppstå, säkerställa patientens följsamhet och förstärka värdet av behandlingen.
Sluttningsvis kommer rätt utbildning och vaksam uppföljning med strukturella och funktionella tester att bidra till att minimera synförlusten.
Dr Dorkowski är klinisk samordnare för programmet för vårdhem/stödboende vid SCO.
Dr Williamson är handledare för praktikanter vid Memphis VA Medical Center.
Dr. Rixon är behandlare vid Memphis VA och är medlem i Optometric Glaucoma Society.
Dr Onofrey är författare till The Ocular Therapeutics Handbook.
1. Zimmerman TJ, William P. BogerIII. De beta-adrenerga blockerarna och behandlingen av glaukom. Surv Ophthalmol. 1979;23(6):347-62.
2. Realini T. A history of glaucoma pharmacology. Optom Vis Sci. 2011;88(1):36-8.
3. Erickson KA, Schroeder A. Direkta effekter av muskariniska medel på utflödesvägarna i mänskliga ögon. Invest Ophthalmol Vis Sci. 2000;41(7):1743-8.
4. Drance S, Nash P. Dosresponsen för humant intraokulärt tryck på pilokarpin. Can J Ophthalmol. 1971;6(1):9-13.
5. Sears M. Verkningsmekanismen för adrenerga läkemedel vid glaukom. Investig Opthalmology Vis Sci. 1966;5:115-9.
6. Mandell AI, Stentz F, Kitabchi AE. Dipivalyl epinefrin: en ny pro-drog vid behandling av glaukom. Ophthalmology. 1978;85(3):268-75.
7. Neufeld AH. Experimentella studier av timolols verkningsmekanism. Surv Ophthalmol. 1979;23(6):363-70.
8. Coakes RL, Brubaker RF. Timolols mekanism för att sänka det intraokulära trycket: I det normala ögat. Arch Ophthalmol. 1978;96(11):2045-8.
9. Trope GE, Clark B. Beta adrenerga receptorer i pigmenterade ciliära processer. Br J Ophthalmol. 1982;66:788-92.
10. Wax MB, Molinoff PB. Distribution och egenskaper hos beta-adrenerga receptorer i mänsklig iris-ciliarkropp. Invest Ophthalmol Vis Sci. 1987;28(3):420-30.
11. Allen RC, Hertzmark E, Walker AM, Epstein DL. En dubbelmaskerad jämförelse av betaxolol vs timolol vid behandling av öppenvinkelglaukom. Am J Ophthalmol. 1986;101(5):535-41.
12. Novack GD. Oftalmiska betablockerare sedan timolol. Surv Ophthalmol. 1987;31(5):307-27.
13. Soll DB. Utvärdering av timolol vid kroniskt öppenvinkelglaukom: En gång om dagen jämfört med två gånger om dagen. Arch Ophthalmol. 1980;98(12):2178-81.
14. Topper JE, Brubaker RF. Effekter av timolol, epinefrin och acetazolamid på vattenflödet under sömnen. Invest Ophthalmol Vis Sci. 1985;26(10):1315-9.
15. Krag S, Andersen HB, Sorensen T. Circadian intraocular pressure variation with beta-blockers. Acta Ophthalmol Scand. 1999;77(5):500-3.
16. Schuman JS. Effekter av systemisk behandling med betablockerare på effekt och säkerhet av topisk brimonidin och timolol. Brimonidinstudiegrupperna 1 och 2. Ophthalmology. 2000;107(6):1171-7.
17. Salim S, Shields MB. Glaukom och systemiska sjukdomar. Surv Ophthalmol. 2010;55(1):64-77.
18. Sugrue MF. Farmakologiska och okulära hypotensiva egenskaper hos topiska karbonanhydrashämmare. Prog Retin Eye Res. 2000;19(1):87-112.
19. Loftsson T, Jansook P, Stefansson E. Topisk läkemedelstillförsel till ögat: dorzolamid. Acta Ophthalmol. 2012;90(7):603-8.
20. Lester M. Brinzolamid oftalmisk suspension: en genomgång av dess farmakologi och användning vid behandling av öppenvinkelglaukom och okulär hypertension. Clin Ophthalmol. 2008;2(3):517-23.
21. Petounis A, Mylopoulos N, Kandarakis A, et al. Comparison of the additive intraocular pressure-lowering effect of latanoprost and dorzolamide when added to timolol in patients with open-angle glaucoma or ocular hypertension: a randomized, open-label, multicenter study in Greece. J Glaucoma. 2001;10(4):316-24.
22. Williams GC, Orengo-Nania S, Gross RL. Förekomst av brimonidinallergi hos patienter som tidigare varit allergiska mot apraklonidin. J Glaucoma. 2000;9(3):235-8.
23. Lee DA, Gornbein JA. Effektivitet och säkerhet hos brimonidin som tilläggsbehandling för patienter med förhöjt intraokulärt tryck i en stor, öppen samhällsstudie. J Glaucoma. 2001;10(3):220-6.
24. Cantor LB, Safyan E, Liu C-C, Batoosingh AL. Brimonidin-purit 0,1 % jämfört med brimonidin-purit 0,15 % två gånger dagligen vid glaukom eller okulär hypertension: en 12-månaders randomiserad studie. Curr Med Res Opin. 2008;24(7):2035-43.
25. Beltz J, Zamir E. Brimonidininducerad främre uveit. Ocul Immunol Inflamm. 2016;24(2):128-33.
26. Toris CB, Gabelt BT, Kaufman PL. Uppdatering av verkningsmekanismen för topiska prostaglandiner för minskning av intraokulärt tryck. Surv Ophthalmol. 2008;53 Suppl1:S107-20.
27. Liu JHK, Slight JR, Vittitow JL, Scassellati Sforzolini B, Weinreb RN. Effekt av latanoprosten bunod 0,024 % jämfört med timolol 0,5 % för att sänka det intraokulära trycket under 24 timmar. Am J Ophthalmol. 2016;169:249-57.
28. Kaufman PL. Latanoprosten bunod oftalmisk lösning 0,024 % för sänkning av IOP vid glaukom och okulär hypertension. Expert Opin Pharmacother. 2017;18(4):433-44.
29. Medeiros FA, Martin KR, Peace J, Scassellati Sforzolini B, Vittitow JL, Weinreb RN. Jämförelse av latanoprosten bunod 0,024 % och timololmaleat 0,5 % vid öppenvinkelglaukom eller okulär hypertension: LUNAR-studien. Am J Ophthalmol. 2016;168:250-9.
30. Abu-Hassan DW, Acott TS, Kelley MJ. Det trabekulära meshwork: En grundläggande genomgång av form och funktion. J Ocul Biol. 2014. fulltextarticles.avensonline.org/JOCB-2334-2838-02-0017. Tillgänglig den 29 juni 2018.
31. Sturdivant JM, Royalty SM, Lin C-W, et al. Discovery of the ROCK inhibitor netarsudil for the treatment of open-angle glaucoma. Bioorg Med Chem Lett. 2016;26(10):2475-80.
32. Serle JB, Katz LJ, McLaurin E, et al. Två kliniska fas 3-studier som jämför säkerhet och effekt av netarsudil med timolol hos patienter med förhöjt intraokulärt tryck: rho kinase elevated iop treatment trial 1 and 2 (ROCKET-1 och ROCKET-2). Am J Ophthalmol. 2018;186:116-27.
33. Lin C-W, Sherman B, Moore LA, et al. Discovery and preclinical development of netarsudil, a novel ocular hypotensive agent for the treatment of glaucoma. J Ocul Pharmacol Ther. 2018;34(1-2):40-51.
34. Shaw PX, Sang A, Wang Y, et al. Topisk administrering av en rock/net-hämmare främjar retinala gangliecellers överlevnad och axonregenerering efter skada på synnerven. Exp Eye Res. 2017;158:33-42.
35. Schmier JK, Hulme-Lowe CK, Covert DW. Mönster för tilläggsbehandling hos glaukompatienter som använder prostaglandinanaloger. Clin Ophthalmol. 2014;8:1097-104.
36. Fechtner BYRD, Khouri AS. Fasta kombinationer. Glaucoma Today. 2016;14(6)33-6.
37. Rossi G, Pasinetti G, Scudeller L, et al. Finns det ett samband mellan följsamhet och glaukomatös synfältsutveckling? Eur J Ophthalmol. 2011;21(4):410-4.
38. Friedman DS, Quigley HA, Gelb L, et al. Användning av uppgifter om apoteksfordringar för att studera följsamhet till glaukomläkemedel: metodik och resultat från Glaucoma Adherence and Persistency Study (GAPS). Investig Ophthalmol Vis Sci. 2007;48(11):5052-7.
39. Jampel HD, Chon BH, Stamper R, et al. Effekten av intraokulärt trycksänkande medicinering fastställd genom utfasning. JAMA Ophthalmol. 2014;132(4):390-5.
40. Susanna R, De Moraes CG, Cioffi GA, Ritch R. Varför blir människor (fortfarande) blinda av glaukom? Transl Vis Sci Technol. 2015;4(2):1.
41. Crabb DP. En syn på glaukom – ser vi det klart och tydligt? Eye. 2016;30(2):304-13.
42. Newman-Casey PA, Robin AL, Blachley T, et al. De vanligaste hindren för följsamhet till glaukommedicinering: En tvärsnittsundersökning. Ophthalmology. 2015;122(7):1308-16.
43. Davis SA, Sleath B, Carpenter DM, Blalock SJ, Muir KW, Budenz DL. Droppinstillation och glaukom. Curr Opin Ophthalmol. 2018;29(2):171-7.
44. Boland M, Chang DS, Frazier T, et al. Automatiserade telekommunikationsbaserade påminnelser och följsamhet med dosering av glaukomläkemedel en gång dagligen: Studien om automatiserad påminnelse om dosering. JAMA Ophthalmol. 2014;132(7):845-50.
45. Waisbourd M, Dhami H, Zhou C, et al. Wills eye glaucoma app: Patienters och deras vårdgivares intresse för en smartphone- och tablettbaserad glaukomapplikation. J Glaucoma. 2016;25(9):e787-e791.
46. Joseph A, Pasquale LR. Egenskaper som är förknippade med följsamhet till medicinsk behandling av glaukom och dess effekter på glaukomutfall: En evidensbaserad genomgång och potentiella strategier för att förbättra följsamheten. Semin Ophthalmol. 2017;32(1):86-90.
47. Clement CI, Bhartiya S, Shaarawy T. Nya perspektiv på det intraokulära måltrycket. Surv Ophthalmol. 2014;59(6):615-26.
48. Sit AJ, Pruet CM. Personalisering av det intraokulära trycket: Målinriktat intraokulärt tryck i samband med 24-timmars övervakning av det intraokulära trycket. Asia-Pacific J Ophthalmol. 2016;5(1):17-22.
49. Jampel HD. Måltryck vid behandling av glaukom. J Glaucoma. 1997;6(2):133-8.
50. Fingeret M. Vård av patienten med öppenvinkelglaukom. Am Optom Assoc. 2011;1:1-161.
51. Singh K, Shrivastava A. Tidig aggressiv sänkning av det intraokulära trycket, intraokulärt måltryck och ett nytt koncept för glaukomvård. Surv Ophthalmol. 2008;53(6 SUPPL.):33-8.
52. Prum Jr. BE, Rosenberg LF, Gedde SJ, et al. Primary open-angle glaucoma Preferred Practice Pattern guidelines. Ophthalmology. 2016;123(1):P41-P111.
53. Realini T, Weinreb RN, Wisniewski SR. Dagliga intraokulära tryckmönster kan inte upprepas på kort sikt hos friska individer. Ophthalmology. 2010;117(9):1700-4.
54. Florent Aptel, MD, PhDemail, Antoine Lesoin, MSc, Christophe Chiquet, MD, PhD, Nishal Aryal-Charles, MSc, Christian Noel, MD, Jean-Paul Romanet M. Long-term reproducibility of diurnal intraocular pressure patterns in patients with glaucoma. Ophthalmology. 2014:1998-2003.
55. Rotchford AP, Uppal S, Lakshmanan A, King AJ. Daglig variabilitet i intraokulärt tryck vid glaukom och okulär hypertension. Br J Ophthalmol. 2012;96(7):967-70.
56. Barkana Y, Anis S, Liebmann J, Tello C, Ritch R. Clinical utility of intraocular pressure monitoring outside of normal office hours in patients with glaucoma. Arch Ophthalmol. 2006;124(6):793-7.
57. Konstas AGP, Quaranta L, Mikropoulos DG, et al. Peak intraocular pressure and glaucomatous progression in primary open-angle glaucoma. J Ocul Pharmacol Ther. 2012;28(1):26-32.
58. Kass MA, Heuer DK, Higginbotham EJ, et al. The Ocular Hypertension Treatment Study: a randomized trial determines that topical ocular hypotensive medication delays or prevents the onset of primary open-angle glaucoma. Arch Ophthalmol. 2002;120(6):701-30.
59. Heijl A, Cristina Leske M, Bengtsson B, et al. Minskning av det intraokulära trycket och glaukomutveckling: Results from the Early Manifest Glaucoma Trial. Arch Ophthalmol. 2002 Oct;120(10):1268-79.
60. AGIS7. Den avancerade glaukominterventionsstudien (AGIS): Förhållandet mellan kontroll av intraokulärt tryck och försämring av synfältet. Am J Ophthalmol. 2010;130:429-440.
61. Musch DC, Gillespie BW, Lichter PR, et al. Progression av synfältet i studien Collaborative Initial Glaucoma Treatment Study. Effekten av behandling och andra utgångsfaktorer. Ophthalmology. 2009;116(2):200-207.e1.
62. Albert A. Latanoprost vid behandling av glaukom. Clin Ophthalmol. 2014;(8):1967-85.
63. Stein JD, Shekhawat N, Talwar N, Balkrishnan R. Impact of the introduction of generic latanoprost on glaucoma medication adherence. Ophthalmology. 2015;122(4):738-47.
64. Weinreb RN, Ong T, Sforzolini BS, et al. En randomiserad, kontrollerad jämförelse av latanoprosten bunod och latanoprost 0,005 % vid behandling av okulär hypertension och öppenvinkelglaukom: VOYAGER-studien. Br J Ophthalmol. 2015;99(6):738-45.