Och även om denguefeber en gång i tiden var en periodisk sjukdom som orsakade epidemier med långa intervaller, anses den idag vara den viktigaste myggburna virussjukdomen i världen. Varje år registreras cirka femtio till hundra miljoner fall av denguefeber i världen . En halv miljon av dessa fall leder till den allvarligaste formen av denguefeber som kallas dengue hemorragisk feber (DHF) . DHF är en sjukdom som främst drabbar barn under 15 år och kännetecknas av plötsligt insättande av feber, trombocytopeni och vaskulärt läckagesyndrom . DHF uppstår på grund av en infektion med dengueviruset, som tillhör familjen Flaviviridae . Viruset är icosahedra, omslutet, enkelsträngat, positivt sens-RNA . Den icosaedriska kärnan är fyrtio till femtio nanometer i diameter och innehåller C-proteinet som kapslar in virusgenomet . Kärnan omges av två virusproteiner, M och E, som utgör lipidhöljet . Infektionen orsakas av en av de fyra serotyperna av dengueviruset (DENV): DENV-1, DENV-2, DENV-3 och DENV-4 . Infektion med en av serotyperna ger inte immunitet mot infektion med de andra serotyperna .
Om en person som tidigare varit infekterad smittas på nytt har han eller hon en ökad risk att utveckla denguechocksyndrom (DSS) och DHF, vilket resulterar i försvagning och bristning av kärlsystemet och inre blödningar . Icke-neutraliserande antikroppar kan öka upptaget av viruset av celler som uttrycker Fc-receptorer, vilket möjliggör antikroppsberoende förstärkning av DHF . Olika arter av Aedesmyggor är vektorer för dengueviruset och överför viruset genom att bita en mänsklig värd . Aedes aegypti, en liten, svartvit, tropisk och subtropisk mygga som finns i Centralamerika, Latinamerika, Sydostasien och västra Stilla havet, är den viktigaste vektorn .
Epidemiologi
I dag betraktas DHF internationellt sett som den mest betydande myggburna virussjukdomen. Den är endemisk i mer än 100 länder världen över, särskilt i tropiska och subtropiska regioner . I Förenta staterna kan den DHF-orsakande Aedes aegyptispecies säsongsmässigt påträffas i Louisiana, södra Florida, New Mexico, Arizona, Texas, Georgia, Alabama, Mississippi, North och South Carolina, Kentucky, Oklahoma och Tennessee . Under de senaste 50 åren har förekomsten av denguefeber ökat 30 gånger .
Enligt Världshälsoorganisationen (WHO) beräknas 50 till 100 miljoner infektioner av denguefeber inträffa årligen. Av dessa fall utvecklas 500 000 till DHF, vilket leder till 22 000 dödsfall, främst bland barn. Enligt officiella uppgifter till WHO översteg antalet fall av denguefeber i Nord- och Sydamerika, Sydostasien och västra Stillahavsområdet 1,2 miljoner år 2008 och över 3 miljoner år 2013. Under 2013 rapporterades 2,35 miljoner fall av denguefeber enbart i Nord- och Sydamerika, varav 37 687 fall av DHF . Efter den första kända epidemin av DHF 1953-1954 i Filippinerna fortsatte sjukdomen att spridas i hela Sydostasien .
Under 1950-, 1960- och större delen av 1970-talet var dengueepidemier sällsynta i större delen av Syd- och Centralamerika eftersom den primära myggvektorn, Aedes aegypti, utrotades. När utrotningen upphörde började dock Aedes aegypti återinvadera dessa regioner. År 1997 fick Aedes aegypti och dengueviruset åter en världsomspännande spridning (figurerna 1 och 2).Enligt WHO finns det nu över 2,5 miljarder människor som lever i områden där dengue/DHF är endemisk och som riskerar att smittas av dengueviruset. Flera faktorer bidrar till att viruset överförs av Aedes aegypti, bl.a. temperatur, nederbörd, migration från landsbygd till stad, befolkningstillväxt, lagrat vatten och ökad mängd fast avfall, vilket ger larverna livsmiljöer för vektorn. Det kan också förekomma utbrott av DHF i samband med resor. Denguefeber är den mest utbredda arbovirusinfektionen i världen.
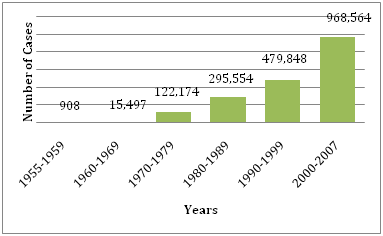
Figur 1: Genomsnittligt antal DF/DHF som rapporterats till WHO under de angivna åren .
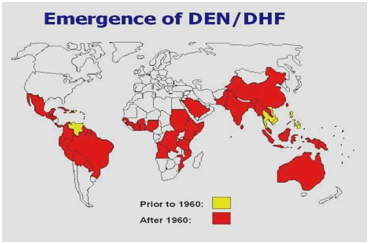
Figur 2: Utbredning av denguefeber/dengue hemorragisk feber i Nord- och Sydamerika, Västindien, Afrika och Mellanöstern.
Riskfaktorer för DF och överföring av denguevirus
Denguefeber är en viktig leddjursburen virussjukdom . Forskning visar att Aedes-släktet, främst Aedes aegypti och Aedes albopictus-myggor, har anpassat sig till att leva nära områden där människor bor och är ansvariga för överföringen av denguefeber. Myggorna livnär sig på dagen och föredrar människor framför andra djur . Aedes aegypti har det högsta blodfödningsmönstret för människor med 76,9 %, följt av Aedes albopictus och Aedes vittatus med 75 % respektive 33,3 % . Förekomsten av DF har förknippats med mängden vegetation, trädtäckning, bostadskvalitet och omgivande markyta .
Samman med av människan skapade födosöksområden har klimatet också visat sig påverka dengue-ekologin genom att påverka vektordynamiken, agensutvecklingen och samspelet mellan myggor och människor.13 Temperaturen bidrar till att påverka vektorns utvecklingshastighet, dödlighet, beteende och kontrollerar virusreplikationen inom vektorn. Varmt klimat möjliggör larvutveckling och en ökad hastighet för virusreplikation, medan kallt klimat bromsar virusutvecklingen och minskar myggornas överlevnadstid, vilket minskar möjligheten till en smittsam vektor och minskar överföringen av denguefeber . Temperaturen samverkar också med nederbörden som den viktigaste regulatorn för avdunstning, vilket direkt påverkar tillgången på vattenhabitat och indirekt påverkar marktäcke och markanvändning, vilket kan främja eller hindra tillväxten av vektorpopulationer .
Demografiska och sociala förändringar som befolkningstillväxt, urbanisering och moderna transportmedel bidrar i hög grad till den ökade förekomsten och geografiska spridningen av denguefeberaktivitet . När resenärer flyttar från endemiska områden tenderar de att fungera som fordon för ytterligare spridning . Viralstammens virulens och denguevirusets genetiska variation bidrar också till att öka potentialen för epidemisk överföring av DHF .
Patogenes av dengue hemorragisk feber
När myggan äter på den mänskliga värden injicerar dengueviruset (DENV) i blodomloppet och den omgivande epidermis och dermis. Detta resulterar i infektion av omogna Langerhansceller och keratinocyter genom receptormedierad endocytos . E-protein, ytproteinet, omkonfigureras och möjliggör membranfusion och frisättning av det virala RNA:t i den infekterade cellen. De icke-strukturella proteinerna NS1 och NS2A kontrollerar replikationen av viralt RNA och NS1 kan också vara inblandad i aktiveringen av komplementkaskaden . De infekterade cellerna kan sedan dö genom apoptos eller nekros eller vandra till lymfkörtlarna där makrofager rekryteras (figur 3). Infektion med någon av de fyra serotyperna av denguefeber (DENV-1 till DENV-4) kan i de flesta fall vara asymtomatisk eftersom värdets immunsystem kan neutralisera den lokalt, men den kan också orsaka ett spektrum av kliniska manifestationer, där den allvarligaste formen är DHF, som kan utvecklas till DSS och död . DHF definieras kliniskt som en kontinuerlig feber i 2 till 7 dagar med hemorragiska manifestationer på slemhinnor eller hud i samband med trombocytopeni (<100 000 celler/mm3) och en hematokrit som är mer än 20 % högre än baslinjen för patienten eller samma åldersgrupp . De patologiska kännetecknen för DHF är plasmaläckage från pleurala eller peritoneala ytor och intrinsisk koagulopati, som kliniskt mäts antingen genom ett positivt tourniquet-test eller genom tecken på spontan blödning, t.ex. petechier eller ekchymoser, tandköttsblödning eller epistaxis eller gastrointestinal blödning .

Figur 3: Efter att ha blivit biten av den bärande Aedes aegypti-myggan infekteras omogna Langerhansceller och keratinocyter med DENV. De infekterade cellerna rör sig sedan ner i lymfan där makrofager rekryteras . Härifrån sprids infektionen till olika organ, inklusive lever, mjälte och benmärg. Nekros i benmärgen orsakad av DENV kan leda till att hematopoietiska och minskad trombogenes i blodet undertrycks . Den inflammatoriska reaktionen, som orsakas av frisättning av kemokiner och cytokiner från mastceller, makrofager och lymfocyter, orsakar ökad kärlpermeabilitet, trombocytdysfunktion och trombocytopeni samt plasmaläckage . Även om mekanismen inte är väl förstådd tycks denna kaskad också orsaka spontan blödning, vilket leder till de kliniska manifestationerna petechier, tandköttsblödning och gastrointestinal blödning .
Denna allvarliga form av sjukdomen är ofta ett resultat av en sekundärinfektion, där värden smittas med en andra serotyp och ett komplext samspel mellan viruset och värdens immunförsvar uppstår . Även om den mekanism som orsakar denna reaktion inte är väl förstådd, finns det tecken som tyder på att tidigare infektion kan skapa korsreaktiva antikroppar som binder den nya serotypen, men som inte kan neutralisera den . Detta kallas teorin om antikroppsberoende förstärkning (ADE) . Man tror att antikroppar som bildats under tidigare infektioner mot DENV:s strukturella proteiner, t.ex. E-protein eller prM, inte kan neutralisera den nya patogenen utan i stället leder till ökad bindning till Fcγ-receptor-positiva celler, vilket möjliggör en förstärkt replikation av viruset . Som svar på detta frigör immunsystemet ett överdrivet cytokinsvar, vilket leder till ökad kärlpermeabilitet och koagulopati .
Mastceller har också involverats i patogenesen för DHF. I vissa fall verkar mastceller ge en skyddande funktion där antivirala molekyler frigörs av de granulation och andra immunceller, t.ex. T-lymfocyter och naturliga mördarceller (NK) rekryteras, som alla bidrar till att neutralisera viruset . I andra fall kan dock de lokala kontrollmekanismerna inte hålla viruset tillbaka och det färdas genom blodomloppet eller lymfsystemet för att aktivera mastceller i andra organ, t.ex. lever, mjälte och lymfkörtlar . När de granulering sker i dessa organ frigörs proteaser och inflammatoriska mediatorer, t.ex. leukotriener och VEGF (vascular endothelial growth factor), syntetiseras, vilket ökar kapillärernas permeabilitet och leder till plasmaläckage . Detta är viktigt eftersom olika grupper av mastceller frigör olika mediatorer under de granuleringsprocessen . Virus-antikroppskomplexet, kanske genom denguevirusets NS1-antigen, och cytokinproduktionen leder också till komplementaktivering. Det är känt att frisättningen av C3a- och C5a-fragment ökar kärlpermeabiliteten och därmed bidrar till plasmaläckage.
Typen och mängden cytokiner som frisätts spelar en viktig roll när det gäller att bestämma sjukdomens svårighetsgrad. Makrofaginflammatoriskt protein 1β (MIP-1β) verkar vara en indikator på mindre allvarlig sjukdom eftersom det frisätts av infekterade mononukleära celler och aktiverade NK-celler. Det fungerar som en kemoattraktor för fler NK-celler och lockar dem till den inflammatoriska platsen, vilket begränsar virusreplikationen och den nedströms liggande cytokineffekten. Interferon γ (IFN-γ) har å andra sidan visat sig inducera plasmaläckage och öka upptaget av denguepartiklar genom att öka Fc-receptorerna på målcellerna och är därför förknippat med allvarligare kliniska manifestationer och dålig prognos . Andra cytokiner som visat sig vara förhöjda vid DHF och som har satts i samband med induktion av plasmaläckage är interleukin 2 (IL-2), tumörnekrosfaktor α (TNF- α), makrofagmigrationsinhibitorisk faktor (MIF), monocyt kemotaktiskt protein-1 (MCP-1), interleukin-8 (IL-8) och högmobilitetsgruppsbox-1 (HMGB-1) . Effekterna av cytokinfrisättning är inte begränsade till kärlpermeabilitet och plasmaläckage, utan är också inblandade i de hemorragiska manifestationerna av DHF. Den underliggande mekanismen som orsakar blödning vid DHF är dock dåligt förstådd. Även om de flesta infekterade celler är benägna att dö genom apoptos sker en viss nekros, vilket resulterar i frisättning av toxiner som aktiverar koagulations- och fibrinolysesystemen. När höga nivåer av nekros uppstår i benmärgen på grund av hög virusbelastning undertrycks den hematopoetiska blodbildningen, vilket resulterar i trombolytiskpeni . Den resulterande minskningen av trombogenes och trombocytdysfunktion kan orsaka kapillär fragilitet och de resulterande kliniska manifestationer som ses vid DHF . Vissa studier tyder på att leverns inblandning i DENV-infektion kan vara inblandad i spontan blödningsbenägenhet, med en korrelation mellan förhöjda leverenzymnivåer och ökad blödningsbenägenhet .
Kliniska tecken och symtom
Den kliniska manifestationen av sjukdomen omfattar asymtomatisk infektion, mild denguefeber (DF), mild denguehemorragisk feber (DHF) eller denguechocksyndrom (DSS), som ofta är allvarlig på grund av onormal kapillärpermeabilitet och plasmaläckage . Svårt denguevirus förekommer vanligen hos patienter som tidigare har infekterats med denguevirus (dvs. sekundärinfektion). Hög frekvens av allvarlig dengueinfektion har också rapporterats hos spädbarn med primär denguevirusinfektion som fötts av mödrar som tidigare varit infekterade med denguevirus .
Den inledande fasen av DHF framstår som denguefeber. Symtomatologin i denna initiala fas beror på patientens ålder och omfattar plötsligt hög feber (ibland med två 2 toppar – sadelryggs), svår huvudvärk, minskad aptit, svår myalgi och artralgi, ett makulopapulärt hudutslag som uppträder tre till fyra dagar efter den första febern, retroorbital smärta, fotofobi, lymfadenopati, lindrig blödning (epistaxis, tandköttsblödning, gastrointestinal blödning, hematuri och menorragi) och ett positivt tourniquet-test. DHF-fall kännetecknas av fyra huvudsakliga kliniska manifestationer som är hög feber, blödningsfenomen och ofta hepatomegali och cirkulationssvikt. Den akuta febrila sjukdomen, som är karakteristisk för den inledande fasen, består av temperaturer över 39 °C och förblir så i 2-7 dagar.
De ovannämnda symtomen i initialfasen förvärras successivt med kontinuerlig feber och huvudvärk, svår buksmärta eller ömhet, ihållande kräkningar, hematemesis, melena, petekier, lätt blåmärken, rastlöshet, letargi, dåsighet, irritabilitet, blödning eller blåmärken under huden . Efter 2-7 dagars feber åtföljs en snabb temperatursänkning ofta av tecken på cirkulationsstörningar av varierande svårighetsgrad. Patienten kan svettas, vara rastlös och ha kalla extremiteter samt visa förändringar i puls och blodtryck. Efter 24-48 timmar efter DHF:s början observeras särskilda kännetecken, onormal hemostas och plasmaläckage som är de utmärkande symtomen.
En bra indikator på dessa framsteg är en förstoring av levern på mer än 2 cm, eftersom hepatomegali tenderar att föregå plasmaläckage . Många patienter återhämtar sig med eller utan vätske- och elektrolytbehandling. I allvarliga fall kan plasmaförlusten utvecklas till chock och död om den inte behandlas . Forskning tyder på att både en sekundär dengueinfektion och en överdriven vedergällning av cytokinernas immunsystemrespons ökar prediktionen för att en patient ska utveckla DHF.
Virala produkter som NS1-glykoprotein tros påverka komplementaktiveringen och den vaskulära permeabiliteten vilket resulterar i plasmaläckage som utvecklas till ascites eller pleurautgjutningar . Cytokinresponsen är också ansvarig för att öka den vaskulära permeabiliteten, vilket leder till att det intravaskulära onkotiska trycket minskar och underlättar förlust av vätska till de extravaskulära delarna (figur 4). Den onormala hemostasen består av trombocytopeni samtidigt med en ökning av hematokriten , förlängd partiell tromboplastintid med minskad fibrinogenkoncentration, tillsammans med de tidigare nämnda petechierna, allvarliga gastrointestinala blödningar, ekchymos och epistaxis .
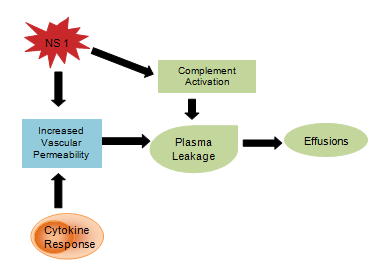
Figur 4: Cytokin immunsystemrespons.
Under den febrila viremiska fasen av DHF tros trombocytopenin och de efterföljande manifestationerna uppkomma på grund av benmärgssuppression. Som tidigare nämnts är suppressionen av benmärgen ett resultat av att den är en plats för replikation av viruset och specifikt angriper hematopoietiska progenitorceller , Emellertid föreslogs även immunmedierad förstörelse av trombocyterna genom upptäckten av virus-antikroppskomplex som hittades på trombocytytytor hos DHF-patienter.
Ovanliga kliniska manifestationer är akut hepatit, leversvikt, akut njursvikt, encefalopati eller kardiomyopati (akut myokardit) . I en studie om dödlig DHF hos vuxna undersöktes andra dödsorsaker än Dengue chocksyndrom (DSS) hos patienter med svår dengue och man drog slutsatsen att hypotermi, leukocytos och bandemi kan vara utlösande tecken på svår dengue. I studien rekommenderas dessutom kliniker att vara medvetna om eventuell utveckling av massiv GI-blödning, särskilt hos patienter med tidigt förändrat medvetande, djup trombocytopeni, förlängd PT och/eller leukocytos .
Diagnostik, behandling och handläggning
En tidig och korrekt diagnos är kritisk för korrekt klinisk vård. Det finns många metoder med vilka diagnosen av dengue kan ställas. Diagnosen kan ställas genom isolering av viruset, virusets nukleinsyra, antikroppar och antigener eller en kombination av alla dessa tekniker. Påvisande av denguevirus genom odling är det definitiva diagnostiska testet, men praktiska överväganden begränsar dess användning. Detektion av virus-RNA går snabbare, men kontaminering kan leda till falskt positiva resultat. Serologiska tester kan också ge falska positiva resultat på grund av korsreaktiva antikroppar.
Akuta infektioner påvisas i serum, plasma och cirkulerande blodkroppar under den tidiga konvalescentfasen, dvs. de första 5-8 dagarna efter symtomen. Vid denna tidpunkt kan den primära virusbelastningen vara så hög som103 RNA-partiklar/ml eller större än 106 RNA-partiklar/ml vid sekundära infektioner . För närvarande används kombinationen av NS1-antigen- och antikroppstester samt molekylära metoder, t.ex. RT-PCR (reverse transcription-polymerase chain reaction) i realtid, allt oftare för diagnostik eftersom de kan ge snabbare resultat och vara känsligare. Immunohistokemisk analys och immunofluorescens bekräftar också förekomsten av viruset genom virusantigen. IgM-antikroppar är de första som uppträder inom de första 3-5 dagarna efter infektionen .
De är på toppnivå 2 veckor efter det att symtomen uppträder och minskar sedan i allmänhet till odetekterbara nivåer efter 30-60 dagar . IgG-antikroppar, som är mer korsreaktiva, upptäcks på låga nivåer efter de första 7-9 dagarna av symtomen, ökar långsamt upp till fyra gånger och förblir påvisbara efter flera månader och eventuellt till och med livet ut . Det mänskliga antigen- och antikroppssvaret är beroende av värdens immunstatus och förekommer endast vid primär- eller sekundärinfektion. Det finns inga specifika behandlingar eller antivirala läkemedel mot denguefeber. Patofysiologin vid dengue ökar den vaskulära permeabiliteten, vilket leder till en betydande förlust av plasma från det intravaskulära kompartmentet till det extravaskulära utrymmet.
Denna vätskeförlust kan leda till chock och leder utan rätt korrigering till hypoxi, metabolisk acidos och slutligen till döden. Den primära behandlingen kräver därför stödjande vård i slutenvården med vätske- och elektrolytbalans. Den packade cellvolymen bör övervakas på timmen var 4-6 timme. Signifikant plasmaförlust definieras som en >20 % ökning av packad cellvolym eller hematokrit. När en patient når dessa nivåer krävs snabb och aggressiv volymersättning .
Förnyelsehastigheten för infusionsvätska är beroende av den packade cellvolymen och urinproduktionen. Det finns flera vätskor som används för att ersätta plasmaförlust, bland annat fysiologisk koksaltlösning, Ringerlaktat eller Ringeracetat, utspädd 5-procentig glukoslösning, plasma eller plasmasubstitut som dextrin 40 och färskt helblod . Förutom intravenös vätskeersättning kan elektrolyter tillföras oralt eftersom det kommer att lindra en del av törsten och uttorkningen från febern. Stödjande smärtstillande medel som t.ex. paracetamol kan användas för att behandla feber och andra symtom. NSAID och aspirin bör undvikas eftersom de kan påskynda Reyes syndrom.
När DHF-patienterna återhämtar sig måste de uppfylla följande kriterier innan de skrivs ut från sjukhuset: synlig klinisk förbättring, afebril utan användning av febernedsättande medel i >24 timmar, ökad aptit, stabil hematokrit, adekvat urinproduktion, tre dagar efter återhämtning från allvarlig metabolisk acidos, trombocytantal >50 000/mm3, och ingen andningssvårigheter på grund av pleurautgjutning eller ascites .
Förebyggande och utrotning av aedes aegypti
Aedes aegypti, som är den vanligaste vektorn för dengueviruset, är huvudmålet för övervakning och kontroll. Andra vektorer, t.ex. Aedes albopictus, kan ge upphov till denguefeber, men övervaknings- och kontrollåtgärder för olika vektorer bör endast övervägas om det finns tillförlitliga bevis för att dessa vektorer har spelat en epidemiologiskt betydande roll i överföringen av dengueinfektioner . Det första initiativet för att utrota Aedes aegypti togs på Kuba 1901. Fumigering och eliminering av myggförekomsterna genom att förstöra övergivna behållare var de första stegen för att utrota vektorn . Efter utbrott av gula febern i Brasilien 1928 och 1932 blev det uppenbart att ett fullständigt skydd av stadsbefolkningen var beroende av en fullständig utrotning av Aedes aegypti-myggan. Detta ledde till att den panamerikanska hälsoorganisationen (PAHO) 1947 godkände den kontinentala planen för utrotning av Aedes aegypti-myggan i syfte att bekämpa gula febern i städerna. Sedan 1947 har Pan American Sanitary Bureau (PASB) intensivt främjat kampanjer i alla drabbade länder, och deras framgång visade sig 1962 när 18 kontinentala länder och ett antal karibiska öar hade uppnått utrotning. Som ett resultat av dessa ansträngningar är det amerikanska DENV-2 genotyp V det enda denguevirus som finns kvar i dag .
Trots ansträngningarna att utrota vektorn har Aedes aegypti inte utrotats på Kuba, i USA, Venezuela och flera karibiska länder . Decennier av oöverträffade mänskliga ansträngningar för att utrota Aedes aegyptifell sönder mycket snabbt och ledde snabbt till infestation. Bristande övervakning och försämrad struktur för utrotningsprogrammen, otillräcklig sanering av miljön och otillräckligt deltagande från samhällets sida var några av de faktorer som ledde till att ansträngningarna för att utrota vektorn minskade. I dagsläget finns det inget vaccin för att förebygga dengueinfektioner. Takeda Vaccines Inc. utvecklar ett levande, försvagat kandidatvaccin som kallas tetravalent denguevaccin (TDV) och som består av en försvagad DENV-2-stam (TDV-2) och tre chimära virus som innehåller prM- och E-proteingener från DENV-1, -3 och -4, vilka uttrycks inom ramen för den försvagade TDV-2-genomstammen (TDV-1, TDV-3 respektive TDV-4). Vaccinet har visat sig vara väl tolererat och immunogent i en klinisk fas 2-studie i dengue endemiska länder bland vuxna och barn.
Vaccinet befinner sig i utvecklingsfas 3. Dessutom har Sanofi Pasteur utvecklat ett rekombinant, levande försvagat, tetravalent denguevaccin (CYD-TDV) som visat konsekvent säkerhet och effekt hos ≥9-åringar i endemiska länder; det befinner sig i ett sent utvecklingsstadium . Dengvaxia (CYD-TDV) från Sanofi Pasteur registrerades för första gången i Mexiko i december 2015 och har utvärderats i kliniska fas III-studier som en 3-dosserie enligt ett schema 0/6/12 månader . Det finns ytterligare cirka fem vaccinkandidater som utvärderas i kliniska studier . Resenärer till dengue-endemiska områden löper risk att smittas av dengue, och för att förebygga detta bör de därför uppmuntras att välja boende med väl avskärmade fönster och dörrar, använda insektsmedel, bära lämpliga kläder samt tömma och täcka över allt stående vatten som eventuellt kan bli en plats för myggförökning .
Aktuell global situation
För närvarande finns det förväntningar på att förekomsten av denguefeber kommer att fortsätta att öka på grund av många faktorer, bland annat socioekonomisk status, kontinuerliga klimatförändringar, resor och globalisering. Vacciner är fortfarande under utveckling och det finns för närvarande ingen specifik antiviral behandling för att hantera det växande hotet från denguefeber . Den globala uppskattningen av förekomsten av dengue är mellan 50 och 200 miljoner. Användningen av kartografiska metoder tyder dock nyligen på att antalet fall ligger närmare 400 miljoner. År 2012 klassificerade WHO denguefeber som en av de viktigaste myggburna virussjukdomarna . Denna klassificering motiveras av den betydande geografiska spridningen av viruset tillsammans med dess vektor till områden som tidigare inte var drabbade (figur 5).
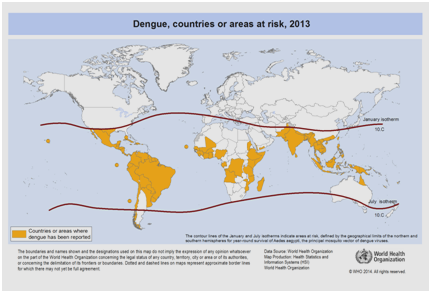
Figur 5: Länder eller områden i världen där dengue rapporterades 2013, enligt uppgifter insamlade av Världshälsoorganisationen .
Det stöds också av de kostnader som sjukdomen för med sig . Om man jämför bördan av dengue och andra smittsamma sjukdomar i den drabbade regionen, orsakar dengue mycket mer mänskligt lidande och är en större börda än de andra vektorburna sjukdomarna . Enligt WHO är denguefeber den främsta orsaken till sjukhusvistelse och dödsfall bland barn i Sydostasien . En studie av Hammond et al. rapporterade att majoriteten av sjukligheten och dödligheten i samband med denna sjukdom är förknippad med barn snarare än andra åldersgrupper. Spädbarn i åldern 4-9 månader och barn i åldern 5-9 år bär den största bördan av denguefeber (figur 6). Sjukdomens svårighetsgrad hos dessa barn beror ofta på sekundär DENV-infektion . I en ekologisk studie som genomfördes av Dıaz-Quijano och Waldman i Latinamerika och Västindien konstaterades att de avgörande faktorerna för dengue-dödligheten i dessa befolkningar omfattade längden av erkänd endemicitet, befolkningstäthet och nederbörd .
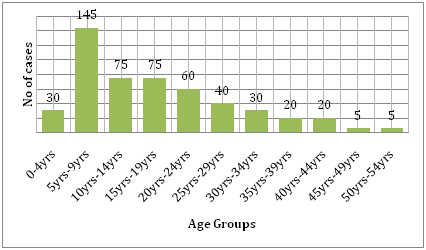
Figur 6: Åldersfördelning av studiekohorten i León efter åldersgrupp .
Förutom konsekvenserna av sjuklighet och dödlighet medför dengueviruset en stor ekonomisk börda för de drabbade regionerna, varav många är dåligt rustade att bära dessa kostnader. År 2010 uppskattades den ekonomiska bördan av dengueviruset till i genomsnitt 2,1 miljarder dollar per år i Nord- och Sydamerika (i amerikanska dollar 2010), med ett intervall på 1-4 miljarder dollar i känslighetsanalyser och en betydande variation från år till år . Enligt WHO betraktas dengue nu som ett världsomspännande problem, och det är i Asien och Stillahavsområdet som den största delen (75 %) av den globala befolkningen exponeras för dengueviruset. Även i västra Stilla havet har antalet rapporterade fall av denguevirus ökat kontinuerligt under det senaste decenniet.
Till och med att det inte förekom någon överföring av febernedsättande sjukdom i mitten av 1900-talet finns det nu en ökad endemi av inhemskt febernedsättande sjukdom i Nord- och Sydamerika. Enbart i Nord- och Sydamerika fanns det 2010 över 1,6 miljoner rapporterade fall av dengue och 49 000 av dessa var allvarliga denguefall . I Afrika ökar utbrotten av DF i storlek och frekvens, men rapporteras inte konsekvent till WHO. Mellan 1960 och 2010 rapporterades sporadiska fall av 22 afrikanska länder, vilket framgår av tillgängliga uppgifter om utbrott . I Europa har inga epidemier av afrikansk feber rapporterats sedan ett utbrott i Grekland 1928. Det finns nu hot om utbrott i Europa, som har tillskrivits Aedes albopictus på grund av resor från länder där sjukdomen är endemisk. Man räknar med att sjukdomsincidensen kommer att öka under de kommande åren på grund av multifaktoriella riskfaktorer.