Lärandemål
- Att beskriva egenskaperna hos en gas.
De tre vanliga faserna (eller tillstånden) av materia är gaser, vätskor och fasta ämnen. Gaser har den lägsta densiteten av de tre, är mycket komprimerbara och fyller helt och hållet varje behållare i vilken de placeras. Gaser beter sig på detta sätt eftersom deras intermolekylära krafter är relativt svaga, så deras molekyler rör sig ständigt oberoende av de andra närvarande molekylerna. Fasta ämnen är däremot relativt täta, styva och inkompressiva eftersom de intermolekylära krafterna är så starka att molekylerna i stort sett är låsta på plats. Vätskor är relativt täta och inkompressiva, liksom fasta ämnen, men de flyter lätt för att anpassa sig till formen på sina behållare, liksom gaser. Vi kan därför dra slutsatsen att summan av de intermolekylära krafterna i vätskor ligger mellan de intermolekylära krafterna i gaser och fasta ämnen. Figur 10.1.1 jämför de tre materiatillstånden och illustrerar skillnaderna på molekylär nivå.
Figur 10.1.1.1 En diatomär substans (O2) i fast, flytande och gasformigt tillstånd
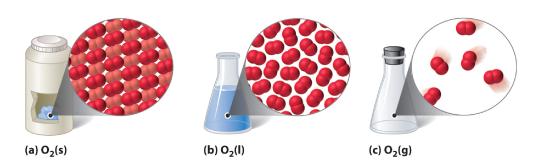
(a) Fast O2 har en fast volym och form, och molekylerna är tätt packade tillsammans. (b) Flytande O2 anpassar sig till behållarens form men har en fast volym; den innehåller relativt tätt packade molekyler. (c) Gasformigt O2 fyller sin behållare helt och hållet – oavsett behållarens storlek eller form – och består av vitt skilda molekyler.
Tillståndet hos ett visst ämne beror starkt på förhållandena. H2O finns till exempel ofta i alla tre tillstånd: fast is, flytande vatten och vattenånga (dess gasform). Under de flesta förhållanden möter vi vatten som den vätska som är nödvändig för livet; vi dricker det, lagar mat med det och badar i det. När temperaturen är tillräckligt kall för att omvandla vätskan till is kan vi åka skidor eller skridskor på det, packa det till en snöboll eller en snökotte och till och med bygga bostäder med det. VattenångaSkillnaden mellan en gas och en ånga är subtil: termen ånga avser den gasform av ett ämne som är en vätska eller ett fast ämne under normala förhållanden (25 °C, 1,0 atm). Kväve (N2) och syre (O2) kallas därför gaser, men gasformigt vatten i atmosfären kallas vattenånga. är en beståndsdel av den luft vi andas och bildas när vi värmer vatten för att laga mat eller göra kaffe eller te. Vattenånga vid temperaturer över 100 °C kallas ånga. Ånga används för att driva stora maskiner, inklusive turbiner som genererar elektricitet. Egenskaperna hos vattnets tre tillstånd sammanfattas i tabell 10.1.1
Den geometriska strukturen och de fysikaliska och kemiska egenskaperna hos atomer, joner och molekyler beror vanligen inte på deras fysiska tillstånd; de enskilda vattenmolekylerna i is, flytande vatten och ånga är till exempel alla identiska. Däremot beror de makroskopiska egenskaperna hos ett ämne starkt på dess fysiska tillstånd, som bestäms av intermolekylära krafter och förhållanden som temperatur och tryck.
Figur 10.1.2 visar placeringen i det periodiska systemet av de grundämnen som vanligen återfinns i gasformigt, flytande och fast tillstånd. Med undantag för väte finns de grundämnen som förekommer naturligt som gaser på den högra sidan av det periodiska systemet. Av dessa är alla ädelgaser (grupp 18) monatomära gaser, medan de andra gasformiga grundämnena är diatomära molekyler (H2, N2, O2, F2 och Cl2). Syre kan också bilda en andra allotrope, den mycket reaktiva treatomiga molekylen ozon (O3), som också är en gas. Brom (som Br2) och kvicksilver (Hg) är däremot vätskor under normala förhållanden (25 °C och 1,0 atm, allmänt kallat ”rumstemperatur och tryck”). Gallium (Ga), som smälter vid endast 29,76 °C, kan omvandlas till en vätska helt enkelt genom att hålla en behållare i handen eller genom att förvara den i ett rum utan luftkonditionering en varm sommardag. Resten av grundämnena är alla fasta ämnen under normala förhållanden.
Figur 10.1.2 Grundämnen som förekommer naturligt som gaser, vätskor och fasta ämnen vid 25°C och 1 atm
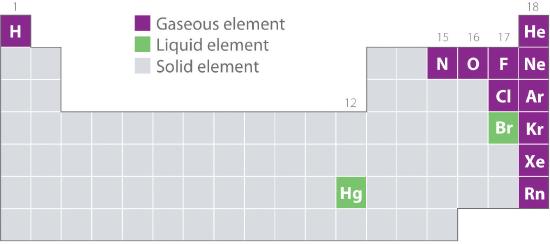
Ädelgaserna och kvicksilver förekommer som monatomära arter, medan alla andra gaser och brom är diatomära molekyler.
Många av de grundämnen och föreningar som vi hittills har stött på förekommer vanligen som gaser; några av de vanligaste finns i tabell 10.1.2 . Bland gasformiga ämnen finns många binära hydrider, t.ex. vätehalogeniderna (HX), hydrider av chalkogenerna, hydrider av grupp 15-elementen N, P och As, hydrider av grupp 14-elementen C, Si och Ge samt diboran (B2H6). Dessutom är många av de enkla kovalenta oxiderna av ickemetaller gaser, t.ex. CO, CO2, NO, NO2, SO2, SO3 och ClO2. Många organiska föreningar med låg molekylmassa är också gaser, däribland alla kolväten med fyra eller färre kolatomer och enkla molekyler som dimetyleter, metylklorid (CH3Cl), formaldehyd (CH2O) och acetaldehyd (CH3CHO). Köldmedier, såsom klorfluorkarboner (CFC) och klorfluorkolväten (HCFC), är gaser som lätt kan göras flytande genom komprimering, och vätskor kan i sin tur omvandlas till gaser genom att trycket på vätskorna minskas. Fasförändringen från vätska till gas i rören inuti kylskåpet kyler ned, medan kompressionen i spolarna på kylskåpets botten eller baksida värmer upp rummet. Ammoniak och SO2 är andra komprimerbara gaser som har använts som köldmedier, men som inte kan användas i hus på grund av att de är giftiga. Ammoniak används fortfarande som köldmedium i stora kommersiella miljöer på grund av sin effektivitet och låga kostnad.
Alla tidigare nämnda gasformiga ämnen (förutom de monatomära ädelgaserna) innehåller kovalenta eller polära kovalenta bindningar och är opolära eller polära molekyler. De starka elektrostatiska attraktionerna i joniska föreningar, som NaBr (kokpunkt = 1390°C) eller LiF (kokpunkt = 1673°C), förhindrar däremot att de existerar som gaser vid rumstemperatur och tryck. Dessutom är de lättaste medlemmarna i en given familj av föreningar sannolikt gaser, och kokpunkterna för polära föreningar är i allmänhet högre än för opolära föreningar med liknande molekylmassa. I en given serie av föreningar är därför de lättaste och minst polära medlemmarna de som med största sannolikhet är gaser. Med relativt få undantag är dock föreningar med mer än cirka fem atomer från period 2 eller lägre för tunga för att existera som gaser under normala förhållanden.
Notera mönstret
Gasformiga ämnen innehåller ofta kovalenta eller polära kovalenta bindningar, existerar som opolära eller svagt polära molekyler, har relativt låga molekylmassor och innehåller fem eller färre atomer från period 1 eller 2.
Och även om gaser har ett brett spektrum av användningsområden, tros ett särskilt grymt användningsområde för en gasformig substans ha använts av perserna mot den romerska staden Dura i östra Syrien under det tredje århundradet e.Kr. Perserna grävde en tunnel under stadsmuren för att ta sig in och erövra staden. Arkeologiska bevis tyder på att när romarna svarade med mottunnlar för att stoppa belägringen, antände perserna bitumen- och svavelkristaller för att producera en tät, giftig gas. Det är troligt att bälgar eller skorstenar spred de giftiga ångorna. Resterna av cirka 20 romerska soldater upptäcktes vid basen av stadsmuren vid ingången till en tunnel som var mindre än 2 m hög och 11 m lång. Eftersom det är högst osannolikt att perserna skulle ha kunnat slakta så många romare vid ingången till ett så begränsat utrymme, spekulerar arkeologerna i att de gamla perserna använde sig av kemisk krigföring för att framgångsrikt erövra staden.
Exempel 10.1.1
Vilka föreningar skulle du förutspå att de är gaser vid rumstemperatur och tryck?
- cyklohexen
- lithiumkarbonat
- cyklobutan
- vanadium(III)oxid
- benzoesyra (C6H5CO2H)
Givet: Föreningar
Fråga om: fysikaliskt tillstånd
Strategi:
A Bestäm om varje förening är jonisk eller kovalent. En jonisk förening är troligen ett fast ämne vid rumstemperatur och tryck, medan en kovalent förening kan vara ett fast ämne, en vätska eller en gas.
B Bland de kovalenta föreningarna är de som är relativt opolära och har låga molekylmassor troligen gaser vid rumstemperatur och tryck.
Lösning:
A Litiumkarbonat är Li2CO3, som innehåller Li+- och CO32-joner, och vanadium(III)oxid är V2O3, som innehåller V3+- och O2-joner. Båda är huvudsakligen joniska föreningar som förväntas vara fasta ämnen. De återstående tre föreningarna är alla kovalenta.
B Bensoesyra har mer än fyra kolatomer och är polär, så det är inte troligt att den är en gas. Både cyklohexen och cyklobutan är i huvudsak opolära molekyler, men cyklobutan (C4H8) har en betydligt lägre molekylmassa än cyklohexen (C6H10), som återigen har fler än fyra kolatomer. Vi förutspår därför att cyklobutan sannolikt är en gas vid rumstemperatur och tryck, medan cyklohexen är en vätska. Med en kokpunkt på endast 12 °C, jämfört med 83 °C för cyklohexen, är cyklobutan faktiskt en gas vid rumstemperatur och tryck.
Övningsuppgift
Vilka föreningar skulle du förutspå att vara gaser vid rumstemperatur och tryck?
- n-butanol
- ammoniumfluorid (NH4F)
- ClF
-
etylenoxid
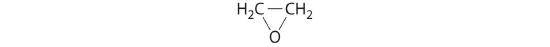
- HClO4
Svar: c; d
Sammanfattning
Massor kan existera i tre tillstånd: gas, vätska och fast form. Gaser har den lägsta densiteten av de tre, är mycket komprimerbara och fyller sina behållare helt och hållet. Grundämnen som existerar som gaser vid rumstemperatur och tryck är grupperade på den högra sidan av det periodiska systemet; de förekommer antingen som monatomära gaser (ädelgaserna) eller diatomära molekyler (vissa halogener, N2, O2). Många oorganiska och organiska föreningar med fyra eller färre icke-vätgasatomer är också gaser vid rumstemperatur och tryck. Alla gasformiga ämnen kännetecknas av svaga interaktioner mellan de ingående molekylerna eller atomerna.
Key Takeaway
- Molekylerna i gasformiga ämnen innehåller ofta kovalenta eller polära kovalenta bindningar, är opolära eller svagt polära molekyler och har relativt låga molekylmassor.
Begreppsproblem
-
Förklara skillnaderna mellan materiens mikroskopiska och makroskopiska egenskaper. Är kokpunkten för en förening en mikroskopisk eller makroskopisk egenskap? molekylmassa? Varför?
-
Bestäm om smältpunkten, dipolmomentet och den elektriska ledningsförmågan är makroskopiska eller mikroskopiska egenskaper hos materien och förklara ditt resonemang.
-
Hur påverkar materiens mikroskopiska egenskaper de makroskopiska egenskaperna? Kan du relatera molekylmassan till kokpunkten? Varför eller varför inte? Kan polaritet relateras till kokpunkten?
-
För ett ämne som har gas-, vätske- och fasta faser, ordna dessa faser i ordning efter ökande
- densitet.
- styrka av intermolekylära interaktioner.
- kompressibilitet.
- molekylär rörelse.
- ordning i molekylernas eller atomernas arrangemang.
-
Förklara vad som är fel med detta påstående: ”Ämnestillståndet bestämmer till stor del de molekylära egenskaperna hos ett ämne.”
-
Beskriv de viktigaste faktorerna som bestämmer tillståndet hos en viss förening. Vilka yttre förhållanden påverkar om ett ämne existerar i något av de tre materiatillstånden?
-
Vilka grundämnen i det periodiska systemet existerar som gaser vid rumstemperatur och tryck? Vilka av dessa är diatomära molekyler och vilka är monatomära? Vilka grundämnen är vätskor vid rumstemperatur och tryck? Vilken del av det periodiska systemet innehåller grundämnen vars binära hydrider sannolikt är gaser vid rumstemperatur?
-
Är följande observation korrekt? ”Nästan alla binära hydrider som inte är metaller är gaser vid rumstemperatur, men metallhydriderna är alla fasta ämnen.” Förklara ditt resonemang.
-
Är följande observation korrekt? ”Alla chalkogenhydrider är gaser vid rumstemperatur och tryck utom den binära hydriden av syre, som är en vätska.” Förklara ditt resonemang. Skulle du förvänta dig att 1-chlorpropan skulle vara en gas? jodpropan? Varför?
-
Förklara varför joniska föreningar inte är gaser under normala förhållanden.
Svar
-
-
-
-
.
-
-
De molekylära egenskaperna hos ett ämne styr dess materiatillstånd under en given uppsättning förhållanden, inte tvärtom. Förekomsten av starka intermolekylära krafter gynnar ett kondenserat materiatillstånd (flytande eller fast), medan mycket svag intermolekylär interaktion gynnar gasformigt tillstånd. Dessutom dikterar molekylernas form om en kondenserad fas är en vätska eller ett fast ämne.
-
-
Element som existerar som gaser återfinns huvudsakligen i det övre högra hörnet och på högersidan av det periodiska systemet. Följande grundämnen existerar som gaser: H, He, N, O, F, Ne, Cl, Ar, Kr, Xe och Rn. Hälften av halogenerna, alla ädelgaser och de lättaste chalkogenerna och picnogenerna är alltså gaser. Av dessa existerar alla utom ädelgaserna som tvåatomiga molekyler. Endast två grundämnen existerar som vätskor vid en normal rumstemperatur på 20-25 °C: kvicksilver och brom. Den övre högra delen av det periodiska systemet innehåller också de flesta grundämnen vars binära hydrider är gaser. Dessutom är de binära hydriderna av grundämnena i grupperna 14-16 gaser.
-
-
-
-
.