Cancer är ett resultat av att de kontroller som reglerar cellerna bryts ner. Orsakerna till sammanbrottet innefattar alltid förändringar i viktiga gener. Dessa förändringar är ofta resultatet av mutationer, förändringar i kromosomernas DNA-sekvens. Mutationer kan vara mycket små förändringar, som bara påverkar några få nukleotider, eller så kan de vara mycket stora och leda till stora förändringar i kromosomernas struktur.
Både små och stora mutationer kan påverka cellernas beteende. Kombinationer av mutationer i viktiga gener kan leda till utveckling av cancer. Materialet som behandlas på den här sidan beskriver förhållandet mellan mutation och cancer, de olika typerna av mutationer och vad som orsakar dem. Ytterligare information om ämnena på den här sidan finns också i de flesta introduktionsböcker i biologi, vi rekommenderar Campbell Biology, 11th edition.1
Teman på den här sidan:
- Mutationer och cancer
- Ärvda mutationer och cancer
- Typer av mutationer
- Punktmutationer
- Translokationer
- Genförstärkning
- Inversioner, Deletioner och duplikationer
- Aneuploidi
- Epigenetiska förändringar
- Mutationsorsaker
- Mutationssammanfattning
- Känn till flödet: Mutation
Mutation och cancer
De onormala beteenden som cancerceller uppvisar är resultatet av en rad mutationer i viktiga reglerande gener. Cellerna blir successivt mer onormala när fler gener skadas. Ofta skadas de gener som kontrollerar DNA-reparationerna själva, vilket gör cellerna ännu mer mottagliga för allt större genetisk förödelse.
Nedan visas en animation som visar förhållandet mellan kromosomer, gener och DNA.
De flesta cancerformer tros uppkomma från en enda muterad prekursorcell. När den cellen delar sig kan de resulterande ”dottercellerna” få olika mutationer och olika beteenden under en tidsperiod. De celler som får en fördel i fråga om delning eller motståndskraft mot celldöd tenderar att ta över populationen. På detta sätt kan tumörcellerna få ett brett spektrum av förmågor som normalt inte ses i den friska versionen av den representerade celltypen. De beteendeförändringar som ses i cancerceller står i fokus för avsnittet om cancerbiologi på webbplatsen.
Mutationer i viktiga reglerande gener (tumörsuppressorer och proto-onkogener) förändrar cellernas beteende och kan potentiellt leda till den oreglerade tillväxt som ses i cancer.
För nästan alla typer av cancer som hittills har studerats verkar det som om övergången från en normal, frisk cell till en cancercell är en stegvis utveckling som kräver många genetiska förändringar som sammantaget skapar cancercellen. Dessa mutationer förekommer på både onkogener och tumörsuppressorer. Detta är en av anledningarna till att cancer är mycket vanligare hos äldre personer. För att skapa en cancercell måste en serie mutationer inträffa i samma cell. Eftersom sannolikheten för att någon gen blir muterad är mycket liten, står det klart att chansen att flera olika mutationer uppstår i samma cell verkligen är mycket osannolik. Av denna anledning har cellerna i en 70-årig kropp haft mer tid på sig att ackumulera de förändringar som krävs för att bilda cancerceller, medan cellerna i ett barn har mycket mindre sannolikhet att ha förvärvat de nödvändiga genetiska förändringarna. Naturligtvis får vissa barn cancer, men det är mycket vanligare hos äldre individer. I diagrammet nedan visas tjocktarmscancerfrekvensen i USA som en funktion av åldern. Grafen är hämtad från National Cancer Institute. 2
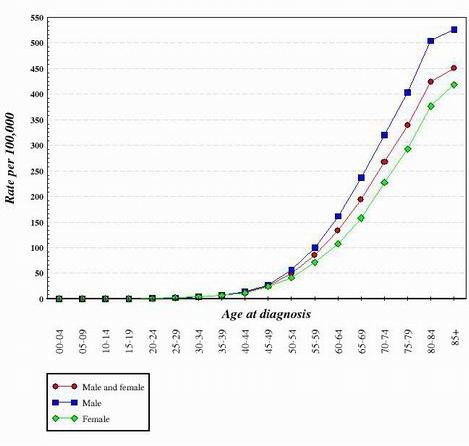
Om man tittar på formen på kurvor som de som visas ovan har man dragit slutsatsen att det krävs flera genetiska förändringar för att skapa celler som blir cancerlika.
I laboratoriet har forskarna försökt skapa tumörceller genom att förändra eller införa viktiga reglerande proteiner. Flera studier har försökt definiera det minsta antal genetiska förändringar som krävs för att skapa en cancercell, med fascinerande resultat.3
I naturen kan mutationer ackumuleras i celler med tiden och om ”rätt” grupp av gener muteras kan cancer uppstå. En studie från 2012 visade att benmärgsstamceller i en frisk individ ackumulerar många mutationer när personen åldras. Bara några fler förändringar i viktiga gener kan orsaka cancer. Resultaten innebär att ”normala” celler och cancerceller kanske inte är så olika i många fall.4
Ärvda mutationer i cancer
För att komplicera saken står det klart att de förändringar som krävs för att skapa en cancercell kan åstadkommas på många olika sätt. Även om alla cancerformer måste övervinna samma spektrum av regleringsfunktioner för att kunna växa och utvecklas kan de inblandade generna skilja sig åt. Dessutom kan ordningen i vilken generna avregleras eller försvinner också variera. Som exempel kan tjocktarmscancertumörer från två olika individer involvera mycket olika uppsättningar av tumörsuppressorer och onkogener, även om resultatet (cancer) är detsamma.
Den stora heterogenitet som ses i cancer, även i cancer i samma organ, innebär att diagnos och behandling är komplicerad. De nuvarande framstegen inom den molekylära klassificeringen av tumörer bör göra det möjligt att rationellt utforma behandlingsprotokoll baserat på de faktiska gener som är inblandade i varje enskilt fall. Nya diagnostiska tester kan innebära screening av hundratals eller tusentals gener för att skapa en personlig profil av tumören hos en individ. Denna information bör göra det möjligt att skräddarsy cancerbehandlingar som är anpassade till individen. För mer information om detta se avsnittet Genomik/Proteomik.
De genetiska förändringar som leder till oreglerad celltillväxt kan förvärvas på två olika sätt. Det är möjligt att mutationen kan uppstå gradvis under ett antal år, vilket leder till att ett ”sporadiskt” fall av cancer utvecklas. Alternativt är det möjligt att ärva dysfunktionella gener som leder till utveckling av en familjär form av en viss cancertyp. Några exempel på cancerformer med kända ärftliga komponenter är:
- Bröstcancer – ärftlighet av muterade versioner av BRCA1- och BRCA2-generna är kända riskfaktorer. Även om många, om inte de flesta, personer med bröstcancer inte har påvisbara förändringar i dessa gener, ökar sannolikheten för att utveckla bröstcancer om man har en muterad form.
- Koloncancer- Defekter i DNA-reparationsgener som MSH2 är kända för att predisponera individer för ärftlig icke-polyposisk kolorektalcancer (HNPCC).
- Retinoblastom- Defekter i Rb-tumörsuppressorgenen är kända för att orsaka denna ögoncancer och flera andra typer av cancer. Mer om just denna sjukdom finns i avsnittet om Rb
Detta är en ofullständig förteckning över kända ärftliga cancertyper, och det är säkert att fler ärftliga cancerformer kommer att identifieras i takt med att genetiken för olika typer av cancer klargörs.
Mer information om detta ämne finns i kapitel 2 och 4 i The Biology of Cancer av Robert A. Weinberg.
Mutationstyper
Den process genom vilken proteiner tillverkas, översättning, bygger på ”läsning” av mRNA som producerats via transkriptionsprocessen. Varje förändring av det DNA som kodar för en gen leder till en förändring av det mRNA som produceras. Det förändrade mRNA kan i sin tur leda till att ett protein produceras som inte längre fungerar korrekt. Även en ändring av en enda nukleotid längs DNA:t i en gen kan leda till ett helt icke-funktionellt protein.
Det finns flera olika sätt på vilka DNA:t kan förändras. I följande avsnitt beskrivs de olika typerna av genetiska förändringar närmare.
Punktmutationer
Genetiska förändringar kan placeras i två allmänna kategorier. Den första kategorin består av förändringar som endast ändrar en eller några få nukleotider längs en DNA-sträng. Dessa typer av förändringar kallas punktmutationer.
När ribosomerna läser en budbärar-RNA-molekyl tolkas var tredje nukleotid som en aminosyra. Dessa koder med tre bokstäver kallas kodoner. För att göra en analogi med en engelsk mening: ”The fat cat ate the rat” skulle innehålla 6 kodoner. De förändringar som orsakas av mutationer kan leda till saker som ”Den feta fladdermusen åt råttan” eller ”Den fa” eller ”Den feta oca tat her at…”. Konsekvenserna för proteinet beror på var förändringen sker och vilken typ av förändring det är.
De kodoner med tre bokstäver som läses av ribosomerna kan ändras genom mutation på ett av tre sätt:
Nonsensmutationer
Den nya kodonet leder till att proteinet avslutas i förtid, vilket ger ett protein som är förkortat och ofta inte fungerar som det ska eller överhuvudtaget.
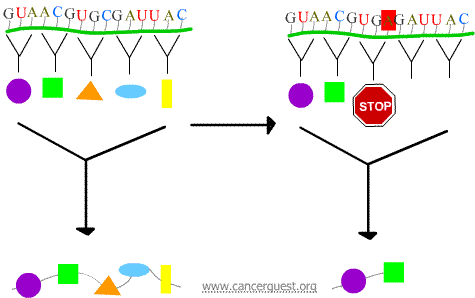
Missense mutationer
Det nya kodonet gör att en felaktig aminosyra infogas i proteinet. Effekterna på proteinets funktion beror på vad som sätts in i stället för den normala aminosyran.

Frameshift-mutationer
Förlusten eller vinsten av 1 eller 2 nukleotider leder till att den påverkade kodonet och alla kodon som följer därefter läses fel. Detta leder till en mycket annorlunda och ofta icke-funktionell proteinprodukt.
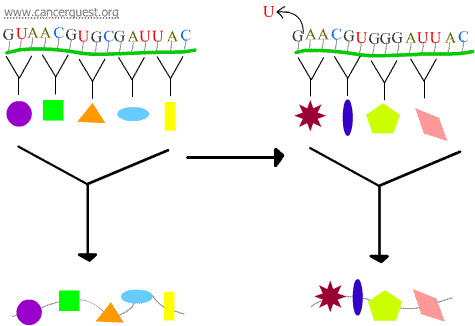
Transkriptionsfel
En del DNA-skador resulterar i en modifierad nukleotid eller en liten grupp nukleotider som inte kan ”läsas” av RNA-polymeras. När RNA-polymeraskomplexet når dessa ställen kommer de ibland att kringgå skadan genom att lägga till nukleotider i ett försök att fortsätta, även om det innebär att de lägger till fel sak. Denna process kallas transkriptionell mutagenes och kan spela en viktig roll i utvecklingen av cancer.5
Translokationer
En annan kategori av mutationer innebär förändringar av större mängder DNA, ofta på kromosomnivå. Dessa kallas translokationer och innebär att kromosomfragment bryts och förflyttas. Ofta gör brott i två olika kromosomer det möjligt att bilda två ”nya” kromosomer, med nya kombinationer av gener.
Men även om det kan tyckas att detta inte skulle orsaka några större problem, eftersom alla gener fortfarande finns kvar, kan processen leda till en avreglerad celltillväxt på ett antal olika sätt-
1. Generna kanske inte transkriberas och översätts på lämpligt sätt på sin nya plats.
2. Förflyttningen av en gen kan leda till en ökning eller minskning av dess transkriptionsnivå.
3. Brytning och sammanfogning kan också ske inom en gen (som visas i grönt ovan), vilket leder till att den inaktiveras.
För vissa cancerformer är särskilda translokationer mycket vanliga och kan till och med användas för att diagnostisera sjukdomen. Translokationer är vanliga i leukemier och lymfom och har varit mindre vanligt identifierade i cancer i fasta vävnader. Ett exempel är ett utbyte mellan kromosomerna 9 och 22 som ses hos över 90 % av patienter med kronisk myeloisk leukemi (CML). Utbytet leder till att det bildas en förkortad form av kromosom 22 som kallas Philadelphiakromosomen (efter platsen där den upptäcktes). Denna translokation leder till bildandet av en onkogen från proto-onkogenen abl.67
Andra cancerformer som ofta (eller alltid) är förknippade med särskilda translokationer är Burkitts lymfom, B-cellslymfom och flera typer av leukemi.
Genamplifiering
I denna mycket ovanliga process har den normala DNA-replikationsprocessen allvarliga brister. Resultatet är att i stället för att göra en enda kopia av en region av en kromosom produceras många kopior. Detta leder till att det produceras många kopior av de gener som finns på den regionen av kromosomen. Ibland produceras så många kopior av den förstärkta regionen att de faktiskt kan bilda egna små pseudokromosomer som kallas dubbelminuterskromosomer.
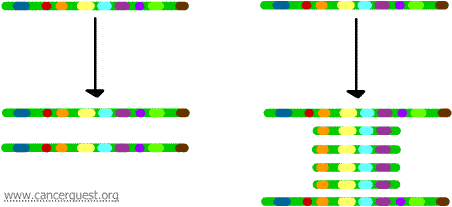
Generna på var och en av kopiorna kan transkriberas och översättas, vilket leder till en överproduktion av det mRNA och det protein som motsvarar de förstärkta generna, vilket visas nedan. De snirkliga linjerna representerar mRNA som produceras via transkriptionen av varje kopia av genen.
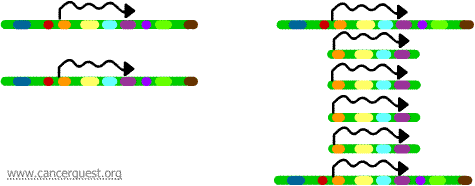
Men även om denna process inte ses i normala celler förekommer den ganska ofta i cancerceller. Om en onkogen ingår i den amplifierade regionen kan det resulterande överuttrycket av den genen leda till en avreglerad celltillväxt. Exempel på detta är amplifieringen av myc-onkogenen i ett stort antal tumörer och amplifieringen av ErbB-2 eller HER-2/neu-onkogenen i bröst- och äggstockscancer. När det gäller HER-2/neu-onkogenen har kliniska behandlingar utformats för att rikta sig mot celler som överuttrycker proteinprodukten.
Genamplifiering bidrar också till ett av de största problemen vid cancerbehandling: läkemedelsresistens. Läkemedelsresistenta tumörer kan fortsätta att växa och sprida sig även i närvaro av kemoterapiläkemedel. En gen som ofta är inblandad kallas MDR för multipel läkemedelsresistens. Proteinprodukten från denna gen fungerar som en pump som ligger i cellmembranet. Den kan selektivt kasta ut molekyler ur cellen, inklusive kemoterapiläkemedel. Detta avlägsnande gör läkemedlen ineffektiva.
Detta diskuteras mer ingående i avsnittet om läkemedelsresistens. Amplifiering av olika gener kan göra andra kemoterapimediciner ineffektiva.
Inversioner, duplikationer och deletioner
Inversioner
I dessa förändringar frigörs DNA-segment från en kromosom och sätts sedan in igen i motsatt riktning. Liksom i de tidigare exemplen kan denna omläggning leda till onormalt genuttryck, antingen genom att aktivera en onkogen eller avaktivera en tumörsuppressorgen.
Duplikationer/Deletioner
Gen eller grupp av gener kan genom replikationsfel kopieras mer än en gång inom en kromosom. Detta skiljer sig från genamplifiering genom att generna inte replikeras utanför kromosomen och att de bara kopieras en extra gång, inte hundratals eller tusentals gånger. Gener kan också gå förlorade på grund av misslyckande i replikationsprocessen eller annan genetisk skada.

Aneuploidi
Aneuploidi är den genetiska förändring som innebär förlust eller ökning av hela kromosomer. På grund av problem i celldelningsprocessen kan det hända att de replikerade kromosomerna inte separeras korrekt i dottercellerna. Detta kan resultera i celler som har för många kromosomer eller för få kromosomer. Ett exempel på ett ganska vanligt aneuploid tillstånd som inte är relaterat till cancer är Downs syndrom, där det finns en extra kopia av kromosom 21 i alla celler hos den drabbade individen.
I animationen nedan görs kopior av två kromosomer, men när cellen delar sig fördelas inte kromosomerna jämnt mellan de två cellerna som bildas (dotterceller). Resultatet är att en av cellerna har för många kromosomer och en har inte tillräckligt många.
Cancerceller är mycket ofta aneuploida. Människor har normalt 46 kromosomer i sina celler, men cancerceller har ofta många fler, ibland mer än 100. Förekomsten av de extra kromosomerna gör cellerna instabila och stör allvarligt kontrollerna av celldelningen. Det pågår för närvarande en debatt om huruvida alla cancerformer är aneuploida eller inte. Oavsett om så är fallet står det klart att aneuploidi är ett vanligt inslag i cancerceller.
Epigenetiska förändringar
Inom de faktiska förändringarna i DNA-sekvensen kan genuttrycket förändras genom förändringar i DNA och kromatin som inte ändrar sekvensen. Eftersom dessa förändringar inte ändrar DNA-sekvensen i generna kallas de epigenetiska förändringar. Två typer av epigenetiska förändringar beskrivs nedan.
Metylering
I denna förändring modifieras vissa nukleotider i DNA genom att en metylgrupp (-CH3) läggs till basen. Metylering av DNA är förknippat med inaktivering av den särskilda regionen av DNA. Onormala DNA-metyleringsmönster har setts i cancerceller. I likhet med de beskrivna förändringarna ändrar metylering uttrycket av de drabbade generna.
Acetylering
I denna epigenetiska förändring modifieras de histonproteiner kring vilka DNA:t är lindat genom tillsats av acetylgrupper (-CH3CHO). Denna förändring leder till att interaktionen mellan DNA och histon lossnar och är förknippad med ökat genuttryck. Modifieringen av processerna för tillsats och avlägsnande av acetylgrupper till DNA är ett aktivt område inom forskningen om cancerbehandling.
Mer om epigenetiska förändringar och cancerbehandlingar.
Orsaker till mutation
Som vi har sett skapas cancerceller från normala föregångsceller via en ackumulering av genetiska skador. Mekanismerna genom vilka förändringarna framkallas är varierande. I vid bemärkelse faller agenterna för genetisk förändring (mutation) främst in i de kategorier som beskrivs nedan och diskuteras ingående i följande avsnitt.
Spontana mutationer
Spontana mutationer: Baserna (A, T, G, C) i DNA förändras eller försvinner på grund av icke reparerade replikationsfel eller slumpmässiga molekylära händelser. Till exempel leder förlusten av en aminogrupp från cytosin, en normal bas som finns i DNA, till produktion av uracil, en bas som normalt inte finns i DNA. Om denna förändring inte upptäcks och återställs kan en mutation uppstå. Ibland kan en hel bas gå förlorad till följd av att bindningen mellan DNA-ryggen och basen klyvs. Detta leder till en lucka i DNA-dubbelhelixen som, om den inte repareras, kan leda till en mutation nästa gång DNA kopieras (dvs. under replikationen).
Inducerade mutationer
Inducerade mutationer: Mutationer kan framkallas genom att organismer (eller celler) utsätts för olika behandlingar. Några av de vanligaste är:
Bestrålning- Strålning är en av de första kända mutagena ämnena och är en kraftfull mutationsframkallare. Olika typer av strålning orsakar olika typer av genetiska förändringar. Ultraviolett (UV) strålning orsakar punktmutationer. Röntgenstrålning kan orsaka brott i DNA-dubbelhelixen och leda till translokationer, inversioner och andra typer av kromosomskador. Exponering för UV-strålar i solljus har kopplats till hudcancer. Observera att strålningens DNA-skadande egenskaper har utnyttjats i flera olika strålningsbaserade cancerbehandlingar.
Nedan visas en typ av mutation som orsakas av ultraviolett strålning. I det här exemplet leder bombardemanget av DNA:s dubbelhelix med UV-strålar till att två baser förenas. Detta förändrar DNA:s struktur och kan leda till permanenta förändringar om det inte repareras.
En annan typ av strålning är den energi som avges av naturligt förekommande radioaktiva element (som radon och uran) eller av människan skapade källor som de som finns (och skapas) i kärnreaktorer. Strålning av denna typ finns i olika typer och kan orsaka olika typer av skador på celler och vävnader. Strålning kan direkt skada DNA eller orsaka bildning av kemikalier (dvs. reaktiva syrearter eller ROS) som sedan kan skada DNA eller andra cellkomponenter.
Exponering för strålning från radioaktiva material har dokumenterats väl. Analyser av överlevande från atombomberna som släpptes över Japan under andra världskriget visade stora ökningar av leukemier kort efter exponeringen och sedan ökningar av andra cancertyper under de följande decennierna.8
Farliga mängder radioaktivt material har också oavsiktligt släppts ut från kärnkraftverk. Strålningsexponering till följd av det oavsiktliga utsläppet av radioaktivt material från kärnkraftsreaktorn i Tjernobyl har förknippats med ökningar av sköldkörtelcancer och andra elakartade cancerformer.9
Medicinska bilddiagnostikmaskiner (som röntgenapparater och datortomografer) utsätter också patienterna för strålning. De mängder som används vid ett enskilt test anses inte orsaka betydande mängder cancer, men den långsiktiga effekten av många tester under flera år är oklar.10 På samma sätt anses flygpassagerares exponering för helkroppsskanning på flygplatser inte innebära någon risk för cancer.11 Passagerare som flyger i flygplan utsätts också för strålning från rymden, men på en låg nivå och anses inte utgöra någon cancerrisk, inte ens för flygbesättningsmedlemmar.1112
Kemiska mutagena ämnen- Många olika kemikalier är kända för att orsaka mutationer. Dessa kemikalier utövar sin effekt genom att binda till DNA eller DNA:s byggstenar och störa replikerings- eller transkriptionsprocesserna. Några exempel på potenta mutagena ämnen är benso-a-pyren, en kemikalie som finns i cigarettrök, och aflatoxin, ett mutagen som oftast hittas på felaktigt förvarade jordbruksprodukter.
Kronisk inflammation- Kronisk inflammation kan leda till DNA-skador på grund av att cellerna i immunsystemet producerar mutagena kemikalier. Ett exempel är den långvariga inflammation som orsakas av infektion med hepatitvirus. Läs mer om virus och cancer.
Syreradikaler- Vid infångandet av energi från maten, som sker i våra mitokondrier, kan det bildas kemikalier som är mycket reaktiva och som kan skada cellmembran och själva DNA. Dessa reaktiva syrgasintermediärer (ROI) kan också genereras när celler utsätts för strålning, vilket visas nedan.
Den mutagena aktiviteten hos ROI är förknippad med utvecklingen av cancer samt med aktiviteterna hos flera cancerbekämpande behandlingar, inklusive strålning och kemoterapi. 131415
Abnormal celldelning
Under mitos är det möjligt att celldelningsprocessen misslyckas med att dela upp de replikerade kromosomerna korrekt i två dotterceller. Ett fel av denna typ leder till produktion av aneuploida celler. Cellerna kommer antingen att sakna eller ha fått ett betydande antal gener. Denna sällsynta process kan skapa celler som är mer benägna till oreglerad celldelning. Som tidigare nämnts är en stor andel av de cancerformer som isolerats från människor aneuploida.
Om en cell har en mutation i en gen vars proteinprodukt ansvarar för att ”kontrollera” delningsprocessen, kan saker och ting snabbt hamna utom kontroll och dottercellerna från varje delning kan bli alltmer onormala.
Virus som mutagena ämnen
Virus tros vara ansvariga för en betydande andel av cancerfallen. Virus kan orsaka cancer på olika sätt och det är troligt att varje virustyp fungerar på lite olika sätt. Vissa virus (inklusive många retrovirus) kan orsaka mutationer genom att föra in sina gener i den infekterade cellens arvsmassa. Det infogade DNA:t kan förstöra eller ändra aktiviteten hos berörda gener.161718
Virus kan också orsaka mutationer på indirekta sätt. Som ett exempel kan nämnas följande: En infektion med hepatitvirus kan pågå i många år. Under den tiden försöker kroppens försvarssystem göra sig av med viruset genom att producera giftiga kemikalier. Dessa kemikalier kan skada annars friska ”bystander”-celler och skicka dem på den väg som leder till cancer. Det finns många andra sätt som virus kan orsaka cancer.1920
På grund av virusens betydelse för utvecklingen av många cancerformer har vi skapat ett avsnitt om virus och cancer.
Transposoner som mutagena ämnen
Transposoner är korta DNA-sekvenser som har förmågan att förflytta sig från en plats i DNA till en annan plats. Transposoner kodar för ett enzym, transposas, som agerar för att skarva transposonen till nya platser i ett genom (se schematisk bild nedan till vänster av en transposon) Transposoner upptäcktes av Barbara McClintock och hon fick Nobelpriset för sitt arbete.2122 Det mänskliga genomet innehåller många inaktiverade kopior av transposoner som har förlorat sin förmåga att flytta eller ”hoppa” till nya platser. Ungefär 50 % av det mänskliga genomet består av ”döda” transposoner.23
Förflyttningen av aktiva transposoner kan leda till mutationer och förändra genernas aktivitet. Ett synligt exempel på transposonrörelse (kallad transposition) är färgen på kärnorna i indisk majs (se nedan till höger). De transposoner som är aktiva hos människor tros vara inblandade i mänskliga sjukdomar, inklusive cancer242526.


Mutationssammanfattning
Genisk förändring (mutation) Introduktion
- De onormala beteenden som uppvisas av cancerceller är resultatet av en serie mutationer i viktiga reglerande gener (dvs. DNA-reparationsgener).
- De flesta cancerformer tros uppkomma från en enskild föregångscell som förvärvar tillräckliga mutationer för att bli en cancercell.
DNA-mutationer
- Genförändringar kan vara små och påverka endast en eller några få nukleotider (punktmutationer) eller så kan de vara ganska stora och förändra strukturen hos en kromosom eller kromosomer.
- Punktmutationer
- Translation är produktionen av ett protein med hjälp av enzymer som ”läser” tre nukleotiska ”ord” (kodoner) längs ett messenger RNA (mRNA).
- Även om man ändrar en enda nukleotid längs DNA:t i en gen kan det leda till ett helt icke-funktionellt protein. Mutationerna grupperas efter de förändringar de skapar i den resulterande proteinprodukten från den drabbade genen.
- Nonsense-mutationer – Det nya (muterade) kodonet leder till att proteinsyntesen stoppas i förtid.
- Missense-mutationer – Det ändrade kodonet leder till att en felaktig aminosyra läggs in i proteinet.
- Frameshift-mutationer – Förlusten eller ökningen av en eller två nukleotider i ett mRNA gör att kodonerna läses fel. Leder ofta till förkortade och icke-funktionella proteiner.
- Förändringar på kromosomnivå
- Translokationer – Brytning och (ibland) utbyte av kromosomfragment.
- Genamplifiering – Onormal replikation skapar flera kopior av en region av en kromosom. I slutändan leder detta till överproduktion av motsvarande proteiner.
- Inversioner – DNA-segment frigörs från en kromosom och återinförs sedan i motsatt riktning.
- Duplikationer/eletioner – En gen eller en grupp av gener kan försvinna helt eller kopieras mer än en gång inom en kromosom.
- Aneuploidi – En genetisk förändring som innebär förlust eller ökning av hela kromosomer.
- Spontana mutationer kan uppstå på grund av icke reparerat DNA eller slumpmässiga molekylära händelser.
- Aneuploidi är mycket vanligt i cancerceller.
Epigenetiska förändringar
- Genuttryck kan ändras genom förändringar i DNA och kromatin som inte ändrar den genetiska sekvensen. Exempel är DNA-metylering och acetylering av histoner.
- Metylering – Vissa nukleotider i DNA modifieras genom tillsats av en metylgrupp som är förknippad med inaktivering av den regionen av DNA
- Acetylering – Tillsats av acetylgrupper luckrar upp DNA och ökar genuttrycket.
Inducerade mutationer
- Mutationer kan induceras genom att organismer (eller celler) utsätts för en rad olika behandlingar:
- Bestrålning – UV-strålar orsakar punktmutationer och röntgenstrålar orsakar flera former av skador.
- Kemiska mutagena ämnen – Kan binda till DNA eller DNA:s byggstenar och störa replikerings- eller transkriptionsprocesserna
- Kronisk inflammation – DNA-skador på grund av produktion av mutagena kemikalier av cellerna i immunförsvaret
- Syreradikaler – Uppstår vid en cells energiproduktion och kan skada DNA.
Andra genetiska förändringar
- Avvikande celldelning som resulterar i felaktig delning av kromosomerna kan leda till aneuploidi.
- Virus kan orsaka genetiska skador på flera olika sätt och är förknippade med ett stort antal cancerformer.
Mutation och cancer
- Det verkar som om övergången från en normal, frisk cell till en cancercell är en stegvis utveckling.
- Cancerutveckling kräver genetiska förändringar i flera olika onkogener och tumörsuppressorer.
- Alla cancerformer måste övervinna samma spektrum av regleringsfunktioner för att kunna växa och utvecklas, men de inblandade generna kan skilja sig åt.
- Cancerens heterogenitet komplicerar diagnos och behandling.
- Det är möjligt att ärva dysfunktionella gener som leder till utveckling av en familjär form av en viss cancertyp.
Känn flödet: Mutation
Känn flödet är ett interaktivt spel där du kan testa dina kunskaper. Så här spelar du:
- Släpp de lämpliga valen från kolumnen till höger och placera dem i ordning i rutorna till vänster. Observera att du bara kommer att använda fem av de sex valen för att slutföra spelet.
- När du är klar klickar du på ”Kontrollera” för att se hur många du fick rätt.
- För felaktiga svar klickar du på ”Beskrivning” för att se information om processerna.
- Om du vill försöka igen väljer du ”Återställ” och börjar om från början.
-
1
-
2
-
3
-
4
-
5
-
Lär dig merEn cell håller på med DNA-syntes
-
Lär dig merMånga kopior av en del av en kromosom görs
-
Lär dig merTranskribering av amplifierade gener
-
Lär dig merTranskribering av amplifierade gener
-
Lär dig merOverproduktion av en nyckel protein leder till tillväxt av läkemedelsresistent tumör
-
Lär dig merDuplicering förekommer
Spela igen
- 1. Urry, L. A., Cain, M. L., Wasserman, S. A., Minorsky, P. V., & Reece, J. B. (2017). Campbell Biology (11th ed.). Pearson.
- 2. Surveillance, Epidemioloy, and End Results (SEER) representerat av National Cancer Institute
- 3. Hahn WC, Counter CM, Lundberg AS, Beijerbergen RL, Brooks MW, Weinberg RA. ”Skapande av mänskliga tumörceller med definierade genetiska element”. Nature 400: 464-468
- 4. Welch JS, Ley TJ, Link DC, Westervelt P, Walter MJ, Graubert TA, DiPersio JF, Ding L, Mardis ER, Wilson RK et al. The origin and evolution of mutations in acute myeloid leukemia. Cell, 20 juli 2012
- 5. Brégeon D, Doetsch PW. Transkriptionell mutagenes: orsaker och inblandning i tumörutveckling. Nat Rev Cancer. 2011 Mar;11(3):218-27.
- 6. Nowell PC, Hungerford DA. ”Kromosomstudier på normala och leukemiska mänskliga leukocyter”. J Natl Cancer Inst (1960). 25: 85-100.
- 7. Rowley JD. ”En ny konsekvent kromosomavvikelse vid kronisk myeloisk leukemi identifierad med hjälp av kinakrinfluorescens och Giemsa-färgning”. Nature (1973). 243: 290-293.
- 8. Ozasa K, Shimizu Y, Sakata R, Sugiyama H, Grant EJ, Soda M, Kasagi F, Suyama A. Risken för cancer och andra sjukdomar som inte är cancerrelaterade hos dem som överlevt en atombomb. Radiat Prot Dosimetry. 2011 Apr 18.
- 9. Cardis E, Hatch M. Tjernobylolyckan – ett epidemiologiskt perspektiv. Clin Oncol (R Coll Radiol). 2011;23(4):251-260. doi:10.1016/j.clon.2011.01.510 Mar 9.
- 10. Fazel R, Krumholz HM, Wang Y, Ross JS, Chen J, Ting HH, Shah ND, Nasir K, Einstein AJ, Nallamothu BK. Exponering för lågdos joniserande strålning från medicinska avbildningsförfaranden. N Engl J Med. 2009 Aug 27;361(9):849-57.
- 11. a. b. Mehta P, Smith-Bindman R. Airport Full-Body Screening: Vad är risken? Arch Intern Med. 2011 Mar 28.
- 12. Bagshaw M. Cosmic radiation in commercial aviation. Travel Med Infect Dis. 2008 May;6(3):125-7. Epub 2007 Nov 26.
- 13. Kang DH. ”Oxidativ stress, DNA-skador och bröstcancer”. AACN Clin Issues. (2002). 13:540-549
- 14. Athar M. ”Oxidativ stress och experimentell karcinogenes”. Indian J. Exp. Biol. (2002). 40:656-667
- 15. Marnett LJ. ”Oxiradikaler, lipidperoxidation och DNA-skador”. (2002)181-182:219-222
- 16. Nair V. Retrovirusinducerad onkogenes och säkerhet hos retrovirala vektorer. Curr Opin Mol Ther. 2008 Oct;10(5):431-8.
- 17. Brady G, Macarthur GJ, Farrell PJ. Epstein-Barr-virus och Burkitt-lymfom. Postgrad Med J. 2008 Jul;84(993):372-7.
- 18. Ruprecht K, Mayer J, Sauter M, Roemer K, Mueller-Lantzsch N. Endogena retrovirus och cancer. Cell Mol Life Sci. 2008 Nov;65(21):3366-82.
- 19. Lupberger J, Hildt E. Hepatitis B-virusinducerad onkogenes. World J Gastroenterol. 2007 Jan 7;13(1):74-81.
- 20. Castello G, Scala S, Palmieri G, Curley SA, Izzo F. HCV-relaterat hepatocellulärt karcinom: Från kronisk inflammation till cancer. Clin Immunol. 2010 Mar;134(3):237-50. Epub 2009 Nov 11.
- 21. McClintock B. The origin and behavior of mutable loci in maize. Proc Natl Acad Sci U S A. 1950 Jun;36(6):344-55.
- 22. McClintock, Barbara Nobelprisföreläsning
- 23. Burns KH, Boeke JD. Human transposon tectonics. Cell. 2012 May 11;149(4):740-52.
- 24. Kozeretska IA, Demydov SV, Ostapchenko LI. Mobila genetiska element och cancer. Från mutationer till genterapi. Exp Oncol. 2011 Dec;33(4):198-205.
- 25. Solyom S, Kazazian HH Jr. Mobila element i det mänskliga genomet: konsekvenser för sjukdomar. Genome Med. 2012 Feb 24;4(2):12.
- 26. Iskow RC, McCabe MT, Mills RE, Torene S, Pittard WS, Neuwald AF, Van Meir EG, Vertino PM, Devine SE. Naturlig mutagenes av mänskliga genomer genom endogena retrotransposoner. Cell. 2010 Jun 25;141(7):1253-61.