Aunque el dengue fue en su día una enfermedad periódica que provocaba epidemias de larga duración, hoy en día se considera la enfermedad vírica transmitida por mosquitos más importante del mundo . Cada año se registran entre cincuenta y cien millones de casos de dengue en todo el mundo. Medio millón de estos casos dan lugar a la forma más grave del dengue (DF), conocida como fiebre hemorrágica del dengue (DHF). La FHD es una enfermedad que afecta predominantemente a niños menores de 15 años y se caracteriza por la aparición repentina de fiebre, trombocitopenia y síndrome de fuga vascular . La FHD se produce debido a una infección por el virus del dengue, que forma parte de la familia Flaviviridae . El virus es un ARN de sentido positivo, icosaédrico y monocatenario. El núcleo del icosaedro tiene entre cuarenta y cincuenta nanómetros de diámetro y contiene la proteína C que encapsula el genoma viral . Dos proteínas virales, M y E, que componen la envoltura lipídica, rodean el núcleo . La infección está causada por uno de los cuatro serotipos del virus del dengue (DENV): DENV-1, DENV-2, DENV-3 y DENV-4 . La infección por uno de los serotipos no proporciona inmunidad contra la infección por los otros serotipos.
Si una persona que ha sido infectada previamente se infecta de nuevo, tiene un mayor riesgo de desarrollar el síndrome de shock del dengue (SSC) y la FHD, que provoca el debilitamiento y la ruptura de la vasculatura y la hemorragia interna . Los anticuerpos no neutralizantes pueden potenciar la captación del virus por parte de las células que expresan receptores Fc, lo que permite una potenciación dependiente de anticuerpos en la FHD . Varias especies de Aedesmosquitos son vectores del virus del dengue y lo transmiten al picar a un huésped humano . El Aedes aegypti, un pequeño mosquito tropical y subtropical de color blanco y negro que se encuentra en América Central, América Latina, el sudeste asiático y el Pacífico occidental, es el principal vector.
Epidemiología
Hoy en día, la FHD está considerada internacionalmente como la enfermedad vírica más importante transmitida por mosquitos. Es endémica en más de 100 países del mundo, especialmente en las regiones tropicales y subtropicales. En los Estados Unidos, el Aedes aegyptispecies causante de la FHD puede encontrarse estacionalmente en Luisiana, el sur de Florida, Nuevo México, Arizona, Texas, Georgia, Alabama, Misisipi, Carolina del Norte y del Sur, Kentucky, Oklahoma y Tennessee . En los últimos 50 años, la incidencia del dengue se ha multiplicado por 30 .
Según la Organización Mundial de la Salud (OMS), se estima que se producen entre 50 y 100 millones de infecciones de dengue al año. De estos casos, 500.000 evolucionan a FHD y provocan 22.000 muertes, sobre todo de niños. Según los datos oficiales presentados a la OMS, los casos de dengue en las Américas, el Sudeste Asiático y el Pacífico Occidental superaron los 1,2 millones en 2008 y más de 3 millones en 2013. En 2013, se notificaron 2,35 millones de casos de dengue solo en las Américas, de los cuales 37, 687 casos fueron de FHD . Después de la primera epidemia conocida de FHD en 1953 a 1954 en Filipinas, la enfermedad continuó extendiéndose por el sudeste asiático .
Durante los años 50, 60 y la mayor parte de los 70, la epidemia de dengue fue poco frecuente en la mayor parte de América del Sur y Central porque el principal mosquito vector, el Aedes aegypti, fue erradicado. Sin embargo, una vez que se detuvo la eexterminación, el Aedes aegypti comenzó a reinvadir esas regiones. En 1997, el Aedes aegypti y el virus del dengue volvieron a tener una distribución mundial, (Figuras 1,2). Según la OMS, en la actualidad hay más de 2.500 millones de personas que viven en zonas donde el dengue/fiebre hemorrágica es endémico y corren el riesgo de infectarse con el virus del dengue. Hay varios factores que contribuyen a la transmisión del virus por parte del Aedes aegypti, como la temperatura, las precipitaciones, la migración del campo a la ciudad, el crecimiento de la población, el agua almacenada y el aumento de los residuos sólidos, que permiten la creación de hábitats larvarios para el vector. También puede haber brotes de FHD asociados a los viajes. El dengue es la infección por arbovirus más extendida en todo el mundo.
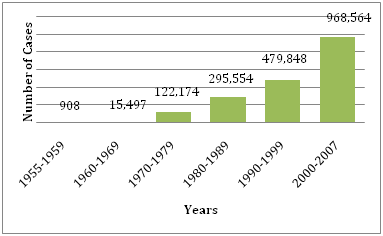
Figura 1: Número medio de DF/DHF notificados a la OMS en los años indicados .
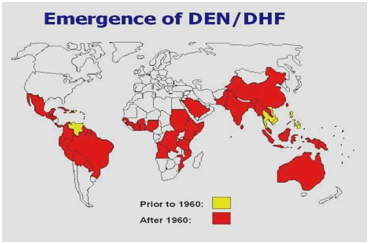
Figura 2: Distribución del dengue/la fiebre hemorrágica del dengue en las Américas, el Caribe, África y Oriente Medio.
Factores de riesgo para la DF y la transmisión del virus del dengue
El dengue es una importante enfermedad viral transmitida por artrópodos . Las investigaciones demuestran que el género Aedes, principalmente los mosquitos Aedes aegypti y Aedes albopictus, se han adaptado a vivir cerca de zonas habitadas y son responsables de la transmisión del dengue. Los mosquitos se alimentan durante el día y prefieren a los seres humanos antes que a otros animales. El Aedes aegypti es el mosquito que más se alimenta de sangre humana, con un 76,9%, seguido por el Aedes albopictus y el Aedes vittatus, con un 75% y un 33,3% respectivamente. La incidencia de la DF se ha asociado con la cantidad de vegetación, la cobertura arbórea, la calidad de las viviendas y la superficie de terreno circundante.
Además de los criaderos creados por el hombre, también se ha demostrado que el clima influye en la ecología del dengue al afectar a la dinámica del vector, el desarrollo del agente y la interacción entre el mosquito y el ser humano.13 La temperatura ayuda a influir en las tasas de desarrollo del vector, la mortalidad y el comportamiento, y controla la replicación viral dentro del vector. Los climas cálidos permiten el desarrollo larvario y una mayor velocidad de replicación del virus, mientras que los climas fríos ralentizan el desarrollo viral y disminuyen el tiempo de supervivencia de los mosquitos, con lo que se reduce la posibilidad de un vector infeccioso y disminuye la transmisión del dengue . La temperatura también interactúa con las precipitaciones como principal regulador de la evaporación, por lo que afecta directamente a la disponibilidad de hábitats acuáticos e indirectamente a la cubierta y el uso del suelo, lo que puede promover o impedir el crecimiento de las poblaciones de vectores.
Los cambios demográficos y sociales, como el crecimiento de la población, la urbanización y el transporte moderno, contribuyen en gran medida al aumento de la incidencia y la propagación geográfica de la actividad del dengue . A medida que los viajeros se desplazan desde las zonas endémicas, tienden a servir de vehículos para una mayor propagación . La virulencia de las cepas virales y la variación genética del virus del dengue también se prestan a un mayor potencial de transmisión epidémica de la FHD .
Patogénesis del dengue hemorrágico
Cuando el mosquito se alimenta del huésped humano, inyecta el virus del dengue (DENV) en el torrente sanguíneo y en la epidermis y dermis circundantes. Esto da lugar a la infección de las células de Langerhans inmaduras y los queratinocitos a través de la endocitosis mediada por receptores . La proteína E, la proteína de superficie, se reconfigura y permite la fusión de la membrana y la liberación del ARN viral en la célula infectada. Las proteínas no estructurales, NS1 y NS2A, controlan la replicación del ARN viral y la NS1 también puede estar implicada en la activación de la cascada del complemento. Las células infectadas pueden morir por apoptosis o necrosis o migrar a los ganglios linfáticos donde se reclutan macrófagos, (Figura 3). La infección por cualquiera de los cuatro serotipos del dengue (DENV-1 a DENV-4) puede ser asintomática en la mayoría de los casos, ya que el sistema inmunitario del huésped es capaz de neutralizarla localmente, pero también puede causar un espectro de manifestaciones clínicas, siendo la forma más grave la FHD, que puede progresar hasta la SSE y la muerte . La FHD se define clínicamente como una fiebre continua de 2 a 7 días con manifestaciones hemorrágicas en las mucosas o en la piel, asociada a una trombocitopenia (<100.000 células/mm3) y un hematocrito superior al 20% por encima del valor de referencia del paciente o de la población de la misma edad . Las características patológicas de la FHD son la fuga de plasma de las superficies pleurales o peritoneales y la coagulopatía intrínseca, que se mide clínicamente por una prueba de torniquete positiva o por la evidencia de una hemorragia espontánea, como petequias o equimosis, hemorragia gingival o epistaxis, o hemorragia gastrointestinal .

Figura 3: Tras la picadura del mosquito portador Aedes aegypti, las células de Langerhans y los queratinocitos inmaduros se infectan con el DENV. Las células infectadas pasan a la linfa, donde se reclutan macrófagos. Desde aquí, la infección se disemina a varios órganos, como el hígado, el bazo y la médula ósea. La necrosis de la médula ósea por el DENV puede provocar la supresión de la hematopoyesis y la disminución de la trombogénesis en la sangre . La respuesta inflamatoria, causada por la liberación de quimioquinas y citoquinas de los mastocitos, macrófagos y linfocitos, provoca un aumento de la permeabilidad vascular, una disfunción plaquetaria y una trombocitopenia y fuga de plasma . Aunque el mecanismo no se conoce bien, esta cascada también parece causar una hemorragia espontánea, que da lugar a las manifestaciones clínicas de petequias, hemorragia gingival y hemorragia gastrointestinal.
Esta forma grave de la enfermedad suele ser el resultado de una infección secundaria en la que el huésped se infecta con un segundo serotipo y se produce una compleja interacción entre el virus y la respuesta inmunitaria del huésped. Aunque no se conoce bien el mecanismo que provoca esta reacción, las pruebas sugieren que la infección previa puede crear anticuerpos de reacción cruzada que se unen al nuevo serotipo, pero que no son capaces de neutralizarlo . Esto se denomina teoría de la potenciación dependiente de anticuerpos (ADE). Se cree que los anticuerpos formados durante las infecciones anteriores contra las proteínas estructurales del DENV, como la proteína E o la prM, son incapaces de neutralizar el nuevo patógeno y, en cambio, conducen a una mayor unión a la célula positiva al receptor Fcγ que permite la replicación amplificada del virus . En respuesta, el sistema inmune libera una respuesta exagerada de citoquinas, lo que conduce a un aumento de la permeabilidad vascular y Coagulopatía .
Los mastocitos también han sido implicados en la patogénesis de la FHD. En algunos casos, los mastocitos parecen proporcionar una función protectora en la que se liberan moléculas antivirales por la granulación y se reclutan otras células inmunitarias, como los linfocitos T y las células asesinas naturales (NK), que ayudan a neutralizar el virus . Sin embargo, en otros casos, los mecanismos de control local no pueden contener el virus, y éste viaja a través del torrente sanguíneo o del sistema linfático para activar los mastocitos en otros órganos como el hígado, el bazo y los ganglios linfáticos . Cuando se produce la granulación en estos órganos, se liberan proteasas y se sintetizan mediadores inflamatorios, como los leucotrienos y el factor de crecimiento endotelial vascular (VEGF), que aumentan la permeabilidad de los capilares y provocan fugas de plasma . Esto es importante, ya que diferentes grupos de mastocitos liberan distintos mediadores durante el proceso de granulación. El complejo virus-anticuerpo, tal vez a través del antígeno NS1 del virus del dengue, y la producción de citoquinas también dan lugar a la activación del complemento. Se sabe que la liberación de fragmentos de C3a y C5a aumenta la permeabilidad vascular y, por tanto, contribuye a la fuga de plasma.
El tipo y la cantidad de citoquinas liberadas desempeñan un papel importante a la hora de dictar la gravedad de la enfermedad. La proteína inflamatoria de macrófagos 1β (MIP-1β) parece ser un indicador de una enfermedad menos grave, ya que la liberan las células mononucleares infectadas y las células NK activadas. Actúa como un quimioatrayente para más células NK, atrayéndolas al sitio inflamatorio, limitando la replicación viral y el efecto de las citocinas. Por otro lado, se ha demostrado que el interferón γ (IFN-γ) induce la fuga de plasma y aumenta la captación de partículas de dengue mediante el aumento de los receptores Fc en las células diana, por lo que se asocia a manifestaciones clínicas más graves y a un mal pronóstico. Otras citoquinas que se han encontrado aumentadas en la FHD y que han sido implicadas en la inducción de la fuga de plasma son la interleucina 2 (IL-2), el factor de necrosis tumoral α (TNF- α), el factor inhibidor de la migración de los macrófagos (MIF), la proteína quimiotáctica de monocitos-1 (MCP-1), la interleucina-8 (IL-8) y la caja de grupo de alta movilidad-1 (HMGB-1). Los efectos de la liberación de citocinas no se limitan a la permeabilidad vascular y la fuga de plasma, sino que también están implicados en las manifestaciones hemorrágicas de la FHD. Sin embargo, el mecanismo subyacente que causa la hemorragia en la FHD no se conoce bien. Aunque la mayoría de las células infectadas son propensas a la muerte por apoptosis, se produce cierta necrosis, que da lugar a la liberación de toxinas, que activan los sistemas de coagulación y fibrinolisis. Cuando se producen altos niveles de necrosis en la médula ósea debido a la elevada carga viral, se suprime la hematopoyesis, lo que da lugar a la trombolipenia. La disminución resultante de la trombogénesis y la disfunción plaquetaria pueden causar fragilidad capilar y las consiguientes manifestaciones clínicas observadas en la FHD . Algunos estudios indican que la afectación del hígado en la infección por el DENV puede estar implicada en la tendencia a la hemorragia espontánea, con una correlación entre los niveles elevados de enzimas hepáticas y la mayor tendencia a la hemorragia .
Signos y síntomas clínicos
La manifestación clínica de la enfermedad incluye la infección asintomática, la fiebre del dengue (FD) leve, la fiebre hemorrágica del dengue (FHD) o el síndrome de shock del dengue (SCD), que suele ser grave debido a la permeabilidad capilar anormal y la fuga de plasma . El dengue grave suele darse en pacientes que han sido infectados previamente por un virus del dengue (es decir, una infección secundaria). También se han notificado altas tasas de infección grave por dengue en bebés con infección primaria por el virus del dengue que nacen de madres que han sido infectadas previamente por un virus del dengue .
La fase inicial de la FHD aparece como fiebre del dengue. La sintomatología de esta fase inicial depende de la edad del paciente e incluye una fiebre alta y repentina (a veces con dos picos-apoyados), dolor de cabeza severo, disminución del apetito, mialgia severa y artralgia, una erupción cutánea maculopapular que aparece de tres a cuatro días después del inicio de la fiebre, dolor retro-orbital, fotofobia, linfadenopatía, hemorragias leves (epistaxis, hemorragia de las encías, hemorragia gastrointestinal, hematuria y menorragia) y una prueba de torniquete positiva . Los casos de FHD se caracterizan por cuatro manifestaciones clínicas principales, que son fiebre alta, fenómenos hemorrágicos y, a menudo, hepatomegalia e insuficiencia circulatoria. La enfermedad febril aguda característica de la fase inicial consiste en temperaturas superiores a 39°C y se mantienen así durante 2-7 días.
Los síntomas mencionados de la fase inicial empeoran progresivamente con fiebre y cefalea continuas, dolor o sensibilidad abdominal severa, vómitos persistentes, hematemesis, melena, petequias, fácil aparición de hematomas, inquietud, letargo, somnolencia, irritabilidad, hemorragias o hematomas bajo la piel . Tras 2-7 días de fiebre, un rápido descenso de la temperatura suele ir acompañado de signos de alteración circulatoria de gravedad variable. El paciente puede sudar, estar inquieto y tener las extremidades frías y mostrar cambios en la frecuencia del pulso y la presión arterial. Después de 24-48 horas de la aparición de las características específicas de la FHD, se observa que la hemostasia anormal y la fuga de plasma son los síntomas distintivos.
Un buen indicador de estos avances es un agrandamiento de más de 2 cm del hígado, ya que la hepatomegalia suele preceder a la fuga de plasma . Muchos pacientes se recuperan con o sin tratamiento de líquidos y electrolitos. En casos graves, la pérdida de plasma puede progresar hasta el shock y la muerte si no se trata . Las investigaciones sugieren que tanto una infección secundaria de dengue como la exagerada represalia de la respuesta del sistema inmunitario de citoquinas aumentan la predilección de un paciente por desarrollar FHD.
Se cree que los productos virales, como la glicoproteína NS1, influyen en la activación del complemento y en la permeabilidad vascular, lo que da lugar a fugas de plasma que se convierten en ascitis o derrames pleurales . La respuesta de las citoquinas también es responsable del aumento de la permeabilidad vascular, como consecuencia de lo cual se reduce la presión oncótica intravascular y se facilita la pérdida de líquido hacia los compartimentos extravasculares , (Figura 4). La hemostasia anormal consiste en una trombocitopenia concurrente con un aumento del hematocrito , un tiempo de tromboplastina parcial prolongado con una concentración de fibrinógeno reducida, junto con las petequias antes mencionadas, hemorragias gastrointestinales graves, equimosis y epistaxis .
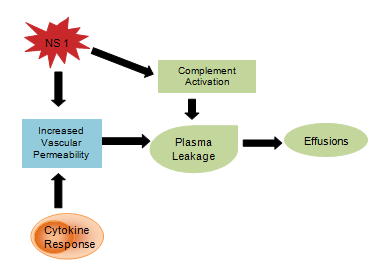
Figura 4: Respuesta del sistema inmunitario con citoquinas.
Durante la fase febril virémica de la FHD, se cree que la trombocitopenia y las manifestaciones posteriores se producen debido a la supresión de la médula ósea. Como se ha mencionado anteriormente, la supresión de la médula ósea es el resultado de ser un lugar de replicación del virus, y de atacar específicamente a las células progenitoras hematopoyéticas , Sin embargo, la destrucción de las plaquetas mediada por el sistema inmunitario también se sugirió por el descubrimiento de complejos virus-anticuerpos encontrados en las superficies de las plaquetas de los pacientes con FHD.
Las manifestaciones clínicas poco comunes incluyen hepatitis aguda, insuficiencia hepática, insuficiencia renal aguda, encefalopatía o cardiomiopatía (miocarditis aguda) . Un estudio sobre el DHF mortal en adultos analizó las causas de mortalidad distintas del síndrome de shock del dengue (DSS) en pacientes con dengue grave y concluyó que la hipotermia, la leucocitosis y la bandemia podrían ser signos desencadenantes del dengue grave. El estudio aconseja además a los médicos que sean conscientes del posible desarrollo de una hemorragia digestiva masiva, especialmente en los pacientes que presentan alteraciones tempranas de la conciencia, trombocitopenia profunda, TP prolongado y/o leucocitosis.
Diagnóstico, tratamiento y manejo
El diagnóstico temprano y preciso es fundamental para una atención clínica adecuada. Hay muchos métodos en los que se puede hacer el diagnóstico del dengue. El diagnóstico puede realizarse mediante el aislamiento del virus, el ácido nucleico viral, los anticuerpos y los antígenos, o una combinación de todas estas técnicas. La detección del virus del dengue mediante cultivo es la prueba diagnóstica definitiva, pero las consideraciones prácticas limitan su uso. La detección del ARN viral es más rápida, pero la contaminación puede dar lugar a un resultado falso positivo. Además, la prueba serológica puede producir un resultado falso positivo debido a los anticuerpos de reacción cruzada .
Las infecciones agudas se detectan en suero, plasma y células sanguíneas circulantes durante la fase de convalecencia temprana, que son los 5-8 días iniciales de los síntomas. En este momento, la carga viral primaria puede ser de hasta 103 partículas de ARN/ml o superior a 106 partículas de ARN/ml en las infecciones secundarias. En la actualidad, la combinación de las pruebas de antígeno NS1 y de anticuerpos, así como los métodos moleculares, como la reacción en cadena de la polimerasa con transcripción inversa en tiempo real (RT-PCR), se están utilizando con más frecuencia para el diagnóstico, ya que pueden ofrecer resultados más rápidos y pueden ser más sensibles. El análisis inmunohistoquímico y la inmunofluorescencia también confirman la presencia del virus mediante antígenos virales. Los anticuerpos IgM son los primeros en aparecer en los primeros 3-5 días de la infección .
Se encuentran en niveles máximos 2 semanas después de la aparición de los síntomas y luego disminuyen generalmente hasta niveles indetectables después de 30-60 días . Los anticuerpos IgG, que son más reactivos, se detectan en niveles bajos después de los 7-9 días iniciales de los síntomas, aumentan lentamente hasta cuadruplicarse y siguen siendo detectables después de varios meses y posiblemente incluso de por vida . El antígeno humano y la respuesta de los anticuerpos dependen del estado inmunitario del huésped y sólo están presentes durante la infección primaria o secundaria. No existen tratamientos específicos ni medicamentos antivirales para el dengue. La fisiopatología del dengue aumenta la permeabilidad vascular, lo que conduce a una pérdida significativa de plasma del compartimento intravascular al espacio extravascular.
Esta pérdida de líquido puede conducir a un shock y, sin una corrección adecuada, conducirá a la hipoxia, a la acidosis metabólica y, finalmente, a la muerte. Por lo tanto, el tratamiento primario requiere cuidados de apoyo en el hospital con equilibrio de fluidos y electrolitos. El volumen celular empaquetado debe ser monitorizado cada hora cada 4-6 horas. La pérdida significativa de plasma se define como un aumento >20% del volumen celular empaquetado o del hematocrito. Una vez que el paciente alcanza estos niveles, es necesaria una reposición de volumen rápida y agresiva .
La tasa de reposición de líquidos en infusión depende del volumen celular empaquetado y de la diuresis. Existen múltiples fluidos utilizados para la reposición de la pérdida de plasma, incluyendo la solución salina fisiológica, el lactato de Ringer o el acetato de Ringer, la solución de glucosa diluida al 5%, el plasma o los sustitutos del plasma como la dextrina 40 y la sangre entera fresca . Además de la reposición de líquidos por vía intravenosa, pueden introducirse electrolitos por vía oral, ya que esto aliviará parte de la sed y la deshidratación de la fiebre. Pueden utilizarse analgésicos de apoyo, como el paracetamol, para tratar la fiebre y otros síntomas. Deben evitarse los AINE y la aspirina, ya que podrían precipitar el síndrome de Reye.
Al recuperarse los pacientes con FHD deben cumplir los siguientes criterios antes del alta hospitalaria: mejoría clínica visible, afebril sin el uso de antipiréticos durante >24 horas, aumento del apetito, hematocrito estable, diuresis adecuada, tres días después de la recuperación de la acidosis metabólica grave, recuento de plaquetas >50.000/mm3 y ausencia de dificultad respiratoria por derrame pleural o ascitis .
Prevención y erradicación del aedes aegypti
El aedes aegypti, el vector más prevalente del virus del dengue, es el principal objetivo de las actividades de vigilancia y control. Otros vectores, como el Aedes albopictus, pueden producir dengue, pero las actividades de vigilancia y control de los distintos vectores sólo deben considerarse si hay pruebas fiables de que esos vectores desempeñan un papel epidemiológicamente significativo en la transmisión de las infecciones por dengue . La primera iniciativa para eliminar el Aedes aegypti fue en Cuba en 1901. La fumigación y la eliminación de los focos de mosquitos mediante la destrucción de contenedores abandonados fueron los primeros pasos para erradicar el vector . Después de que se produjeran brotes de fiebre amarilla en Brasil en 1928 y 1932, se hizo evidente que la protección completa de las poblaciones urbanas dependía de la erradicación absoluta del Aedes aegyptimosquito; esto llevó a la aprobación por parte de la Organización Panamericana de la Salud (OPS) del plan continental de erradicación del Aedes aegypti en 1947 para combatir la fiebre amarilla urbana . Desde 1947, la Oficina Sanitaria Panamericana (OSP) promovió intensamente las campañas en todos los países afectados, y su éxito quedó demostrado en 1962, cuando 18 países continentales y varias islas del Caribe habían logrado la erradicación. Como resultado de estos esfuerzos, el genotipo V del DENV-2 americano es el único virus del dengue que permanece en la actualidad .
A pesar de los esfuerzos por erradicar el vector, el Aedes aegypti no fue erradicado en Cuba, Estados Unidos, Venezuela y varios países del Caribe . Décadas de esfuerzos humanos sin precedentes para erradicar el Aedes aegyptif se desmoronaron muy rápidamente y condujeron a la infestación. La falta de vigilancia y el deterioro de la estructura de los programas de erradicación, el insuficiente saneamiento ambiental y la escasa participación de la comunidad fueron algunos de los factores que condujeron al declive de los esfuerzos por erradicar el vector . A día de hoy, no hay ninguna vacuna disponible para prevenir las infecciones de dengue . Takeda Vaccines Inc. está desarrollando una vacuna candidata viva y atenuada, conocida como vacuna tetravalente contra el dengue (TDV), que se compone de una cepa atenuada del DENV-2 (TDV-2) y de tres virus quiméricos que contienen los genes de las proteínas prM y E del DENV-1, -3 y -4 que se expresaron en el contexto de la columna vertebral del genoma atenuado del TDV-2 (TDV-1, TDV-3 y TDV-4, respectivamente). La vacuna ha demostrado ser bien tolerada e inmunógena en un ensayo clínico de fase 2 en países donde el dengue es endémico entre adultos y niños.
La vacuna está en fase 3 de desarrollo . Además, Sanofi Pasteur ha desarrollado una vacuna tetravalente contra el dengue recombinante y atenuada en vivo (CYD-TDV) que ha demostrado una seguridad y eficacia consistentes en individuos de ≥9 años en países endémicos; se encuentra en la fase final de desarrollo . Dengvaxia (CYD-TDV) de Sanofi Pasteur fue registrada por primera vez en México en diciembre de 2015 y ha sido evaluada como una serie de 3 dosis en un esquema de 0/6/12 meses en estudios clínicos de fase III . Hay aproximadamente cinco candidatos a vacunas adicionales que se están evaluando en ensayos clínicos . Los viajeros a las zonas endémicas de dengue corren el riesgo de contraer el dengue; por lo tanto, para la prevención, deben ser alentados a seleccionar alojamientos con ventanas y puertas bien protegidas, usar repelente de insectos, usar ropa adecuada y vaciar y cubrir cualquier agua estancada que pueda convertirse en sitios de reproducción de mosquitos .
Situación mundial actual
Actualmente, se espera que la incidencia del dengue siga aumentando debido a muchos factores, como la situación socioeconómica, el continuo cambio climático, los viajes y la globalización. Las vacunas están todavía en desarrollo y no existe actualmente ninguna terapia antiviral específica para hacer frente a la creciente amenaza del dengue . La estimación mundial de la incidencia del dengue se sitúa entre 50 y 200 millones. Sin embargo, el uso de enfoques cartográficos sugiere recientemente que la cifra de la incidencia está más cerca de los 400 millones . En 2012, la OMS clasificó el dengue como una de las enfermedades virales vitales transmitidas por mosquitos . Esta clasificación se justifica por la importante propagación geográfica del virus junto con su vector a zonas que antes no estaban afectadas (Figura 5).
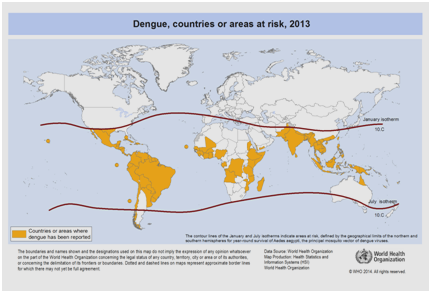
Figura 5: Países o zonas del mundo donde se registró el dengue en 2013, según los datos recogidos por la Organización Mundial de la Salud .
También se apoya en el coste que la enfermedad conlleva. Si se compara la carga del dengue con la de otras enfermedades transmisibles en la región afectada, el dengue causa mucho más sufrimiento humano y es una carga mayor que las otras enfermedades transmitidas por vectores. Según la OMS, el dengue es la principal causa de hospitalización y muerte de niños en el sudeste asiático. Un estudio de Hammond et al. informó de que la mayor parte de la morbilidad y la mortalidad relacionadas con esta enfermedad están asociadas a los niños más que a cualquier otro grupo de edad. Los bebés de entre 4 y 9 meses de edad y los niños de entre 5 y 9 años soportan la mayor carga de dengue (Figura 6). La gravedad de la enfermedad en estos niños suele deberse a una infección secundaria por el DENV . Un estudio ecológico realizado por Dıaz-Quijano y Waldman en América Latina y el Caribe encontró que los determinantes de la tasa de mortalidad por dengue en estas poblaciones incluían la duración de la endemicidad reconocida, la densidad de población y las precipitaciones .
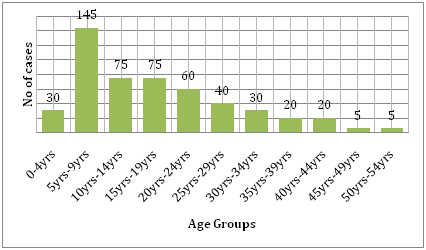
Figura 6: Distribución de la edad de la cohorte de estudio en León por grupos de edad .
Además del impacto de la morbilidad y la mortalidad, el virus del dengue conlleva una alta carga financiera para las regiones afectadas, muchas de las cuales están mal equipadas para soportar estos costes. En 2010, la carga financiera del virus del dengue se estimó en 2.100 millones de dólares por año en promedio en las Américas (en dólares estadounidenses de 2010), con un rango de 1.000 a 4.000 millones de dólares en los análisis de sensibilidad y una variación sustancial de un año a otro . Según la OMS, el dengue se considera ahora una preocupación mundial, y la región de Asia-Pacífico es la que cuenta con la mayor población mundial (75%) expuesta al virus del dengue. El Pacífico occidental también ha experimentado un aumento continuo del número de casos de DF notificados en la última década .
Incluso con la ausencia de transmisión de DF en la mitad del siglo XX, ahora hay la presencia de un aumento de la endemia de DF indígena en las Américas. Sólo en América, en 2010, se registraron más de 1,6 millones de casos de dengue y 49.000 de ellos fueron dengue grave . En África, los brotes de DF están aumentando en tamaño y frecuencia, pero no se notifican sistemáticamente a la OMS. Entre 1960 y 2010, 22 países africanos notificaron casos esporádicos según los datos disponibles sobre brotes . En Europa, no se han notificado epidemias de DF desde un brote en Grecia en 1928. Ahora hay amenazas de brote en Europa, que se ha atribuido al Aedes albopictus debido a los viajes desde países donde la enfermedad es endémica. Se estima que habrá un aumento de la incidencia de la enfermedad en los próximos años debido a factores de riesgo multifactoriales.