US Pharm. 2009;34(2):25-27.
Les maladies cardiovasculaires (MCV), principale cause de décès dans le monde, impliquent des mécanismes qui n’ont pas encore été entièrement compris. Bien que les lipides plasmatiques soient biologiquement nécessaires à la synthèse des membranes cellulaires et à la production d’hormones et qu’ils soient une source d’acides gras libres, la dyslipidémie est depuis longtemps liée à une incidence accrue de MCV, d’accidents vasculaires cérébraux et de maladies artérielles périphériques1.
Strattification traditionnelle du risque
L’approche actuelle du traitement de la dyslipidémie est spécifiée dans le National Cholesterol Education Program Adult Treatment Panel (ATP) III.2 Dans l’ATP III, les facteurs de risque et la stratification ultérieure du risque sont dérivés en calculant ce que l’on appelle le score de risque de Framingham (FRS), qui est utilisé depuis des décennies pour prédire le risque de MCV. L’ATP III fournit des recommandations pour la stratification du risque en fonction de facteurs de risque multiples, du diabète et du syndrome métabolique. Les facteurs de risque de maladie coronarienne (MCV) comprennent l’hypertension (pression artérielle ≥140/90 ou utilisation d’un antihypertenseur) ; les antécédents familiaux (parent du premier degré atteint de MCV ) ; l’âge (homme, ≥45 ans ; femme, ≥55 ans) ; un taux de lipoprotéines de haute densité (HDL) supérieur à 40 mg/dL ; et le tabagisme. Un taux de HDL supérieur à 50 mg/dL est identifié comme étant cardioprotecteur et est donc considéré comme un facteur de risque « négatif ». En plus d’énumérer des facteurs de risque spécifiques de coronaropathie, l’ATP III identifie des équivalents de risque de coronaropathie (conditions qui confèrent un risque similaire d’événement coronarien). Les équivalents de risque de coronaropathie comprennent la maladie de l’artère carotide, l’anévrisme de l’aorte abdominale, la maladie artérielle périphérique, le diabète sucré ou un risque d’infarctus du myocarde (IM) sur 10 ans d’au moins 20 % (c’est-à-dire FRS ≥20 %).1,2
L’ATP III spécifie la lipoprotéine de basse densité (LDL) comme cible principale du traitement du cholestérol. L’atteinte des taux cibles de triglycérides (TG) et de HDL est généralement considérée comme un objectif secondaire. Les objectifs de cholestérol pour la population générale sont indiqués dans le TABLEAU 1.2
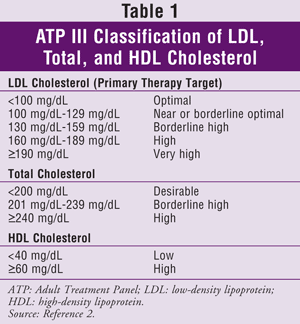
Une mise à jour de l’ATP III a été publiée en 2004.3 Cette version comprend une recommandation pour une réduction de 30 à 40 % du LDL de base chez les patients considérés comme présentant un risque modéré ou élevé de coronaropathie et des lignes directrices selon lesquelles un patient est considéré comme présentant un risque très élevé. Les patients à très haut risque peuvent inclure ceux qui présentent une MCV établie plus un ou plusieurs des éléments suivants : facteurs de risque majeurs multiples (p. ex., diabète) ; facteurs de risque graves et mal contrôlés (p. ex, La mise à jour de l’ATP III suggère également que des médicaments hypolipidémiants et un objectif de LDL inférieur à 100 mg/dL soient envisagés pour certains patients.3 Ces patients doivent présenter un risque de coronaropathie à 10 ans de 10 à 20 % et un taux de LDL compris entre 100 mg/dL et 130 mg/dL. Ils doivent également être d’un âge avancé et présenter des facteurs de risque sévères ; un taux de TG de 200 mg/dL ou plus, un taux de non-HDL de 160 mg/dL ou plus, et un taux de HDL de 40 mg/dL ou moins ; un syndrome métabolique ; ou des facteurs de risque émergents tels que la protéine C-réactive de haute sensibilité (hs-CRP) (<3 mg/dL) ou un calcium coronaire supérieur au 75e percentile pour l’âge et le sexe de la personne.
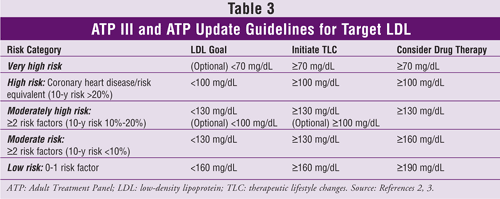
Les niveaux cibles de LDL, les recommandations de changements thérapeutiques du mode de vie et l’information sur l’initiation des médicaments hypocholestérolémiants (en fonction du nombre de facteurs de risque de MCV ou d’équivalents) de l’ATP III et de sa mise à jour sont indiqués dans le TABLEAU 3.2,3
Marqueurs de risque non traditionnels
La prédiction traditionnelle du risque de MCV repose en grande partie sur le SRF. Cette approche présente toutefois des limites, car on a constaté que le FRS surestime le risque dans les populations à faible risque et le sous-estime dans les populations à haut risque.4 En fait, la mort subite et l’infarctus non fatal sans symptômes préalables surviennent chez jusqu’à 25 % des patients atteints de coronaropathie.5 Comme indiqué précédemment, la mise à jour de l’ATP III recommande d’envisager un traitement lipidique plus agressif chez les patients présentant des facteurs de risque émergents.3 Au cours de la dernière décennie, la recherche s’est concentrée sur le rôle que jouent les facteurs de risque non traditionnels dans la physiopathologie des MCV. Le fibrinogène, le hs-CRP, le calcium coronaire et l’analyse de la sous-fraction des lipoprotéines ont fait l’objet de nombreuses recherches.
Bien que plusieurs marqueurs de l’inflammation aient été associés aux MCV, seuls ceux qui peuvent être mesurés facilement ont une valeur pratique.6 L’un de ces marqueurs inflammatoires est le hs-CRP.7 Un taux élevé de hs-CRP a été associé à un risque accru de MCV, d’accident vasculaire cérébral et de maladie vasculaire périphérique chez des patients avec ou sans athérosclérose connue. Les niveaux de hs-CRP ont été divisés en tertiles. Ces tertiles (<1,0 mg/l, 1 mg/l-3 mg/l et >3 mg/l) correspondent, respectivement, à des FRS de risque faible, modéré et élevé.8
L’essai clinique majeur le plus récent examinant l’utilité de la CRP pour prédire le risque cardiovasculaire est l’essai JUPITER.9 Cet essai comprenait spécifiquement des patients en bonne santé ayant un taux de cholestérol normal (LDL <130 mg/dL) et un taux de CRP élevé (>2 mg/dL). Ces patients ont été traités par 20 mg de rosuvastatine ou par un placebo afin d’évaluer le critère composite d’IM ou d’AVC non fatal ultérieur et le risque composite d’IM, d’AVC et de décès de cause cardiovasculaire. L’étude a été arrêtée après 1,9 an de suivi parce qu’on a constaté que le traitement par la rosuvastatine réduisait le critère composite de 44 % par rapport au placebo. Cette étude a fait date car elle démontre que des patients ne présentant aucun facteur de risque cardiovasculaire autre qu’une CRP élevée ont obtenu un bénéfice significatif du traitement par la rosuvastatine ; cependant, on ne connaît pas le rapport coût-efficacité du dépistage de la CRP élevée chez les personnes en bonne santé et de l’élargissement de la prescription de statines dans ces cas.
En dehors des statines, il a été démontré que d’autres agents hypolipidémiants (tels que la niacine, les fibrates et l’ézétimibe), ainsi que les thiazolidinediones et le raloxifène, réduisent les taux de CRP. Il est actuellement recommandé de prendre en compte les taux de hs-CRP dans le processus de décision thérapeutique pour les patients dont le risque de MCV prédit par le FRS est de 10 à 20 % dans les 10 prochaines années, et d’éviter de mesurer systématiquement le hs-CRP dans la population adulte générale.7,8,10
Le fibrinogène a également été étudié en tant que prédicteur non traditionnel du risque de MCV. Dans l’étude CARDIA (Coronary Artery Risk Development in Young Adults), un taux élevé de fibrinogène chez des sujets âgés de 25 à 37 ans a été associé à un risque accru de MCV subclinique au cours de la décennie suivante de la vie du patient10. Le fibrinogène joue un rôle important dans l’agrégation plaquettaire et la formation de fibrine, deux éléments clés de l’athérosclérose et de la formation de thrombus.1,11 Les patients de l’étude CARDIA qui présentaient des taux élevés de fibrinogène ont vu leur épaisseur intimale carotidienne et leur calcification coronarienne (CAC) augmenter au cours de la décennie suivante. Cependant, à l’heure actuelle, la mesure systématique des taux de fibrinogène n’est pas recommandée.10
La CAC se développe dans les artères coronaires athérosclérotiques et est pratiquement absente dans une paroi vasculaire normale. Des scores CAC plus élevés sont associés à une spécificité accrue, mais à une sensibilité réduite, pour la prédiction du risque cardiovasculaire. Il est toutefois important de noter que, bien que des scores CAC élevés soient corrélés à un risque accru de MCV, des événements cardiovasculaires peuvent toujours survenir chez un patient dont le score CAC est nul. La valeur pronostique de la mesure du CAC a fait l’objet de nombreux débats au cours de la dernière décennie. Depuis 2000, il est de plus en plus évident que le CAC peut être un facteur prédictif indépendant de l’issue cardiovasculaire, en plus des facteurs de risque traditionnels. En 2007, le comité d’écriture de l’American College of Cardiology Foundation/American Heart Association a publié un document de consensus concernant l’utilisation du CAC dans l’évaluation globale du risque cardiovasculaire.12 Le consensus du comité était de décourager le dépistage non sélectionné du CAC, car il a une valeur clinique limitée pour les patients à faible risque de coronaropathie (FRS <1%/an). Comme pour le hs-CR et le fibrinogène, la mesure systématique du CAC n’est pas recommandée ; cependant, les scores du CAC peuvent être un outil utile pour modifier la prédiction du risque et potentiellement le traitement de patients asymptomatiques à risque intermédiaire sélectionnés de manière appropriée.
La lipoprotéine(a), ou Lp(a), est identifiée dans les directives ATP III comme un facteur de risque de MCV émergent.2 Les lipides sont transportés dans tout le corps sous forme de complexes lipides-protéines appelés lipoprotéines. Les lipoprotéines varient en taille et en densité et sont désignées en conséquence comme LDL, HDL et lipoprotéine de très basse densité (VLDL). Les constituants protéiques de ces complexes sont appelés apolipoprotéines. La Lp(a), une forme modifiée de LDL, consiste en une molécule d’apoprotéine(a), ou apo(a), liée à la fraction d’apolipoprotéine B, ou apo(b), de la particule de LDL traditionnelle. Elle est similaire aux LDL tant par sa composition que par sa densité. On pense que, puisque le composant apo(a) de la Lp(a) est structurellement similaire au plasminogène, il peut entrer en compétition avec le plasminogène dans l’organisme et ainsi inhiber la fibrinolyse. En outre, la Lp(a) favoriserait l’accumulation de cholestérol, le développement de cellules spumeuses et la propagation des plaques d’athérome.1 Il a été démontré que la niacine et les œstrogènes réduisaient efficacement la Lp(a) ; cependant, aucune statine n’y parvient.13,14 Des taux élevés de Lp(a) ont été associés à un risque accru de MCV dans certaines populations étudiées, mais pas dans toutes.15 Actuellement, rien ne prouve que la surveillance ou la réduction des taux de Lp(a) soit cliniquement utile, et la mesure systématique n’est pas recommandée.16
L’apolipoprotéine(b) est le principal composant protéique non seulement des LDL, mais aussi des LDL de densité intermédiaire et des VLDL. Pour la prédiction du risque cardiovasculaire, la mesure des taux d’apo(b) et de cholestérol non-HDL a récemment été proposée comme étant supérieure à la mesure du cholestérol LDL.17 Dans une analyse post-hoc des études Treating to New Targets et IDEAL, il a été constaté que le cholestérol non-HDL (le produit de la soustraction du cholestérol HDL de la mesure du cholestérol total) et l’apo(b) étaient plus étroitement associés aux résultats cardiovasculaires que le cholestérol LDL.18,19 On suppose que les futures lignes directrices pourraient favoriser le cholestérol non HDL ou l’apo(b) plutôt que le cholestérol LDL comme cible principale du traitement ; actuellement, cependant, le LDL demeure la cible principale de la gestion du cholestérol.
L’hyperhomocystéinémie a été indépendamment liée à un risque accru de MCV, bien qu’elle ne soit pas aussi fortement associée que le FRS, et le mécanisme causal exact est inconnu20. Des défauts dans les voies de transmission des folates et de la B12 peuvent entraîner des taux élevés d’homocystéine, tout comme les régimes alimentaires déficients en folates ou en vitamines B6 et B12 et les médicaments qui interfèrent avec le métabolisme ou l’absorption de ces vitamines.1 L’insuffisance rénale et hépatique peut également entraîner une élévation du taux d’homocystéine. L’hyperhomocystéinémie est considérée comme assez rare. La population âgée peut présenter un risque accru de cette affection, en raison d’une carence en folates alimentaires. La mesure des taux d’homocystéine doit être effectuée lorsque le patient est à jeun, des taux élevés incitant à une évaluation de l’étiologie.
Enfin, l’analyse de la sous-fraction des lipoprotéines est un autre outil potentiel pour une stratification plus poussée du risque cardiovasculaire. On sait que la mesure des LDL comprend un spectre de particules LDL allant de celles qui sont petites et denses à celles qui sont plus légères et flottantes. On sait que les particules de LDL petites et denses confèrent un risque cardiovasculaire plus élevé.21 Plus le LDL augmente, plus les sous-fractions de LDL petites et denses augmentent. De même, les mesures du HDL total sont constituées d’un spectre de particules dont la taille et la densité varient. Les molécules HDL plus petites et plus denses ont un effet cardioprotecteur moindre. Lorsque les taux de HDL diminuent, on observe une augmentation marquée des petites particules de HDL. Sur la base de ces résultats, il a été suggéré qu’un taux élevé de LDL, un taux élevé de petites sous-fractions de LDL, un faible taux de HDL et un faible taux de grandes sous-fractions de HDL sont prédictifs de MCV. Les lignes directrices de l’ATP III reconnaissent que les petites particules LDL ont été identifiées comme une composante de l’athérogenèse et que les mesures des sous-fractions HDL peuvent contribuer à l’évaluation du risque de MCV. Toutefois, selon les lignes directrices, la capacité des sous-fractions de LDL à prédire les MCV indépendamment des autres facteurs de risque n’est pas bien définie. En outre, l’ATP III souligne que l’utilité clinique de la mesure des sous-fractions HDL n’a pas été établie. Pour cette raison et parce que des seuils significatifs et reproductibles pour la taille, la densité et le nombre de particules n’ont pas encore été établis, la mesure de la sous-fraction des lipoprotéines n’est pas utilisée dans la gestion de routine du traitement de l’hyperlipidémie ou dans la stratification du risque. Elle peut cependant être utile en complément de la stratification traditionnelle du risque pour déterminer l’agressivité du traitement chez un patient à risque intermédiaire.
Conclusion
Bien que les directives de traitement basées sur l’ATP III, qui s’appuient fortement sur le FRS, restent le noyau des recommandations de traitement dans les MCV, des indicateurs non traditionnels de MCV émergent comme adjuvants pour fournir une stratification du risque plus raffinée et aider à l’identification des patients avec une maladie subclinique précoce qui peuvent avoir besoin d’un traitement plus précoce et plus agressif.
1. Talbert RL. Hyperlipidemia. In : DiPiro JT, Talbert RL, Yee GC, et al, eds. Pharmacotherapy : A Pathophysiologic Approach. 7th ed. New York, NY : McGraw Hill Medical ; 2008:385-407.
2. National Heart Lung and Blood Institute. Troisième rapport du groupe d’experts sur la détection, l’évaluation et le traitement de l’hypercholestérolémie chez les adultes (Adult Treatment Panel III). www.nhlbi.nih.gov/guidelines/cholesterol/. Consulté le 1er novembre 2008.
3. Grundy SM, Cleeman JI, Merz CN, et al. Implications of recent clinical trials for the National Cholesterol Education Program Adult Treatment Panel III guidelines. Circulation. 2004;110:227-239.
4. Brindle P, Beswick A, Fahey T, Ebrahim S. The accuracy and impact of risk assessment in the primary prevention of cardiovascular disease : a systematic review. Heart. 2006;92:1752-1759.
5. Myerburg RJ, Kessler KM, Castellanos A. Mort cardiaque subite : épidémiologie, risque transitoire et évaluation de l’intervention. Ann Intern Med. 1993;119:1187-1197.
6. de Ferranti SD, Rifai N. C-reactive protein : un marqueur sérique non traditionnel du risque cardiovasculaire. Cardiovasc Cathol. 2007;16:14-21.
7. Koenig W, Sund M, Frölich M, et al. La protéine C-réactive, un marqueur sensible de l’inflammation, prédit le risque futur de maladie coronarienne chez les hommes d’âge moyen initialement en bonne santé : résultats de l’étude de cohorte MONICA (Monitoring Trends and Determinants in Cardiovascular Disease) Augsburg, 1984 à 1992. Circulation. 1999;99:237-242.
8. Pearson TA, Mensah GA, Alexander RW, et al. Markers of inflammation and cardiovascular disease : application to clinical and public health practice : a statement for health-care professionals from the Centers for Disease Control and Prevention and the American Heart Association. Circulation. 2003;107:499-511.
9. Ridker PM, Danielson E, Fonseca FA, et al. Rosuvastatin to prevent vascular events in men and women with elevated C-reactive protein. N Engl J Med. 2008;359:2195-2207.
10. Comité des maladies cardiovasculaires et métaboliques. Évaluation du risque de maladie cardiovasculaire avec des facteurs de risque non traditionnels : les dernières preuves. CMDManagement Insights Informat Cardiovasc Metabol Dis. 2008;13(2):1-3,6.
11. Mora S, Rifai N, Buring JE, Ridker PM. Additive value of immunoassay-measured fibrinogen and high-sensitivity C-reactive protein levels for predicting incident cardiovascular events. Circulation. 2006;114:381-387.
12. Greenland B, Bonow RO, Brundage BH, et al. ACCF/AHA 2007 Clinical Expert Consensus Document on coronary artery calcium scoring by computed tomography in global cardiovascular risk assessment and in evaluation of patients with chest pain. Un rapport de l’American College of Cardiology Foundation Clinical Expert Consensus Task Force (Comité d’écriture de l’ACCF/AHA pour mettre à jour le document de consensus d’experts de 2000 sur la tomographie informatisée à faisceau d’électrons). J Am Coll Cardiol. 2007;49:378-402.
13. Angelin B. Therapy for lowering lipoprotein (a) levels. Curr Opin Lipidol. 1997;8:337-341.
14. Brown BG, Zhao XQ, Chait A, et al. Simvastatine et niacine, vitamines antioxydantes, ou la combinaison pour la prévention des maladies coronariennes. N Engl J Med. 2001;345:1583-1592.
15. Moliterno D, Jokinen EV, Miserez AR, et al. No association between plasma lipoprotein(a) concentrations and the presence or absence of coronary atherosclerosis in African-Americans. Arterioscler Thromb Vasc Biol. 1995;15:850-855.
16. Bennet A, Di Angelantonio E, Erqou S, et al. Lipoprotein(a) levels and risk of future coronary heart disease : large-scale prospective data. Arch Intern Med. 2008;168:598-608.
17. Kastelein JJ, van der Steeg WA, Holme I, et al. Lipides, apolipoprotéines, et leurs ratios en relation avec les événements cardiovasculaires avec le traitement par statine. Circulation. 2008;117:3002-3009.
18. LaRosa JC, Grundy SM, Waters DD, et al. Intensive lipid lowering with atorvastatin in patients with stable coronary disease. N Engl J Med. 2005;352:1425-1435.
19. Pedersen TR, Faergeman O, Kastelein JJ, et al. High-dose atorvastatin vs usual-dose simvastatin for secondary prevention after myocardial infarction : the IDEAL study : a randomized controlled trial. JAMA. 2005;294:2437-2445.
20. Wald DS, Law M, Morris JK. Homocystéine et maladies cardiovasculaires : preuves de la causalité à partir d’une méta-analyse. BMJ. 2002;325:1202-1206.
21. Rizzo M, Berneis K. Taille des lipoprotéines de basse densité et évaluation du risque cardiovasculaire. QJM.2006;99:1-14.